SPATA 48 基因的多态性与男性少精症的相关性研究
2021-12-16孙文文李凤仙尹以瑞阿周存
孙文文,李凤仙,尹以瑞,阿周存*
(1.大理大学基础医学院,云南大理 671000;2.大理大学农学与生物科学学院,云南大理 671003)
生精障碍是男性不育的主要病因之一,临床上主要表现为无精症和少精症。研究表明,生精障碍的发病与遗传因素密切相关〔1-2〕。目前为止,虽然发现了一些生精障碍的遗传因素,但仍有大量与生精障碍相关的基因有待进一步研究。精子发生是一个众多基因参与的复杂过程,其中任何一个基因的异常均有可能导致生精障碍〔3〕。因此,生精发生相关基因的研究,对生精障碍遗传病因学有重要意义。生精相关(spermatogenesis-associated,SPATA)基因家族由一组在睾丸中表达的基因组成。在动物中的研究显示,SPATA 基因家族在生精过程的多种细胞活动中发挥重要作用,如减数分裂、细胞凋亡、精子的生成和生殖细胞的发育等〔4-6〕。因此,SPATA 基因也被认为是人类生精障碍的重要候选基因。近些年来,一些SPATA 家族成员已被证实与人类的生精障碍有关〔7-8〕,但多数家族成员与生精障碍的关系还有待进一步研究阐明。
SPATA 48 基因是最近鉴定出的SPATA 基因家族的一个重要成员,它与人类生精障碍的关系还不完全清楚。本研究对SPATA 48 基因中的2 个常见单核苷酸多态(single nucleotide polymorphism,SNP)位点rs12672941 和rs998928 的多态性与少精症的相关性进行调查,初步了解SPATA 48 基因与少精症的关系。
1 材料与方法
1.1 研究对象 病例组包括来自四川大学华西医院和大理大学第一附属医院的279 例少精症患者(精子密度小于15×106个/mL),对照组包括234 个精子密度正常的男性。所有研究对象均签署知情同意书。
1.2 试剂和仪器 DNA 提取试剂盒(TIANGEN 公司,批号:DP304);dNTPs (TaKaRa 公司,批号:AJ30388A);PCR 引物(上海生工生物工程股份有限公司);Taq DNA 聚合酶(Fermentas 公司,批号:EP0404);ExoI 酶(Fermentas 公司,批号:EN0581);FastAP 酶(Fermentas 公司,批号:EF0654);Snapshot试剂盒(ABI 分司,批号:4323163);3730XL 基因测序仪(ABI 公司,美国);PCR 扩增仪(Eppendorf 公司,型号:AG22331);凝胶电泳仪(Bio-RAD 公司,型号:041BR);凝胶成像分析系统(Bio-RAD 公司,型号:GelDoc100)。
1.3 方法
1.3.1 PCR 扩增 用DNA 提取试剂盒(TIANamp Genomic DNA Kit)从200 μL 外周血中提取基因组DNA。rs12672941 和rs998928 的PCR 扩增引物序列、扩增片段长度见表1。PCR 扩增反应的体积为15 μL,反应条件为:94 ℃预变性5 min,35 个循环(94 ℃,30 s;55 ℃,30 s;72 ℃,30 s),72 ℃延伸3 min。
1.3.2 PCR 纯化 用ExoI 酶和FastAP 酶进行纯化。 反应体系为:PCR 产物3 μL,ExoI 酶4 U,FastAP 酶1 U,ExoI 缓冲液0.7 μL,用水补至7 μL。反应条件为:37 ℃保温15 min,然后80 ℃保温15 min。
1.3.3 Snapshot 基因分型 利用Snapshot 试剂盒(SNaPshotTMMultiplexKit) 进行延伸反应。Snapshot延伸反应的引物序列见表1。反应体系为:纯化后的PCR 产物2 μL,Snapshot Mix 试剂1 μL,每条引物2 μmoL,用水补至6 μL。反应条件:96 ℃变性1 min,30 个循环(96 ℃变性10 s;52 ℃退火5 s),60 ℃延伸30 s。延伸反应结束后,取1 μL 延伸产物进行测序分型。对不同基因型的部分标本进行PCR产物直接测序,验证Snapshot 基因分型结果。

表1 PCR 扩增的引物序列和扩增产物大小,Snapshot 延伸引物序列
1.3.4 统计学分析 用Hardy-Weinberg 平衡在线计算器进行Hardy-Weinberg 平衡检验。用χ2检验比较病例组和对照组之间等位基因和基因型频率之间的差异,检验水准设为0.05,P<0.05 为差异有统计学意义。
2 结果
SPATA48 基因SNP 位点rs12672941 和rs998928的等位基因和基因型分布见表2。如表2 所示,rs998928 的等位基因频率和基因型频率分布在病例组和对照组之间无显著性差异(P >0.05);rs12672941 等位基因频率和基因型频率分布在病例组和对照组间的差异具有统计学意义,等位基因C (28.5% vs. 22.8%,P = 0.040,OR=1.344,95%CI 为1.013~1.785)和含有C 等位基因的(TC/CC)基因型频率(49.8% vs. 40.6%,P = 0.037,OR = 1.453,95%CI 为1.023~2.063)显著高于对照组,而病例组TT 基因型频率(50.1% vs.59.4%,P = 0.037,OR =0.688,95%CI为0.485~0.978)显著低于对照组。
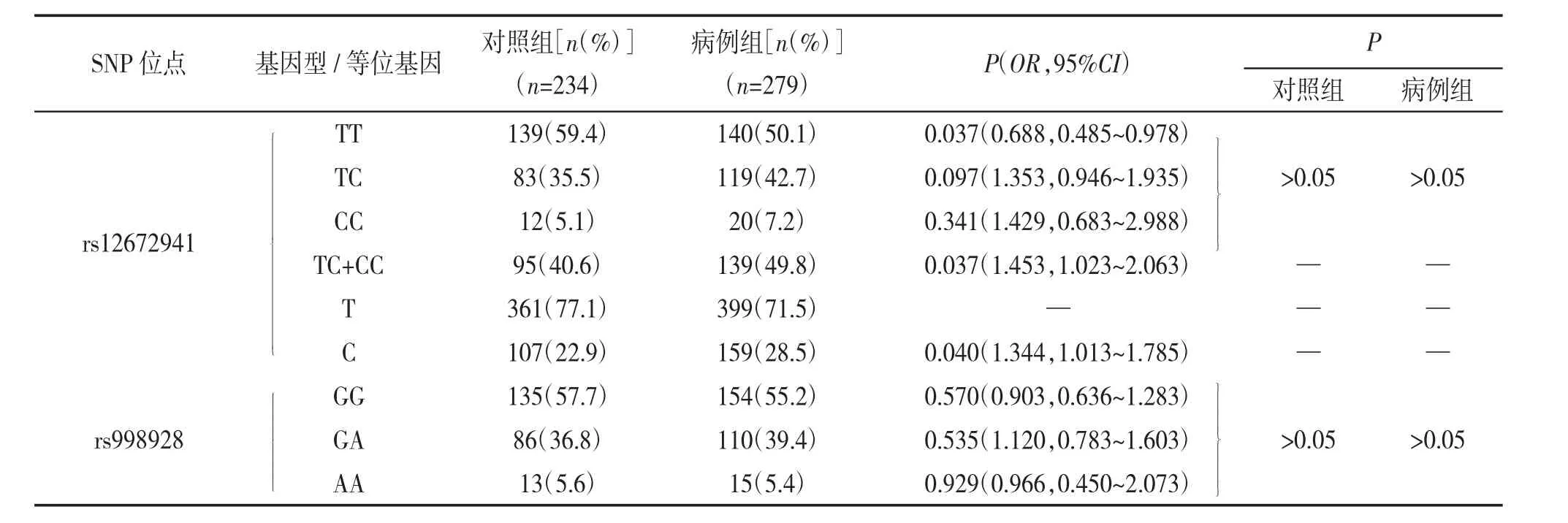
表2 rs12672941 和rs998928 的等位基因频率和基因型频率在对照组和病例组的分布
Hardy-Weinberg 平衡检验结果显示,SPATA 48基因SNP 位点rs12672941 和rs998928 基因型分布在病例组和对照组中符合Hardy-Weinberg 平衡,提示本研究的研究对象具有群体代表性。Snapshot 基因分型技术结果见图1,直接测序结果见图2~3。Snapshot 基因分型技术结果和直接测序结果一致,表明本研究Snapshot 基因分型技术的结果准确、可靠。

续表2
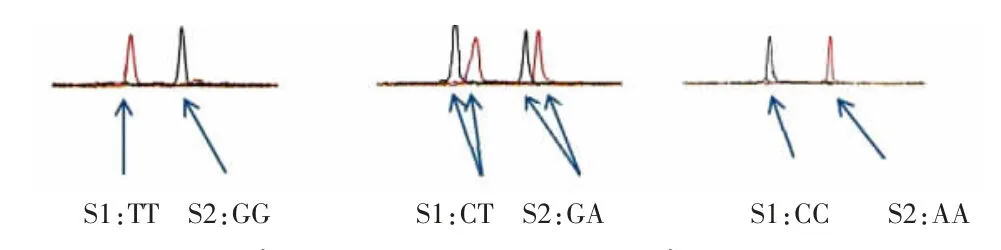
图1 Snapshot 基因分型技术结果
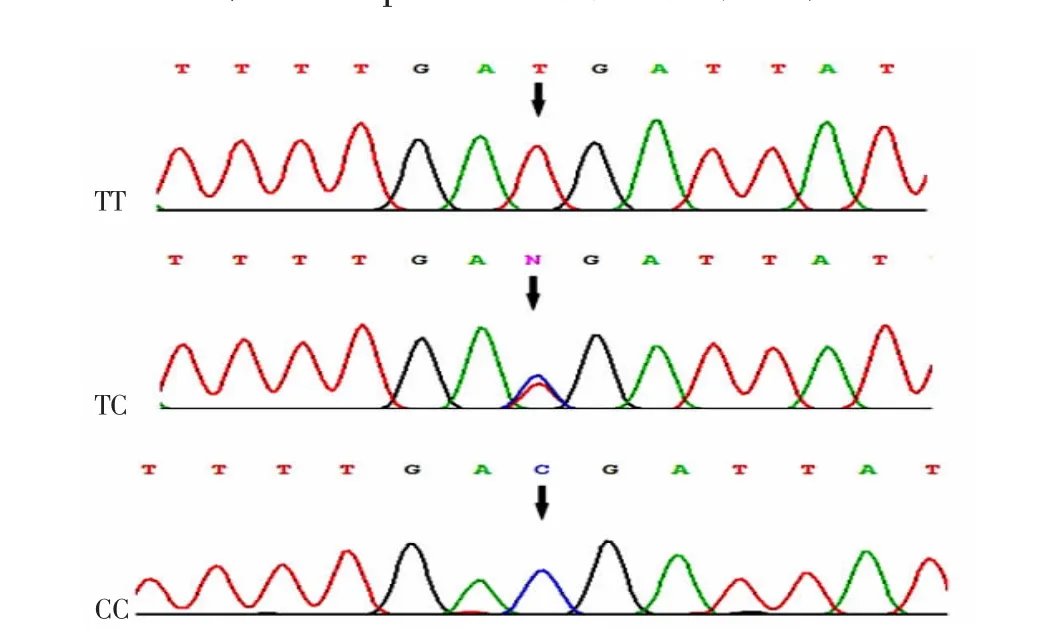
图2 SPATA 48 基因SNP rs12672941 位点的基因测序结果
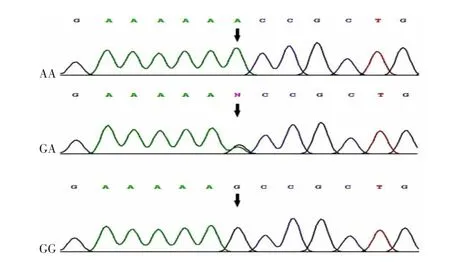
图3 SPATA 48 基因SNP rs998928 位点的基因测序结果
3 讨论
SPATA 48 基因是近些年来发现的一个人类生精障碍的重要候选基因,在基因敲出小鼠模型中的研究表明,SPATA 48 基因在精子发生过程中发挥重要作用,其异常与小鼠的生精障碍有关〔9〕。由于人和小鼠遗传背景的差异,SPATA 48 基因是否也与人类的生精障碍有关,还需要进一步的研究阐明。本研究在正常男性和少精症患者中,对SPATA 48基因的常见SNP 位点rs12672941 和rs998928 的等位基因频率和基因型频率进行调查和比较,从基因变异的角度来探索SPATA 48 基因与少精症的关系。研究的结果显示,SNP 位点rs12672941 的多态性分布正常男性和少精症患者之间存在显著差异,少精症患者中的等位基因C 和基因型TC+CC 的频率显著高于正常男性,而基因型TT 的频率则显著低于正常男性,提示等位基因C 和基因型TC+CC增加少精症的发病易感性,基因型TT 则降低少精症的易感性。上述结果表明,SPATA 48 基因的SNP rs12672941 多态性影响少精症的发病易感性。
SNP rs12672941 是一个内含子SNP,其T>C 变异并不影响SPATA 48 蛋白的氨基酸组成,但该变异邻近前体mRNA(precursor mRNA,pre-mRNA)的剪接点,提示它可能影响pre-mRNA 的剪接。因此,用ESEfinder 软件〔10〕对其影响作用进行了分析。ESEfinder 分析结果显示,SNP rs12672941 的T>C变异会导致一些pre-mRNA 剪接蛋白结合基序的改变,影响pre-mRNA 剪接,最终可能影响SPATA 48基因的表达。由于SPATA 48 基因在生精过程中发挥重要作用,其表达的改变可能影响正常的生精过程,引起生精异常。这可能是SNP rs12672941 影响少精症发病易感性的原因之一。
本研究首次对SPATA 48 基因的多态性与少精症的相关性进行调查,结果显示SPATA 48 基因的SNP rs12672941 的多态性影响少精症的发病易感性。这一结果提示,SPATA 48 基因也可能与人类少精症的发病相关。考虑到本研究样本量偏少,且研究种族的单一性,故本研究的结果还需在更大样本量和不同种族的研究中进一步证实。
