LC-MS/MS 法研究瓜蒌薤白胃内漂浮微丸在大鼠体内的药代动力学特征
2021-12-16鄢海燕孙德考邹纯才
鄢海燕,孙德考,2,邹纯才*
(1.皖南医学院药学院,安徽芜湖 241002;2.江苏开元药业有限公司,南京 222000)
瓜蒌薤白配伍使用源自张仲景的《金匮要略》,用于胸痹心痛等症〔1〕。临床多使用瓜蒌薤白汤治疗心血管疾病〔2〕。为延长瓜蒌薤白在胃内的滞留时间,提高生物利用度,减少患者服药次数,改善患者依从性,课题组前期研制了瓜蒌薤白胃内漂浮微丸(骨架型微丸,以下简称“瓜蒌薤白微丸”)〔3〕,瓜蒌薤白微丸中3,29-二苯甲酰基栝楼仁三醇(3,29-dibenzoyl-karounitriol,3,29-DK)的体外释放度符合2015年版《中华人民共和国药典》的要求。为进一步研究瓜蒌薤白微丸中3,29-DK 在体内释放情况,本研究利用液相色谱-质谱串联(LC-MS/MS)法研究瓜蒌薤白微丸中3,29-DK 在大鼠体内的药代动力学特征,评价瓜蒌薤白微丸在体内的释放效果。
1 仪器与材料
1.1 实验材料 瓜蒌薤白提取物、瓜蒌薤白微丸均由皖南医学院药物制剂及质量控制课题组制备,批号分别为:20190811、20190814;对照品3,29-DK(纯度≥98%)、路路通酸(纯度≥98%)均购自成都普菲德生物技术有限公司,批号分别为:150303、161019;甲醇为色谱醇;水为娃哈哈纯净水;其他试剂为分析纯。
1.2 实验仪器 液质联用仪(Agilent Technologies 1260 Infinity 液相色谱仪,6460 Triple QuadL C/MS,MassHunter 工作站,安捷伦公司);JW-3021HR 高速冷冻离心机(安徽嘉文仪器装备有限公司);SK-1型快速混匀器(常州国华电器有限公司)。
1.3 实验动物 SPF 级SD 大鼠12 只,雄性,体质量200~250 g,由南京青龙山动物养殖场提供,合格证号:SCXK(苏)2017-0001。本实验所用动物经皖南医学院医学伦理委员会批准同意。
2 方法与结果
2.1 动物分组 SPF 级SD 雄性大鼠12 只,适应性饲养1 周,随机分为瓜蒌薤白微丸组(2.0 g/kg)和瓜蒌薤白提取物组(1.4 g/kg),给药剂量为人(按60 kg计)日服用瓜蒌薤白(按25 g 计)的等效剂量,灌胃给药,给药前12 h 禁食不禁水。瓜蒌薤白微丸组于给药前0 h 及给药后第0.5、1、2、3、4、6、8、10、12、24、36、48 h 眼内眦取血0.5 mL 于肝素钠离心管内,瓜蒌薤白提取物组于给药前0 h 及给药后第5、10、30 min,1、1.5、2、3、4、6、8 h 眼内眦取血0.5 mL于肝素钠离心管内,4500 r/min 离心10 min,取血浆于试管内,-80 ℃条件下保存。
2.2 溶液的制备
2.2.1 3,29-DK 对照品溶液 取3,29-DK 对照品适量,精密称定,置于25 mL 容量瓶内,加甲醇定容至刻度。临用前,用甲醇稀释制得浓度为600 ng/mL的3,29-DK 对照品溶液。
2.2.2 路路通酸对照品溶液 取路路通酸对照品适量,精密称定,置于25 mL 容量瓶内,加甲醇定容至刻度。临用前,用甲醇稀释制得浓度为200 ng/mL的路路通酸对照品溶液。
2.2.3 瓜蒌薤白提取物溶液 参照课题组前期研究结果〔4〕,取瓜蒌、薤白,按3∶2(g/g)混合,以10 倍量的70%乙醇回流提取3 次,每次1 h,合并提取液,过滤、减压浓缩并制备瓜蒌薤白提取物干浸膏(每克瓜蒌薤白提取物干浸膏相当于瓜蒌薤白原药材8 g),临用时制备瓜蒌薤白水溶液4 g/mL(每毫升瓜蒌薤白水溶液相当于瓜蒌薤白提取物干浸膏4 g)。
2.3 LC-MS/MS 条件 Phenomenex-C18液相色谱柱(50 mm×4.60 mm,2.6 μm),流动相:甲醇-0.1%甲酸溶液(93∶7);流速:0.5 mL/min;柱温:35 ℃;进样量:5 μL〔5〕。
离子源:带有安捷伦喷射流技术的电喷雾离子源(AJSESI 离子源);检测方式:正离子模式;干燥气:氮气;干燥温度:350 ℃;干燥气流量:10 L/min;雾化器压力:40 psi(1 psi=6.89 kPa);毛细管电压:4000 V〔6〕。
在全扫描(MS2 Scan)模式下3,29-DK 和路路通酸的全扫描一级质谱图中均含有Na+,m/z 分别为689.3 和477.2([M+Na]+)。通过选择离子监测(SIM)模式分别优化3,29-DK 和路路通酸的碰撞电压,确定最优碰撞电压分别为90 V 和120 V。通过子离子模式(Product Ion Scan)分别优化3,29-DK 和路路通酸的碰撞能量,根据优化结果得到的质谱/ 质谱碎片谱图可知,最优碰撞能量分别为45 eV 和35 eV,3,29-DK 和路路通酸的扫描离子对分别为m/z 689.3→567.2 和m/z 477.2→209.0。见图1。
图1 3,29-DK 及路路通酸质谱图
2.4 血浆样品处理方法 取血浆、氨水溶液(pH=10) 和路路通酸对照品溶液各200 μL 涡旋混合30 s,加入2 mL 乙酸乙酯〔7〕,涡旋混合3 min,3 ℃,12000 r/min 离心5 min,取乙酸乙酯层,氮气挥干,加入100 μL 甲醇复溶,3 ℃,12000 r/min 离心5 min,取上清液5 μL 进行LC-MS/MS 分析。
2.5 LC-MS/MS 方法学考察
2.5.1 检测限与定量限 取“2.2”项下3,29-DK 对照品溶液(600 ng/mL)和路路通酸对照品溶液(200 ng/mL),用甲醇逐级稀释,按“2.3”项下条件测定3,29-DK 和路路通酸的检测限(S/N≥3)及定量限(S/N≥10)。结果显示,3,29-DK 和路路通酸的检测限分别为0.1、2.0 ng/mL,定量限分别为1.5、5.0 ng/mL。
2.5.2 专属性考察 分别取空白血浆(正常大鼠的血浆)、空白血浆加混合对照品、瓜蒌薤白微丸组血浆样品、瓜蒌薤白提取物组血浆样品,按“2.4”项下方法处理和“2.3”项下条件进样,结果表明,该法专属性较好。见图2。

图2 专属性考察结果图
2.5.3 标准曲线的建立 取“2.2.1”项下3,29-DK对照品溶液,用甲醇梯度稀释成6 份溶液(512、128、32、8、2、0.125 ng/mL) 并各取200 μL,氮气挥干,分别加入空白血浆200 μL 涡旋3 min,按“2.4”项下方法处理,按“2.3”项下条件测定血浆中3,29-DK 的浓度,并建立标准曲线。以3,29-DK 的浓度为横坐标(X,ng/mL),3,29-DK 和路路通酸峰面积的比值为纵坐标(Y),用加权法(W=1/X)进行回归运算,标准曲线回归方程为Y=0.018+0.014X,r=0.9925。结果表明,3,29-DK 在0.125~512 ng/mL 浓度范围内线性关系良好。
2.5.4 基质效应 取“2.2.1”项下3,29-DK 对照品溶液,制备512、32、2 ng/mL 的3,29-DK 对照品溶液,各取6 份,每份200 μL,备用。取空白血浆200 μL,除不加路路通酸对照品溶液外,其余按“2.4”项下方法处理,分别用512、32、2 ng/mL 的3,29-DK对照品溶液复溶,制备质控样品。按“2.3”项下条件进样,计算各质控样品的峰面积A1与对应浓度的3,29-DK 峰面积A2的比值,测定基质效应(A1/A2×100%)〔8〕。结果表明,血浆中内源性物质对3,29-DK 的测定无明显影响。见表1。
表1 基质效应测定结果(±s,n=6)

表1 基质效应测定结果(±s,n=6)
待测物 浓度/(ng/mL) 基质效应/%3,29-DK 51291.7±1.13285.4±19.6283.4±28.2
2.5.5 提取回收率 取“2.2.1”项下3,29-DK 对照品溶液,制备512、32、2 ng/mL 的3,29-DK 对照品溶液,各取6 份,每份200 μL,氮气挥干,分别加入空白血浆200 μL 涡旋3 min,按“2.4”项下方法处理,按“2.3”项下条件进样,根据标准曲线回归方程分别计算3,29-DK 的提取回收率,512、32、2 ng/mL的回收率分别为90.0%、94.4%和97.0%,平均回收率为93.8%,RSD 值为2.2%。结果表明,本法回收率较好,可满足生物样品的分析。
2.5.6 精密度与准确度 取“2.2.1”项下3,29-DK对照品溶液,制备512、32、2 ng/mL 的3,29-DK 对照品溶液,各取6 份,每份200 μL,氮气挥干,分别加入空白血浆200 μL 涡旋3 min,按“2.4”项下方法处理,“2.3”项下条件进样,经标准曲线回归方程计算分析,得到3,29-DK 的日内、日间精密度及准确度〔9〕。结果表明,本法精密度及准确度良好。见表2。
表2 3,29-DK 的日内、日间精密度及准确度结果(±s,n=6)

表2 3,29-DK 的日内、日间精密度及准确度结果(±s,n=6)
待测物 浓度/(ng/mL)日内精密度RSD/%日间精密度RSD/%准确度RE/%3,29-DK 5126.410.2 -8.6±6.6324.48.0 -9.0±8.125.23.5 -14.2±8.5
2.5.7 稳定性 取“2.2.1”项下3,29-DK 对照品溶液,制备512、32、2 ng/mL 的3,29-DK 对照品溶液,各取6 份,每份200 μL,氮气挥干,分别加入空白血浆200 μL 涡旋3 min,考察样品在室温条件下放置24 h、-20 ℃冻融3 次及-20 ℃冻融30 d 对3,29-DK 稳定性的影响,按“2.4”项下方法处理,按“2.3”项下条件进样,计算3,29-DK 峰面积,RSD 值均小于15%,符合生物样品质量控制要求。见表3。

表3 血浆中3,29-DK 稳定性结果(n=6)
2.6 药代动力学研究 血浆临用前,按“2.4”项下方法处理,“2.3”项下条件进样,测定各时间点血浆中3,29-DK 和路路通酸的峰面积,按标准曲线法计算血药浓度,采用DAS 2.0 软件的非房室模型方法计算药代动力学参数,SPSS 11.0 软件进行瓜蒌薤白微丸组与瓜蒌薤白提取物组的药代动力学参数统计分析。瓜蒌薤白微丸组与瓜蒌薤白提取物组血浆中3,29-DK 主要药代动力学参数见表4,药物浓度-时间曲线见图3。
表4 大鼠血浆中3,29-DK 的主要药代动力学参数(±s,n=6)

表4 大鼠血浆中3,29-DK 的主要药代动力学参数(±s,n=6)
注:与瓜蒌薤白提取物组比较*P<0.05,**P<0.01。
参数 瓜蒌薤白提取物组 瓜蒌薤白微丸组AUC(0-t)/(μg/(L·h)) 422.897±20.3421317.853±181.372*AUC(0-∞)/(μg/(L·h)) 425.662±20.9871327.788±169.994*AUMC(0-t) 870.637±42.82714590.146±2412.735**AUMC(0-∞) 895.860±62.24415547.649±2522.811 MRT(0-t)/h 2.060±0.08613.078±1.060*MRT(0-∞)/h 2.106±0.11813.753±1.581*VRT(0-t)/h2 2.098±0.27658.622±22.432**VRT(0-∞)/h2 2.439±0.57288.379±53.048 t1/2 /h 0.922±0.22811.136±2.555**Tmax /h 1.000±0.0008.000±0.000**CLz/F/(L/(h·kg)) 7839.142±390.550611.482±84.728**Vz/F/(L/kg) 10403.085±2539.3685647.633±3296.164*Zeta 0.793±0.2010.062±0.039 Cz(尾点回归值)/(μg/L) 1.824±1.2930.851±0.798 Cmax/(μg/L) 213.944±11.094142.120±14.831*
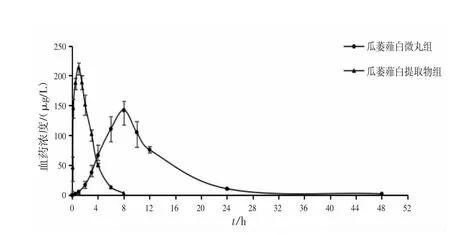
图3 大鼠血浆中3,29-DK 药物浓度-时间曲线(±s,n=6)
由表4、图3 可知,与瓜蒌薤白提取物组相比,瓜蒌薤白微丸组中3,29-DK 达峰时间、AUC和t1/2显著延长(P<0.05),MRT显著增加(P<0.05),CLz/F、Cmax明显降低(P<0.05),表明瓜蒌薤白微丸组中3,29-DK 在大鼠体内释放速率较为平稳,无突释、速释现象,代谢时间延长。
3 讨论
实验中曾尝试用常规的甲醇、乙腈使蛋白沉淀,然后采用乙酸乙酯萃取血浆中的3,29-DK 和路路通酸,结果发现沉淀的蛋白严重包裹3,29-DK,致使血浆中3,29-DK 含量过低甚至低于检测限,而且沉淀蛋白的样品中杂质较多,干扰3,29-DK 的测定。后改用乙酸乙酯直接萃取血浆中的3,29-DK,避免了蛋白沉淀包裹3,29-DK,而且杂质干扰少。
瓜蒌薤白微丸是在瓜蒌薤白汤剂的基础上研制的骨架型缓释制剂,药物从骨架材料中缓慢释放从而达到缓释效果。本实验比较了瓜蒌薤白微丸与瓜蒌薤白提取物在大鼠体内的药代动力学参数,发现与瓜蒌薤白提取物组相比,瓜蒌薤白微丸在大鼠体内有缓释效果。
