肾交感神经射频消融术可降低高血压犬血压并改善动脉硬度
2021-12-16史桂霞王晓艳张志辉曾丽雄
叶 飞,史桂霞,王晓艳,涂 珊,张志辉,曾丽雄
1中南大学湘雅三医院心内科,湖南 长沙 410013;2长沙卫生职业学院,湖南 长沙 410013
高血压流行形势日趋严峻,目前预计全球已逾10亿高血压患者,且每年超过900万例死亡与高血压的并发症有关[1]。肾交感神经射频消融术(RDN)是一项利用射频能量选择性去肾交感神经而降低高血压患者血压的介入技术。肾交感传入神经的激活可减少肾血流量及水盐排泄,传出神经的激活可能增加交感神经系统活性,而RDN则可能通过逆传上述机制降低血压,去肾交感的降压效应在大量动物实验及临床研究中也得到验证[2-5]。而高血压与动脉僵硬关系密切、互为因果[6],进一步研究也发现,RDN在降低患者血压的同时可降低血管阻力、改善动脉僵硬度[7,8]。此外,有证据表明在正常人群中交感神经活性与脉搏波传导速度相关,且这种相关性独立于血压、年龄、心率等因素[9]。但现有研究并未揭示RDN改善血管功能与降压效应之间的关系,交感神经活性等因素对于RDN改善血管功能作用的影响亦不明确,故本研究拟在高血压犬模型构建成功后,通过对其进行RDN干预以明确RDN对高血压犬血压及动脉硬度的影响,并探讨其可能的作用机制。
1 材料和方法
1.1 主要试剂、材料和仪器
犬一氧化氮(NO)ELISA试剂盒、犬内皮型一氧化氮合酶(eNOS)ELISA试剂盒、犬血管紧张素Ⅱ(Ang Ⅱ)ELISA试剂盒、犬去甲肾上腺素(NE)ELISA试剂盒(上海邦奕生物科技有限公司);肌酐测定试剂盒(富士胶片和光纯药株式会社);电子天平秤ES-1100(湘平科技发展有限公司);BP 2010-E 型智能无创动物血压测试仪(Softron Biotechnology);旋涡混合器(TAITEC);麻醉呼吸机Sunny2100A(瑞得伊格尔科技有限公司);低温离心机H2050R-1(湘仪实验室仪器开发有限公司);超纯水器Option-Q7(ELGA Labwater);温控水浴摇床OLS200(Grant);723型分光光度计(上海精密仪器仪表有限公司);酶联免疫检测仪(LABSYSTEMS DRAGON);7600-020 型全自动生化分析仪(日立);RDN所用超滑导丝(泰尔茂株式会社);一次性使用血管鞘(强生);一次性使用Y型阀和三联三通连通板(麦瑞通医疗设备有限公司);肾血管造影导管(泰尔茂株式会社);数字减影血管造影Allura Xper FD10(飞利浦);射频消融仪IBI 1500T及IBI肾动脉消融导管(圣犹达医疗用品有限公司);彩色多普勒超声LOGIQ7(GE)。
1.2 实验动物
实验开始2周前于上海实验动物中心购得10~12月龄同品系合格纯种比格犬共16只,雌雄各半,均委托中南大学湘雅动物部内分笼饲养。饲养间内设有照明系统、排风系统、饮水和投食等必要装置,饲养环境设定为:温度22±2 ℃,湿度(40~70)%,予以人工光照控制明暗周期各12 h。实验动物的管理及处置已经中南大学湘雅三医院伦理委员会批准(伦理审批号2017-S099),符合动物伦理管理要求。
1.3 实验方案
所有比格犬均打上耳标编号,根据性别不同采用随机数字表将16只犬按2∶1∶1的比例随机分为RDN组(n=8)、假手术组(n=4,sham组)和对照组(n=4,control组)。将RDN组与假手术组比格犬均构建成为高血压犬,RDN组比格犬进行RDN处理,术后3月复查肾动脉造影;假手术组仅在导管室操作台上行肾动脉造影而不实施RDN。对照组比格犬不实施上述有创性干预处理。
1.4 高血压犬动物模型的构建
采用高盐高脂饲养方案在3月内构建成高血压犬动物模型。对照组犬持续给予普通配方犬粮进行基础饲养,而RDN组与假手术组比格犬在普通配方犬粮基础上额外添加辅食并一直持续至实验结束。辅食富含钠盐及饱和脂肪酸,主要包括食用猪油、食盐、犬用罐头食品等,以满足高盐高脂饮食饲养的需要。
1.5 RDN的实施
1.5.1 术前准备 对实验犬进行背部及双侧腹股沟区备皮;然后应用法国维克舒泰(7 mg/kg)和速眠新(0.1 mg/kg)肌肉注射麻醉;麻醉成功后,犬取仰卧位固定于操作台上,并迅速行气管插管,接麻醉呼吸机监测心率、血压及血氧饱和度,同时粘贴射频消融电极背部贴片。
1.5.2 RDN 流程 腹股沟区常规消毒、铺巾,采用Seldinger法穿刺股动脉,置入6F动脉鞘;然后在超滑导丝引导下沿鞘送入5F肾动脉造影导管,将造影导管依次置于左右肾动脉开口处行选择性肾动脉造影;造影结束后撤回造影导管,Sham组完成上述流程后即结束操作、继续下文所述术后处理,RDN 组则沿鞘置入6F RDC指引导管于腹主动脉内;沿指引导管将5F 4 mm电极标准射频消融导管置于一侧肾动脉内,由远至近依次沿着肾动脉上、下、前、后壁进行螺旋形消融,消融模式为温度控制模式,温度控制在45~55 ℃,功率设定为8 W,每侧肾动脉消融3~4个点,每个点消融2 min直至阻抗逐渐下降10%以上,在消融过程中,必要时可经指引导管腔内行选择性肾动脉造影以进行定位;单侧肾动脉消融完毕后再按上述方法进行对侧肾动脉消融;双侧肾动脉消融结束后进行双侧肾动脉造影[10]。
1.5.3 术后处理 撤管、拔鞘,伤口以无菌纱布覆盖、压迫止血、绷带加压包扎;肌肉注射青霉素预防术后感染。
1.6 指标检测
1.6.1 体质量 清晨同一时间,在实验犬空腹、安静状态下采用电子秤进行测量,单位为kg,重复测量3次,取平均值;基线时间为适应性饲养1周后,高血压犬建模成功后或RDN术前及RDN术后3月需统一测量体质量,期间每2周进行1次体质量测量。
1.6.2 血压和心率 测量时间同1.6.1。在实验犬空腹、安静状态下采用智能无创动物血压仪测量比格犬清醒时尾动脉血压。先将比格犬置于犬固定架上,设置好血压仪的参数,待实验动物犬完全平静后将套袖轻轻放置于犬尾根部,仪器即可自动测量并在液晶屏幕上显示血压及心率值,如此重复测量3次,取其平均值,记录收缩压(SBP)、舒张压(DBP)及脉压(PP)。
1.6.3 实验室检测指标 采用酶联免疫吸附测定法测定实验犬血清NO、eNOS、Ang Ⅱ、NE的浓度,采用肌酐酶(HMMPS)法检测血清肌酐浓度。所有实验犬均在基线、高血压犬建模成功后及术后3月分批采血,采血途径均取实验犬一侧大隐静脉,采血量为3 mL;成功采集到血标本后,用低温离心机以3000 r/min的转速离心15 min后分离血清,将其置于超低温保存箱保存备用。
1.6.4 血管阻力指数(RI)检测前让实验犬充分饮水,背侧备皮;实验犬处于安静状态下,将超声探头置于肾动脉附近,缓慢调整探头方向直至获得稳定清晰的信号。根据多普勒超声仪软件中自动显示的数值记录肾动脉收缩期峰值流速(PSⅤ)以及舒张末期流速(EDⅤ),再根据公式RI=1-EDⅤ/PSⅤ计算RI值。重复测量3次,取其平均值为RI值。
1.7 统计学处理
所有数据统计均采用SPSS 20.0,定量资料以均数±标准差的形式描述,各组前后比较采用配对t检验,相关测定指标的组间比较采用单因素方差分析,LSD法用于3组间两两比较检验,若方差不齐则采用不等方差假设项下的Tamhane's T2或非参数检验。血压、RI、交感活性等指标变化的相关性分析采用Pearson相关分析方法。所有数据均符合正态分布。P<0.05认为差异具有统计学差异。
2 结果
2.1 实验动物一般资料
对所有比格犬进行基线资料的分析,结果显示RDN组、假手术组及对照组比格犬的平均SBP差异无统计学意义(P=0.868);平均DBP 差异无统计学意义(P=0.545)。3组比格犬基线水平的平均血压、RI、体质量、心率、血清肌酐浓度、eNOS浓度、NO浓度、Ang Ⅱ浓度及NE浓度差异无统计学意义(P均>0.05,表1)。

表1 实验动物犬基线特征Tab.1 Baseline characteristics and blood biochemical profiles of the beagles(Mean±SD)
2.2 RDN对血压的影响
2.2.1 收缩压变化 经3 月饲养,高血压动物模型均构建成功,RDN 组及假手术组实验犬血压均在140/90 mmHg以上。建模成功后,RDN组、假手术组及对照组比格犬的平均SBP差异有统计学意义(P=0.001)。对建模成功至术后3月的SBP变化幅度分析,RDN组、假手术组、对照组的SBP变化幅度差异有统计学意义(P=0.006),其中RDN组SBP降幅显著大于假手术组与对照组(P<0.05,图1)。
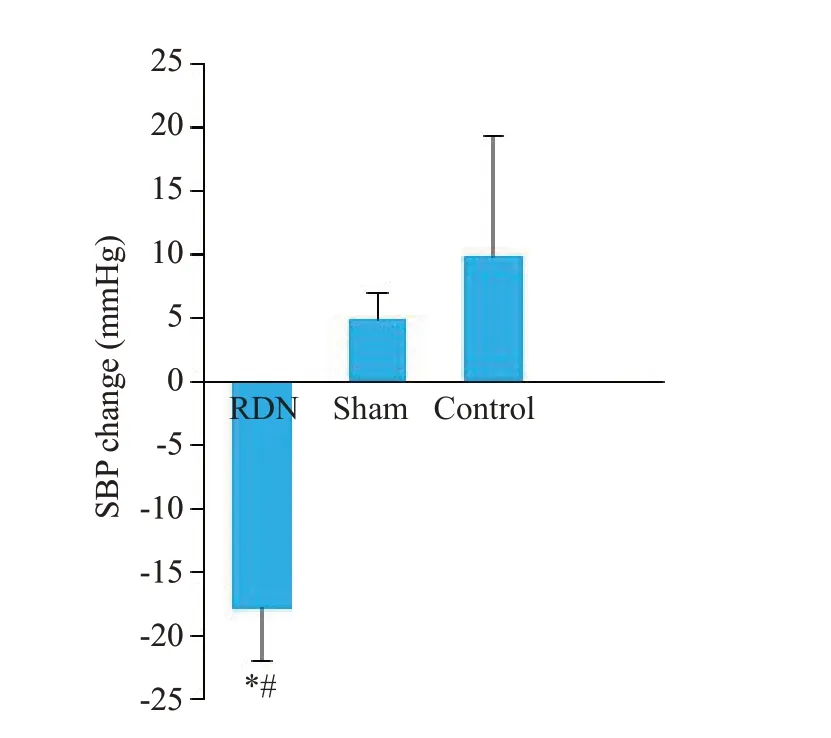
图1 RDN术前后实验动物SBP的变化幅度Fig.1 Amplitude of mean SBP variation in the 3 groups after RDN.*P=0.004 vs control group;#P=0.013 vs sham group.
2.2.2 舒张压变化 高血压犬建模成功后,RDN组、假手术组及对照组的平均DBP 差异有统计学意义(P=0.019)。从成功建模至术后3月,RDN组、假手术组、对照组的DBP变化幅度差异有统计学意义(P=0.016),其中RDN组DBP降幅显著大于对照组(P=0.007),但与假手术组比较,二者差异不显著(P=0.052,图2)。
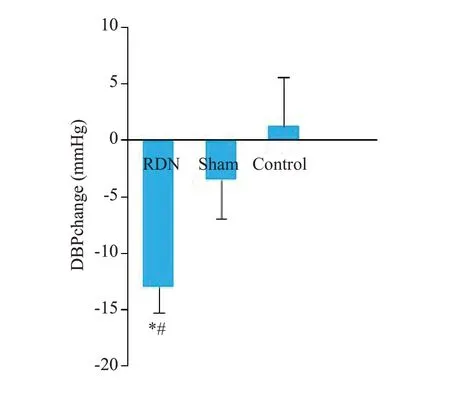
图2 RDN术前后实验动物DBP的变化幅度Fig.2 Changes of mean DBP in the 3 groups after RDN.*P=0.007 vs control group;#P=0.052 vs sham group.
2.3 RDN对动脉硬度的影响
建模成功后,RDN组、假手术组及对照组比格犬的平均RI差异有统计学意义(P=0.006)。从建模成功后到术后3月,RDN组、假手术组及对照组的RI变化幅度差异有统计学意义(P=0.043)。两两比较显示,RDN组RI降幅均显著大于与对照组及假手术组(P<0.05,图3)。
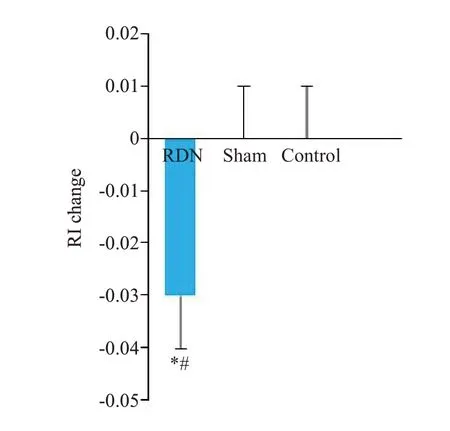
图3 RDN术前后实验动物RI的变化幅度Fig.3 Changes of mean RI in the 3 groups after RDN.*P=0.032 vs control group;#P=0.043 vs sham group.
2.4 RDN对血管内皮功能的影响
建模成功后及RDN术后,实验动物eNOS、NO及Ang Ⅱ的浓度组间比较均无统计学差异(P>0.05,表2、3)。

表2 建模后实验动物的血管内皮功能Tab.2 Vascular endothelial function of the beagles after modeling
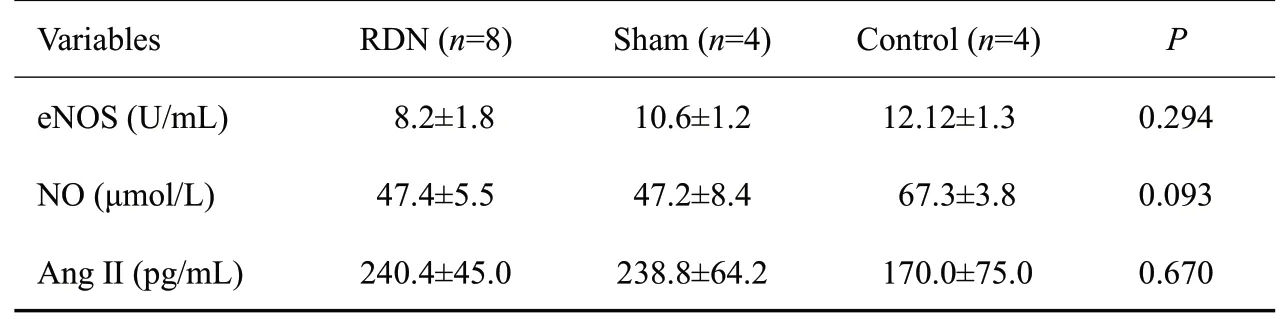
表3 RDN术后实验动物的血管内皮功能Tab.3 Vascular endothelial function of the beagles after RDN(Mean±SD)
2.5 RDN对交感活性的影响
建模成功后,RDN组、假手术组、对照组的平均NE浓度差异有统计学意义(P=0.020),两两比较显示RDN组NE浓度显著高于对照组(P=0.014),而与假手术组无显著差异(P=0.560)。
建模成功后至术后3月,RDN组、假手术组、对照组的NE浓度变化差异有统计学意义(P=0.032),且RDN组NE浓度降幅显著大于假手术组(P=0.014),但与对照组相比差异不显著(P=0.080,图4)。

图4 RDN术前后实验动物NE的变化幅度Fig.4 Changes of serum NE concentrations in the 3 groups after RDN.*P=0.080 vs control group;#P=0.014 vs sham group.
2.6 RDN组动脉硬度变化与血压、血管内皮功能及交感活性变化的相关性分析
RDN组比格犬RI的变化与SBP、DBP、NO浓度、NE浓度的变化存在显著相关(P<0.05),而与eNOS浓度、AngⅡ浓度的相关性无统计学意义(P>0.05,表4)。
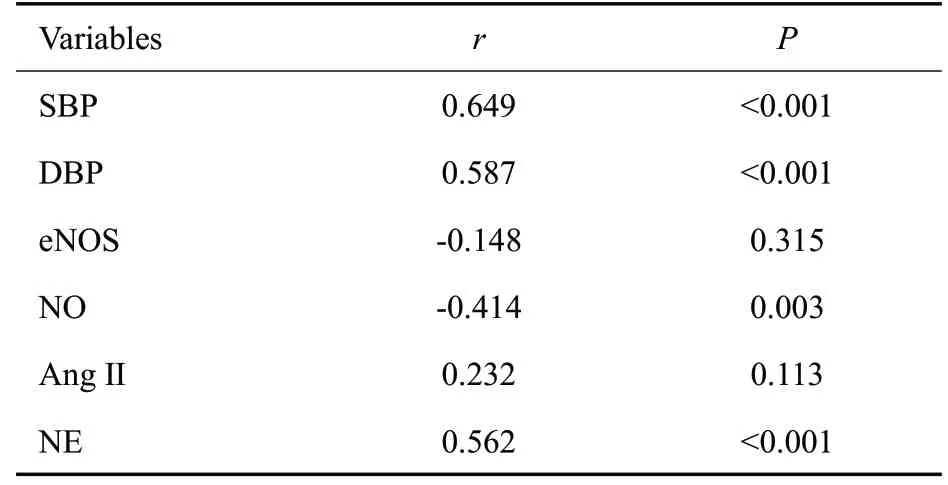
表4 RDN组RI的变化与血压、eNOS、NO、Ang Ⅱ及NE浓度变化的相关性Tab.4 Correlation analysis of the changes of RI in RDN group
2.7 RDN的安全性评价
RDN组有4条比格犬术后出现腹股沟血肿,通过压迫止血后血肿吸收消失;RDN组和假手术组分别有8条、3条比格犬在术中可监测到一过性心率减慢,最低至40 bpm,未予特殊处理后心率逐渐恢复正常,心率的一过性减慢考虑与麻醉药品的心脏抑制作用有关。术后3个月3组比格犬复测体质量、心率、血清肌酐差异均无统计学意义(P>0.05)。
3 讨论
RDN采用血管介入技术,利用置于肾动脉内的消融导管头端释放射频能量而对走行于肾动脉外膜的交感神经纤维造成透壁损伤,使其变性、坏死,以期达到持续降低动脉血压的目的。自RDN技术问世以来,其作用效应及相关机制引发了诸多争议[11]。早期临床研究显示RDN可有效降低患者血压[2,3,5],而随着Symplicity HTN-3研究结果的发布[12],这一项技术的降压效果备受质疑,甚至一度陷入沉寂。近年来,SPYRAL HTN-OFF MED、SPYRAL HTN-ON MED、RADIANCE-HTN SOLO等一系列随机对照临床试验采用改进的消融策略,其结果均显示了RDN 降压治疗的有效性[13-15]。RDN的降压作用在动物实验中也得到证实。有研究对9条肥胖性高血压猎犬进行了双侧RDN术,随访8周后发现收缩压由术前的157±5 mmHg降至133±3 mmHg(P<0.01),平均动脉压较术前亦降低了9 mmHg(P<0.01)[16]。Linz等[17]也发现RDN能够抑制阻塞性睡眠呼吸暂停综合征实验猪血压升高及心房颤动的发生。本研究结果显示,高血压犬经RDN治疗后,其收缩压、舒张压均与基础饲料喂养的对照犬类似,两组比较均无统计学差异,这表明RDN可抑制高盐高脂饮食的升血压作用,进一步佐证了RDN的降压效应。高血压是动脉压力的持续升高,可引起血管结构的损害和动脉硬化的形成,进而可导致全身多处靶器官损害,同时血管功能的改变亦可能引起外周血管阻力增加而导致血压持续升高,二者可谓相互作用、互为因果[6]。Brandt等[8]发现110例顽固性高血压患者接受RDN术后,在6个月随访时不但血压明显下降,反映血管僵硬度的指标如脉搏波传导速度、主动脉增强指数较对照组也均有显著降低。Ott等[7]的研究结果也提示RDN在降低患者血压同时可降低血管阻力、改善动脉僵硬度。Tsioufis等[18]对9头家猪实施了RDN术,以了解RDN对肾脏血流动力学影响的急慢性效应,结果发现无论是术后即刻还是术后一月,RDN均能够改善肾血流动力学状况,其中RI值出现了显著降低。RI作为肾脏疾病终点事件的预测因子,可反映肾脏内灌注情况的变化,也能够反映全身动脉僵硬程度,RI值的升高提示动脉僵硬度增加、血管顺应性的下降和亚临床动脉硬化的发生[19]。本研究发现,RDN可显著降低高血压犬的RI值,提示RDN能够降低外周血管阻力、改善动脉弹性。同时,我们也看到,随着RDN组和假手术组实验动物犬血压逐渐升高,RI值也较对照组出现了显著的升高,而经RDN治疗后高血压犬逐步恢复了与对照组相当的RI水平。这也说明血压的升高伴随着外周血管阻力的增加和血管弹性功能的下降,而血压下降的同时亦并存动脉硬度的改善。
血管功能的改变与动脉硬化的形成和血管内皮的作用息息相关[20]。血管内皮是血管壁的生理屏障,还具有重要的合成分泌功能,可直接调控和影响血管舒缩功能。内皮可分泌产生AngⅡ等血管活性物质调控血管的舒张、收缩,以维持血管张力和保持其顺应性[21]。其中AngⅡ是重要的血管收缩因子,该物质可直接作用于血管平滑肌细胞,抑制NOS合成NO,NO分泌减少可引起血管舒张功能下降、动脉僵硬度增加,同时AngⅡ可以激活交感神经系统释放去甲肾上腺素而引起血管收缩[22]。多种心血管危险因素则可通过氧化应激等方式降低NO的生物活性,而最终导致血管结构和功能发生改变[23]。血管功能减退、动脉壁粘滞度增加也被证实与严重的内皮功能障碍有关[24]。本研究对内皮功能进行了评价以期能够进一步明确RDN对血管功能影响的机制。研究结果未显示血管内皮功能在不同实验动物组之间存在有显著差异,RDN改善动脉僵硬度的作用与血管内皮功能改变似无直接关联。我们发现高血压比格犬出现了NE浓度的明显升高,而经RDN治疗后,高血压犬虽未能恢复与对照组相似的水平,但较未经RDN治疗者的NE水平显著降低,这表明RDN通过去肾交感神经的方式能够显著降低机体交感活性。而近期有研究报道交感系统活性与中心和外周动脉僵硬存在密切关系[25]。本研究进一步分析结果显示RI值的变化与血压、血清NO以及NE浓度均存在显著相关性,其中,RI与血压、血清NE浓度水平存在正相关,意指血压升高越明显、交感活性越高,伴随而来的血管阻力会越大、动脉功能受损也越严重;血清NO浓度与RI存在负相关,表明血管内皮的合成分泌功能对于动脉弹性具有重要的保护作用。上述结果表明,RDN改善血管弹性的作用与神经、体液因素均存在相关性,且这一作用可能与降低交感活性、促进NO合成有关。目前临床上尚缺乏明确方法或效应指标用于RDN消融终点及即时疗效的判定,但研究显示消融导管记录的阻抗变化可以在手术过程中提供即时反馈而可用于监测和评估RDN消融效果[26,27]。消融过程中阻抗逐渐下降10~20%表明导管良好的组织贴靠和有效的消融,而阻抗迅速下降意味着导管贴靠不佳、阻抗迅速升高则提示局部焦痂形成。在心脏消融手术中,术者可以采用压力感应导管通过观察导管贴靠压力实时监测消融效果,但由于比格犬肾动脉内径细小,无法置入压力感应导管而只能采用口径较小的非压力感应消融导管,因此本研究采用监测阻抗变化的方法以确保消融效果。另外,动物实验数据表明从肾动脉血管内腔到肾交感神经距离的中位数为2.1 mm、第75百分位数为4.4 mm[28]。在保证导管良好贴靠的情况下,RDN 术中6 W/60 s 的消融方式可以达到平均6.5 mm的组织损伤深度[26],而实现绝大部分肾交感神经的消融损伤。参考类似研究的消融方案[27,29],我们采用8 W/120 s的消融策略,在监测温度和阻抗的情况下沿着肾动脉进行螺旋形分区消融以期达到有效地去肾交感神经治疗目标。我们的前期研究结果也验证了这一方法的可行性和可靠性[10]。
本研究亦存在一定局限性,如未能进一步明确RDN对血压及血管功能影响的具体分子机制及作用通路,也未能揭示血压降低与交感活性改变之间的因果关系;此外,由于比格犬体型较小,血管条件较差,未必能够完全反映高血压患者机体真实改变的情况。
综上所述,对于高盐高脂饮食构建的高血压犬模型,RDN能够安全有效降低其血压和改善动脉僵硬度,其中对动脉硬度的改善可能与交感活性和血压的降低及促进NO合成有关。本研究对于RDN影响血管功能的作用机制提供了一定的理论依据。
