慢性萎缩性胃炎Hp感染患者胃黏膜形态及IL-34、PLR水平探讨
2021-12-16杨小乔梁彪叶丽芳吴嘉钏陈睿妍谭文惠
杨小乔 梁彪 叶丽芳 吴嘉钏 陈睿妍 谭文惠
作者单位:广东省第二人民医院消化内镜中心,广东,广州510317
慢性萎缩性胃炎(Chronic atrophic gastritis,CAG)是胃黏膜炎症向癌变转化的关键点,被定义为癌前状态,与胃癌紧密联系[1]。CAG 内镜下表现有时并不十分典型,诊断准确率无法完全满足临床需要,胃镜活检仍是确诊的金标准,但该方法为侵入性检查,且无法对患者病情进展及预后做动态监测[2]。CAG 致病机制尚待阐明,幽门螺旋杆菌(Helicobacter pylori,Hp)感染是重要危险因素之一[3]。白细胞介素-34(Interleukin-34,IL-34)、血小板/淋巴细胞之值(Platelet - lymphocyte ratio,PLR)是新的炎症标志物,已有研究报道,二者对慢性胃炎患者预后有一定预测价值[4]。Hp感染会刺激胃粘膜发生炎性反应,而IL-34、PLR 在Hp感染引起CAG 中的作用尚有待明确。本研究首次分析典型胃黏膜形态结合血清IL-34、PLR水平检测与CAG 患者HP 感染关联性及临床意义,为深入研究CAG 致病机制提供依据。报道如下。
1 资料与方法
1.1 一般资料
选取2019年1月至2020年2月本院268 例CAG 患者,根据有无Hp感染分组,其中感染组(n=140)、未感染组(n=128)。纳入标准:均符合《慢性萎缩性胃炎中西医结合诊疗共识意见(2017年)》[5]中相关诊断标准,并经胃镜活检确诊;感染组13C 尿素呼气试验阳性;3 个月内未服用抗生素、益生菌、质子泵抑制剂等可能影响检测结果的药物;患者及家属知情同意。排除标准:上消化道手术史;入组前4 周出现急性感染或重大刺激;自身免疫性疾病;其他重要器官严重疾病,如恶性肿瘤、心功能不全等;长期使用非甾体类抗炎药;妊娠期或哺乳期女性。所有患者及家属均知情同意,本研究经本院医学伦理委员会审批同意。
1.2 方法
①内镜下诊断及形态分类:采用奥林巴斯H260 胃镜完成检查,诊断参照《中国慢性胃炎共识意见(2012年,上海)》[6],镜下表现为黏膜红白相问,以白为主,部分区域血管可见,皱褶浅平甚至消失,伴或不伴颗粒状改变。形态分类:颗粒型:胃窦黏膜表面弥漫性颗粒样改变;灰白型:病变区域呈现大片灰白样改变;浅凹陷型:病变处黏膜层变薄,相对发白,周围黏膜发红,与正常组织分界清晰,中央小血管透见。②血清IL-34、PLR 测定:入组24 h 内,取空腹静脉血4 mL,离心(半径8 cm,3 500 r/min,9 min),取血清,IL-34 采用酶联免疫吸附法检测(上海通蔚生物科技有限公司试剂盒);通过血常规结果计算PLR。
1.3 统计学方法
采用统计学软件SPSS 22.0 处理数据,计数资料以n(%)描述,计量资料以()描述,两组间比较用t检验;多组间比较用F检验。影响因素采用Logistic 回归分析;预测价值采用受试者工作特征(ROC)曲线,获取曲线下面积(AUC)、置信区间、敏感度、特异度及cut-off 值,联合预测实施Logistic 二元回归拟合,返回预测概率logit(p),将其作为独立检验变量。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床资料对比
两组性别、年龄、BMI、病程、吸烟及饮酒率相比,差异无统计学意义(P>0.05),感染组胃炎分型及萎缩程度分型相比,差异有统计学意义(P<0.05)。见表1。
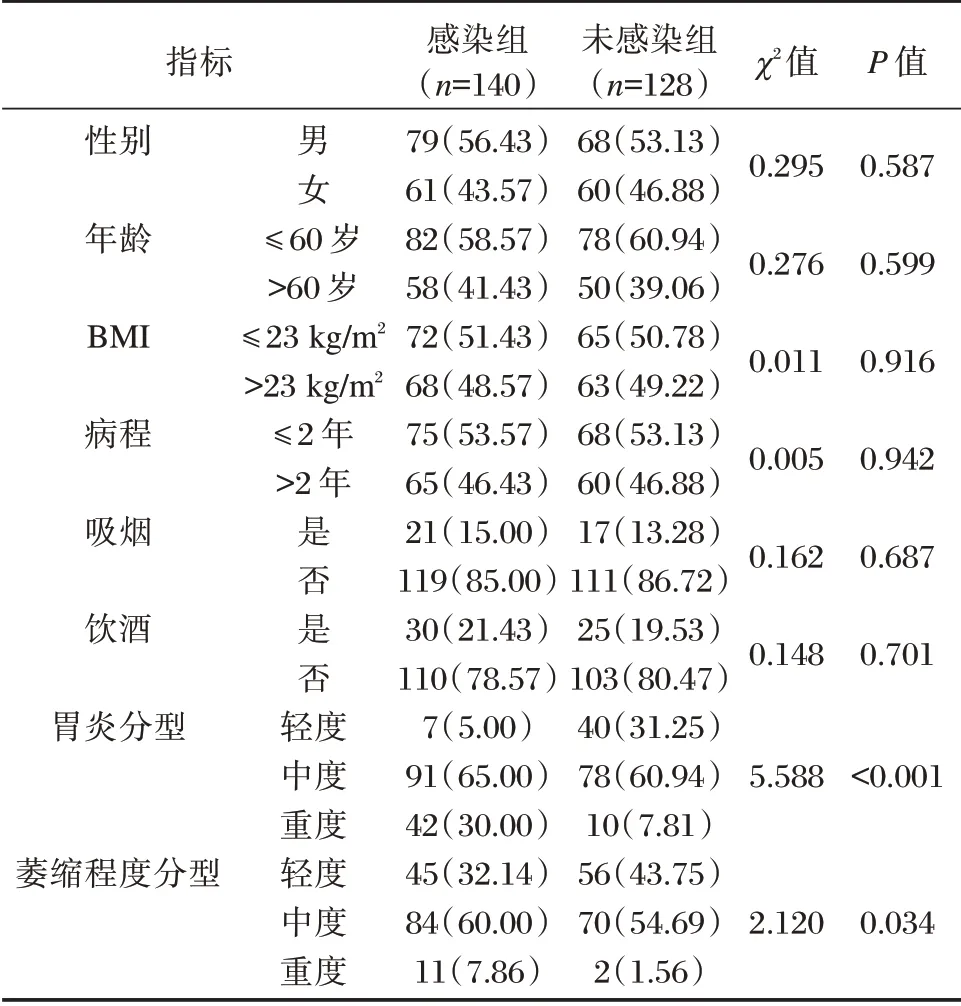
表1 两组临床资料对比[n(%)]Table 1 Comparison of clinical data between the two groups[n(%)]
2.2 两组典型胃黏膜形态、血清IL-34、PLR水平
两组典型胃黏膜形态、血清IL-34、PLR水平相比,差异有统计学意义(P<0.05)。见表2。胃镜下典型胃黏膜形态见图1。
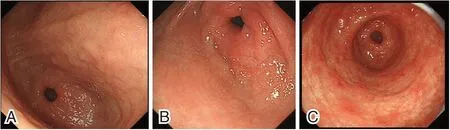
图1 胃镜病理图(×85)Figure 1 Gastroscopic pathological view(×85)
表2 两组典型胃黏膜形态、血清IL-34、PLR水平对比[n(%),(±s)]Table 2 Comparison of typical gastric mucosal morphology,serum IL-34 and PLR levels between the two groups under endoscope[n(%),(±s)]
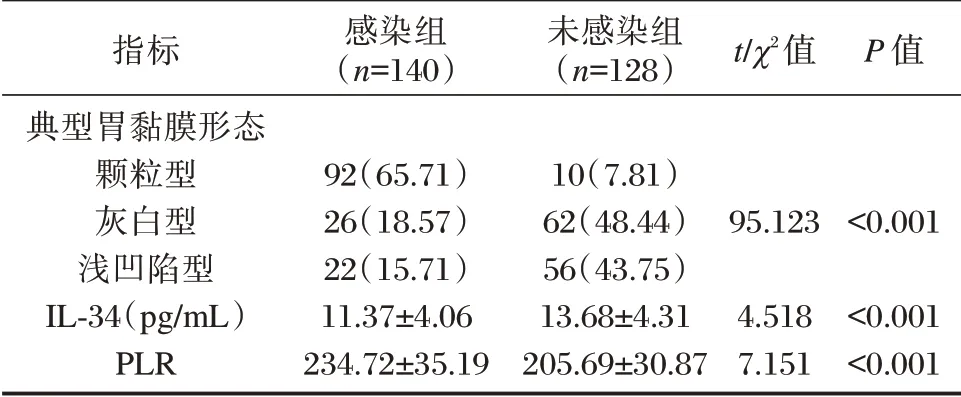
表2 两组典型胃黏膜形态、血清IL-34、PLR水平对比[n(%),(±s)]Table 2 Comparison of typical gastric mucosal morphology,serum IL-34 and PLR levels between the two groups under endoscope[n(%),(±s)]
指标典型胃黏膜形态颗粒型灰白型浅凹陷型IL-34(pg/mL)PLR感染组(n=140)92(65.71)26(18.57)22(15.71)11.37±4.06 234.72±35.19未感染组(n=128)10(7.81)62(48.44)56(43.75)13.68±4.31 205.69±30.87 t/χ2值95.123 4.518 7.151 P 值<0.001<0.001<0.001
2.3 血清IL-34、PLR水平与典型胃黏膜形态的关系
CAG Hp感染患者中,颗粒型患者IL-34水平低于灰白型、浅凹陷型,PLR 高于灰白型、浅凹陷型,差异有统计学意义(P<0.05)。见表3。
表3 血清IL-34、PLR水平与典型胃黏膜形态的关系(±s)Table 3 The relationship between serum IL-34,PLR levels and typical gastric mucosal morphology under endoscopy(±s)
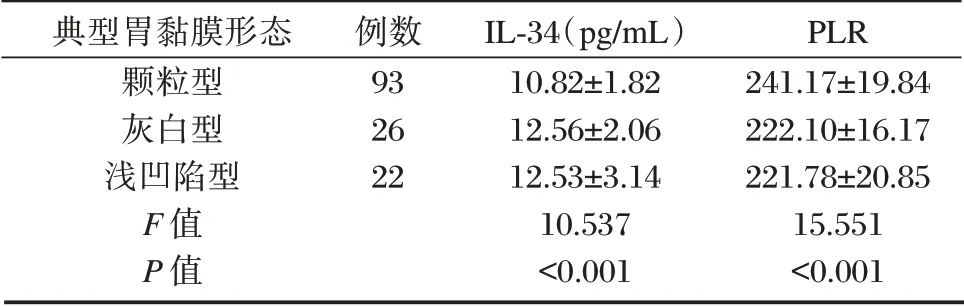
表3 血清IL-34、PLR水平与典型胃黏膜形态的关系(±s)Table 3 The relationship between serum IL-34,PLR levels and typical gastric mucosal morphology under endoscopy(±s)
典型胃黏膜形态颗粒型灰白型浅凹陷型F 值P 值例数93 26 22 IL-34(pg/mL)10.82±1.82 12.56±2.06 12.53±3.14 10.537<0.001 PLR 241.17±19.84 222.10±16.17 221.78±20.85 15.551<0.001
2.4 CAG 患者Hp感染影响因素
以Hp感染为因变量(赋值:未感染=0,感染=1),将上述有差异因素纳入Logistic 回归分析,结果显示,胃炎分型、萎缩程度分型、胃黏膜呈颗粒型、IL-34、PLR 均为CAG 患者Hp感染的影响因素(P<0.05)。见表4。
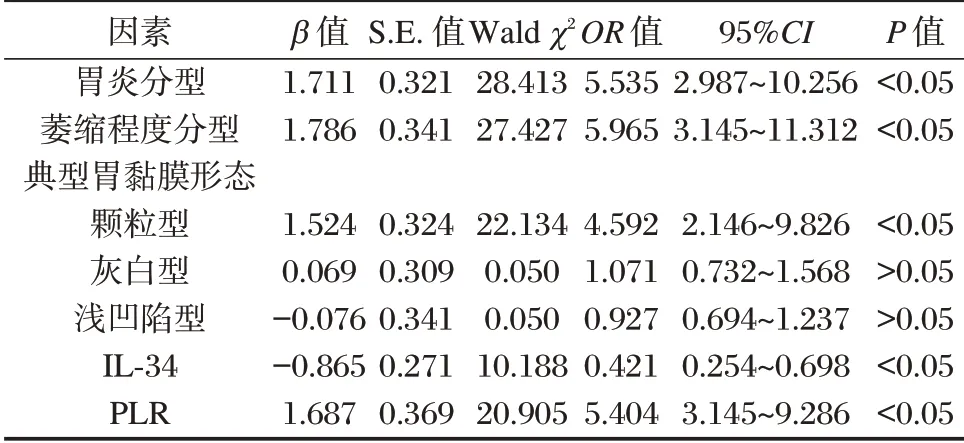
表4 CAG 患者Hp感染影响因素Table 4 Influencing factors of Hp infection in CAG patients
2.5 典型胃黏膜形态、血清IL-34、PLR水平对CAG 患者Hp感染诊断价值
绘制典型胃黏膜形态、血清IL-34、PLR水平对CAG 患者Hp感染的诊断价值的ROC 曲线,显示典型胃黏膜形态、血清IL-34、PLR水平联合诊断AUC均为最大,为0.854,最佳敏感度为70.71%,特异度为87.50%(P<0.05)。见表5,图2。
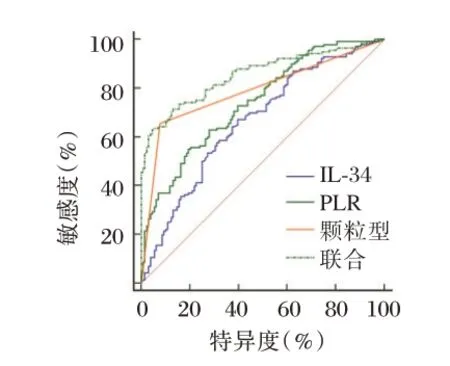
图2 ROC 曲线Figure 2 ROC curve
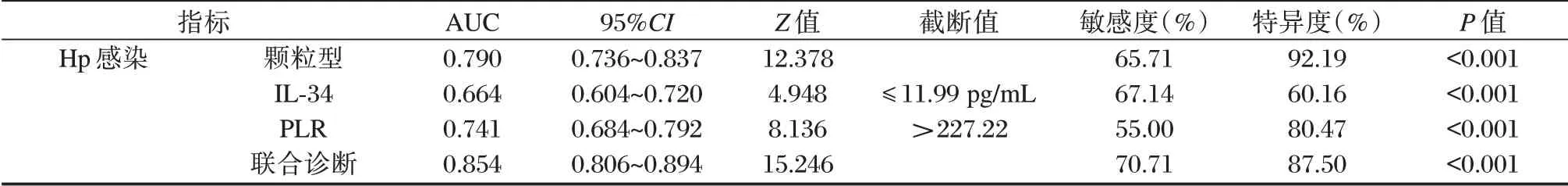
表5 ROC 曲线相关数据Table 5 ROC curve related data
3 讨论
目前,病理学检查仍是CAG 确诊的金标准。近年来,随内镜技术发展,内镜下CAG 确诊率显著升高,但总体准确率并不十分理想。李飞鹏等[7]研究中,225例CAG患者内镜下明确诊断率仅78.7%,23例误诊为黏膜隆起性病变、息肉样病变,38 例误诊为慢性浅表性胃炎(CSG)。可见单纯内镜下诊断无法满足临床要求。因此,发现一种无创、准确检测CAG的方法并进行预后动态评估具有重要临床意义。
Hp感染是CAG 重要致病因素,CAG年发病率在0%~11%,而无Hp感染人群中发病率低于1%,Hp感染者CAG 风险显著高于无Hp感染者[8]。Hp 可促使免疫活性细胞释放炎症细胞因子、增殖因子、生长因子等,相互作用,通过不同调节机制作用于胃粘膜,参与CAG 发生发展。PLR是机体炎症反应的重要指标,Hp感染时,多种细胞受到刺激,分泌PLT 活化因子(PAF),PLT 数量增加,进而促使PLR 升高。陈福敏等[9]研究显示,Hp感染可增加胃炎炎症程度,导致PLT、PLR 升高。本研究发现,Hp感染CAG 患者血清PLR水平高于未感染者,与上述分析一致。
IL-34 是新型细胞因子,参与单核巨噬细胞活化和分化,促进IL-6、TNF 等多种细胞因子分泌。研究显示,应激细胞中,IL-34 的mRNA 和蛋白水平上调,NF-κB 是其主要调节因子[10]。周红菊等[11]研究显示,胃癌、慢性胃炎中,血清IL-34水平表达增高,可作为Hp感染阴性的胃癌、慢性胃炎的血清学标志物。其原因在于,胃部炎症会引起淋巴细胞、中性粒细胞、巨噬细胞等的浸润,并分泌一些促炎因子,如IL-6、IL-10、IL-11 等,高水平促炎因子刺激细胞内激酶磷酸化,诱导激活蛋白1(AP-1)、NF-κB 等转录因子表达。以往研究显示,HP 分为Ⅰ型和Ⅱ型,Ⅰ型可产生细胞毒素,毒性较强[12]。HPⅠ型菌株携带40 kb 左右的特殊基因片段[cag 致病岛(cag PAI)],激活NF-κB 途径的能力更强[13]。cag PAI 也被认为是NF-κB 的重要诱导因子。本研究中并未对Hp感染患者进行cag PAI 检测,所检测到的CAG 患者中感染的HP 菌株是否携带cag PAI 未可知。根据结果推测,纳入实验的CAG 患者可能感染的是cag PAI 阴性HP 菌株,无法激活NF-κB 通道,进而对血清IL-34 表达产生影响。后续研究可以此为切入点,进一步明确血清IL-34 表达与Hp感染的关系。
CAG 内镜下表现分为三种类型,即颗粒型、灰白型、浅凹陷型,研究报道,颗粒型患者Hp感染率、肠上皮化生率较高[14]。本研究结果提示CAG患者血清IL-34、PLR水平可能与典型胃黏膜形态存在一定相关性。Logistic 回归分析结果可推测胃黏膜呈颗粒型CAG 患者Hp感染率高,进而影响血清IL-34、PLR 表达及胃炎分型、萎缩程度分型。因此,本研究创新性探讨典型胃黏膜形态、血清IL-34、PLR水平对CAG 患者Hp感染的诊断价值,ROC 曲线显示,颗粒型、IL-34≤11.99 pg/mL、PLR>227.22 的患者要高度怀疑Hp感染的可能性,联合诊断AUC 最高,达0.854。临床可同时检测典型胃黏膜形态、血清IL-34、PLR水平,为诊断Hp感染提供更全面、可靠的参考信息。
综上可知,典型胃黏膜形态、血清IL-34、PLR水平均与CAG 患者Hp感染有关,在CAG 患者Hp感染对不同介质影响研究,利于加深对CAG 致病机制的研究,为CAG及胃癌防治提供帮助。
