口腔癌患者血清UCA1、HGF、uPA水平与临床特征和预后的关系
2021-12-16冯建梅王钟华王芹
冯建梅 王钟华 王芹
作者单位:河北北方学院附属第一医院口腔科,河北,张家口075000
口腔癌是发展中国家常见的十大癌症之一,近年来其发病率呈递增趋势,且趋于年轻化,45 岁以下患者的比例甚至高达30%[1]。虽通过手术、放化疗等方式让口腔癌患者的总体疗效有所提高,但5年生存率仍只在50%~60%之间[2]。既往研究表明在组织细胞发生形态变化之前,分子水平的变化早已发生异常,出现某些肿瘤标记物表达水平异常变化[3]。肝细胞生长因子(hepatocyte growth factor,HGF)是近年来关注度较高的激活肿瘤细胞增殖相关的众多传导通路的信号途径之一;尿激酶型纤溶酶原激活剂(Urokinase plasminogen activator,uPA)属于纤维蛋白溶解系统,对于肿瘤细胞侵袭、转移可能存在促进作用;尿路上皮癌抗原1(urethral epithelium cancer antigen,UCA1)是发现于膀胱癌中特异性表达的长链非编码RNA 分子。国内外已有部分研究表明上述指标在口腔颌面部肿瘤中也存在异常表达情况[4-6],但目前的研究尚集中于对口腔中组织形态学的研究,基于此,本研究将分析口腔癌患者血清UCA1、HGF、uPA 表达情况,旨在探讨其与患者临床病理特征和预后的关系。
1 资料与方法
1.1 一般资料
选取河北北方学院附属第一医院2016年4月至2019年4月收治的83 例口腔癌患者作为口腔癌组,其中男54 例,女29 例;平均年龄(61.87±10.34)岁。纳入标准:①均符合口腔癌诊断标准[7],存在耳部和咽喉痛、斑块、溃疡、颈部淋巴结肿大、口腔黏膜可变粗糙/厚或呈硬结、口腔糜烂等症状;CT 检查可见翼腭窝扩大、脂肪消失等;细胞学与活组织检查呈阳性。②在标本获取前未进行放化疗或免疫治疗;③患者临床资料完整。排除标准:①既往存在或伴有其他恶性肿瘤;②非原发于口腔的转移癌、多原发癌;③治疗后失访者;④因非肿瘤复发、转移原因死亡者。另选取同期体检正常的志愿者79 例作为对照组,其中男52例,女27 例;平均年龄(60.18±11.04)岁。两组患者性别、年龄比较无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准通过,受试者均签署知情同意书。
1.2 方法
1.2.1 一般资料收集
收集患者一般资料,包括年龄、性别、肿瘤大小、分化程度、临床分期、淋巴结转移情况等。根据血清UCA1、HGF、uPA 表达水平的cut-off 值将口腔癌组患者分别分为高UCA1 表达组和低UCA1 表达组、高HGF 表达组和低HGF 表达组、高uPA 表达组和低uPA 表达组,比较不同血清UCA1、HGF、uPA 表达患者生存时间[8-10]。
1.2.2 血清指标检测
对照组于体检当天、口腔癌组患者于入院后次日抽取空腹静脉血5 mL。室温下静置30 min,以3 000 r/min 进行离心分离10 min,取上清液于40℃保存。采用荧光定量PCR 法检测血清UCA1相对表达量,采用酶联免疫吸附法检测血清HGF、uPA水平,试剂盒由上海恒远生化试剂有限公司提供,操作步骤严格按照试剂盒说明书进行。
1.2.3 随访
对口腔癌组患者均进行手术治疗以及术后放化疗。以术后出院为观察起点,以总生存时间(overall survival,OS,疾病诊断至末次随访或患者死亡)作为观察终点,通过电话、门诊复诊等方法对患者及其家属进行随访,随访截止时间为2021年4月,随访时间约为24 个月,无失访人员。
1.3 统计学分析
采用SPSS 19.0 软件处理数据,计量数据以()表示,行t检验,以Kaplan-Meier 法绘制生存曲线,应用Log-rank 法进行生存分析,采用Cox 风险回归模型分析口腔癌患者预后影响因素,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组血清UCA1、HGF、uPA 表达水平比较
口腔癌组患者血清UCA1、HGF、uPA 表达水平均显著高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组血清UCA1、HGF、uPA 表达水平比较(±s)Table 1 Comparison of the expression levels of serum UCA1,HGF and uPA between 2 groups(±s)
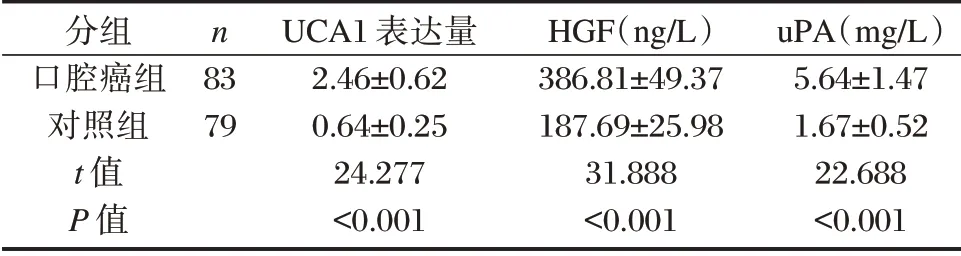
表1 两组血清UCA1、HGF、uPA 表达水平比较(±s)Table 1 Comparison of the expression levels of serum UCA1,HGF and uPA between 2 groups(±s)
分组口腔癌组对照组t 值P 值n 83 79 UCA1 表达量2.46±0.62 0.64±0.25 24.277<0.001 HGF(ng/L)386.81±49.37 187.69±25.98 31.888<0.001 uPA(mg/L)5.64±1.47 1.67±0.52 22.688<0.001
2.2 血清UCA1、HGF、uPA 表达水平与临床特征的关系
不同年龄、性别的口腔癌患者血清UCA1、HGF、uPA 表达水平比较差异无统计学意义(P>0.05),不同肿瘤大小患者的血清UCA1、HGF水平比较无统计学意义(P>0.05),但低中分化、Ⅲ~Ⅳ期和有淋巴结转移患者血清UCA1、HGF、uPA表达水平明显高于高分化、Ⅰ~Ⅱ期和无淋巴结转移患者,肿瘤大小为T3~T4 型患者血清uPA 表达水平高于T1~T2 型患者,差异均有统计学意义(P<0.05)。见表2。
表2 血清UCA1、HGF、uPA 表达水平与临床特征的关系(±s)Table 2 Relationship between the expression levels of serum UCA1,HGF and uPA and clinical features(±s)
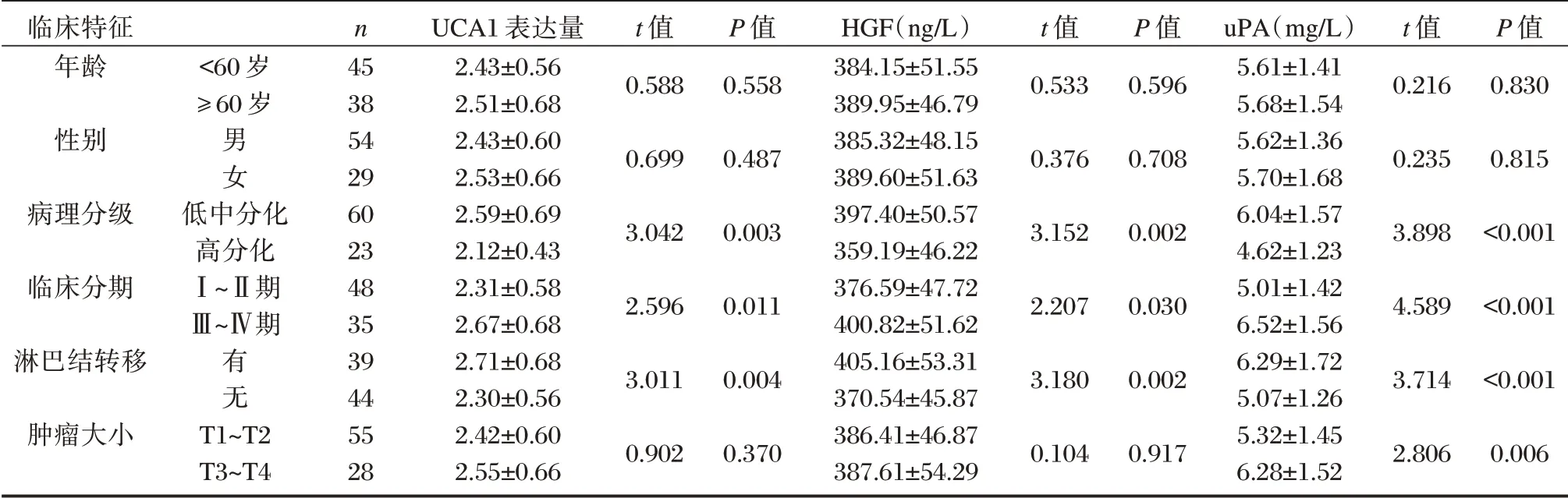
表2 血清UCA1、HGF、uPA 表达水平与临床特征的关系(±s)Table 2 Relationship between the expression levels of serum UCA1,HGF and uPA and clinical features(±s)
临床特征年龄性别病理分级临床分期淋巴结转移肿瘤大小<60 岁≥60 岁男女低中分化高分化Ⅰ~Ⅱ期Ⅲ~Ⅳ期有无T1~T2 T3~T4 n 45 38 54 29 60 23 48 35 39 44 55 28 UCA1 表达量2.43±0.56 2.51±0.68 2.43±0.60 2.53±0.66 2.59±0.69 2.12±0.43 2.31±0.58 2.67±0.68 2.71±0.68 2.30±0.56 2.42±0.60 2.55±0.66 t 值0.588 0.699 3.042 2.596 3.011 0.902 P 值0.558 0.487 0.003 0.011 0.004 0.370 HGF(ng/L)384.15±51.55 389.95±46.79 385.32±48.15 389.60±51.63 397.40±50.57 359.19±46.22 376.59±47.72 400.82±51.62 405.16±53.31 370.54±45.87 386.41±46.87 387.61±54.29 t 值0.533 0.376 3.152 2.207 3.180 0.104 P 值0.596 0.708 0.002 0.030 0.002 0.917 uPA(mg/L)5.61±1.41 5.68±1.54 5.62±1.36 5.70±1.68 6.04±1.57 4.62±1.23 5.01±1.42 6.52±1.56 6.29±1.72 5.07±1.26 5.32±1.45 6.28±1.52 t 值0.216 0.235 3.898 4.589 3.714 2.806 P 值0.830 0.815<0.001<0.001<0.001 0.006
2.3 不同血清UCA1、HGF、uPA 表达患者生存分析
随访期间无失访人员,至随访结束,68 例患者生存,15 例患者死亡,均因原发灶复发死亡。UCA1、HGF、uPA 高表达患者生存时间明显低于低表达患者,差异有统计学意义(P<0.05)。见图1。
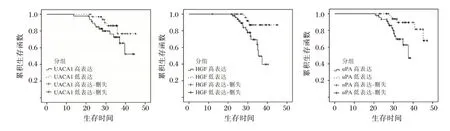
图1 不同血清UCA1、HGF、uPA 表达患者Kaplan-Meier曲线Figure 1 Kaplan-Meier curves of patients with different expression of serum UCA1,HGF and uPA
2.4 口腔癌患者预后影响因素的Cox 回归分析
单因素及多因素Cox 回归分析均证实病灶低中分化、Ⅲ-Ⅳ期、有淋巴结转移以及血清UCA1、HGF、uPA 的高表达均为导致口腔癌患者预后不良的独立危险因素(P<0.05),见表3。
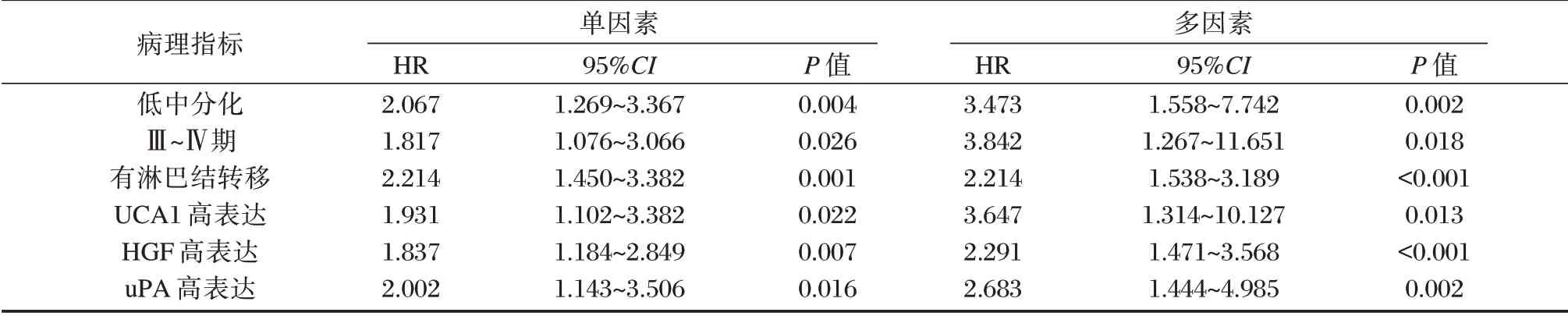
表3 口腔癌患者预后影响因素的Cox 回归分析Table 3 Cox regression analysis of the prognostic factors in patients with oral cancer
3 讨论
肿瘤细胞的浸润、转移被认为是导致癌症治疗后复发、死亡等不良预后的重要原因。近年来,随着肿瘤分子生物学的深入研究,参与口腔癌发生、侵袭和转移的分子调控机制被逐渐揭示。HGF 是一种可促进肝细胞DNA 合成与增殖的营养因子,可由肿瘤组织的细胞外基质经蛋白水解酶降解后释放。已有研究表明HGF 通过持续激活信号通路,从而参与肿瘤细胞的多种病理过程[11]。Yasui 等人[12]发现HGF 在口腔癌癌组织的阳性表达率明显高于癌旁组织,并认为过表达的HGF与口腔癌的恶性进展有关。uPA 是一种蛋白水解酶,与HGF 可协同发挥作用。UCA1是一种长链非编码RNA,在消化和泌尿生殖系统肿瘤中存在明显的表达差异,其异常表达可促进肿瘤细胞的增殖转移,增强肿瘤在人体的转移能力。
本研究发现,口腔癌组患者血清UCA1、HGF、uPA 表达水平均显著高于对照组,提示口腔癌患者血清HGF、uPA 和UCA1水平存在明显的高表达现象。Gao 等[13]也发现口腔鳞癌患者血清HGF含量明显高于健康人,且经治疗后无瘤生存患者相比于残余瘤患者血清HGF 含量明显降低。本研究发现低中分化、Ⅲ~Ⅳ期和有淋巴结转移患者血清UCA1、HGF、uPA 表达水平相对更高,肿瘤大小为T3-T4 型患者血清uPA 表达水平相对更高,表明血清HGF、uPA 和UCA1水平与口腔癌的发生、发展均存在一定的联系,与董爱芬[14]、刘兵等[15]研究结果类似。实体肿瘤的生长离不开血管提供的氧和营养物质,而一些通过血管转移的肿瘤也需要充足的血管。有学者认为,肿瘤细胞在乏氧条件下大量表达C-MET 蛋白,当C-MET 蛋白与HGF 结合后,进而显著增加肿瘤细胞侵袭和转移能力;而uPA 可调节纤溶酶的活性,促使纤溶酶原转化为纤溶酶,从而促进细胞外基质的降解,促进HGF 的合成,进而与HGF 相互作用,共同促进口腔癌的演进[16]。也有研究发现在口腔癌的血管生长过程中,血管的内皮细胞可通过uPA 的表达与内皮细胞表面的受体结合,有利于血管的长入,促进淋巴结的转移[17]。目前已有研究发现UCA1 具有促进肿瘤细胞的耐药性和转化能力,并能够通过调节caspase-3 来抑制肿瘤细胞的凋亡[18]。本研究发现UCA1、HGF、uPA 高表达患者生存时间明显低于低表达患者,且病灶低中分化、Ⅲ~Ⅳ期、有淋巴结转移以及血清UCA1、HGF、uPA 的高表达均为导致口腔癌患者预后不良的独立危险因素。但目前国内尚无关于UCA1、HGF、uPA 高表达与口腔癌预后关系的相关研究,仍待于后续论证结论。推测其原因可能与血清HGF、uPA 和UCA1的高表达会促进肿瘤细胞的增殖、侵袭和转移,而癌细胞的侵袭转移是导致患者死亡的主要原因有关。故对于血清HGF、uPA 和UCA1 高表达的患者,后续应加强监测,配合放化疗等方法提高其预后。
综上所述,口腔癌患者血清HGF、uPA 和UCA1水平的高表达与癌症的病理分级、临床分期和淋巴结转移密切相关,同时也是导致患者预后不良的独立危险因素,有望成为口腔癌疾病严重程度判断以及预后评估的重要生物标志物。
