粪便中脱落细胞基因检测在炎症性肠病诊断中的临床价值
2021-12-16刘秀卿顾大勇李延武郭海建李太晗
刘秀卿 顾大勇 李延武 郭海建 李太晗
作者单位:深圳市第二人民医院检验科,广东,深圳518035
炎症性肠病(Inflammatory bowel disease,IBD)发病率为1.74/10 万,近年来呈上升趋势[1],以南方地区多发,是消化道常见慢性非特异性炎症病变。IBD 主要病变在肠道,但也可累及多种器官、系统,故需尽早诊疗,虽然IBD 治愈率低,但通过一系列治疗后,可缓解病情,使得患者能够像正常人群一样工作、生活,为了保证患者后期得到及时、有效救治,还需注重疾病筛查,以便及时为临床治疗提供科学依据[2]。组织病理学检查、内镜检查是评估肠道炎症活动度的金标准,虽诊断准确率高,但反复内镜检查可给患者带来经济负担,且存在出血、穿孔等风险,加重身心负担,故无法首推[3]。粪便DNA 检测具有诊断效能高、方便、无创等优势,其中DNA 甲基化是最早发现的修饰途径之一,与多种疾病的发生、发展密切相关,目前已有学者用于结直肠癌检测中[4],通过检测粪便中脱落细胞的肿瘤标志物来判断患病风险,其中使用的目标基因为黏结蛋白聚糖2(Syndecan 2,SDC2),内参基因为β 肌动蛋白(β-actin,ACTB),而且在该技术的开发过程中,也观察到一些IBD患者出现了ACTB基因水平异常升高,但当前未有深入研究。本文就此展开深入调查,分析SDC2、ACTB在预测IBD 中效能以及与临床病理特征相关性。
1 资料和方法
1.1 资料
分析在2020年6月至2021年6月深圳市第二人民医院收集的70 例IBD患者(观察组)、30例健康人群(对照组)作为研究对象。观察组男性48 例,女性22 例,平均年龄(47.45±4.53)岁,平均体重(62.35±4.46)kg;对照组男性18 例,女性12 例,平均年龄(47.33±4.49)岁,平均体重(62.49±4.58)kg。两组性别、体重、年龄比较,差异无统计意义(P>0.05)。符合《赫尔辛基宣言》[5]伦理审查。纳入标准:①符合《炎症性肠病外科治疗国内外共识与指南》[6]中关于IBD 临床诊断标准;②自愿提供粪便样本,接受粪便DNA检测;③没有任何肿瘤病史;④签署知情同意书。排除标准:①合并脊柱严重畸形者;②有切口疝或腹部疝气者;③可疑结肠穿孔者;④因直肠、肛门畸形或高度狭窄结肠镜无法插入者;⑤下消化道严重梗阻,无法排便、排气者。本研究经院伦理委员会批准同意。
1.2 样本收集
收集受检者各项基本信息,包括年龄、性别、姓名、家族史、联系方式、疾病史等。在接受肠镜检查后7~30 天进行粪便样本采集,在采集前嘱咐受检者正常饮食,对于服用黄连素等影响检测结果者,需停药一周。收集粪便样本时,严格按照说明书操作,保证DNA 样本不降解,采样后24 h 内送至检验科。
1.3 检测方式
进行粪便DNA 提取和qPCR 检测。首先将粪便样本震荡混匀,离心10 min,5 000 rpm,取上清,保存于-80℃,待检。检测时,先从冰箱取出样本,待融解后,取3.2 mL 上清过SPE 柱,将杂质去除,加入特异性磁珠捕获目标基因,提取的基因组DNA,取2 μL 用超微量分光光度计Nanodrop one测定仪测定浓度及纯度。开展qPCR 法检测,使用广州康立明生物人类SDC2基因甲基化检测试剂盒(国械注准20183400506)与上海宏石全自动医用分析系统SLAN-96S,采用荧光PCR 法检测ACTB、SDC2。具体步骤如下:取10 μL 粪便样本中提取的DNA,加入1×GoTaq 缓冲液,5 mM MgCl2,0.4 mM dNTPs,2.5 U GoTaq 热启动聚合酶(Promega),上下游引物各0.5 μM,0.2 μM Taqman 探针,总反应体系30 μL。在PCR 仪上扩增,反应条件:变性95℃5 min,(95℃15 s,58℃30 s,72℃30s)×48 个循环,冷却40℃30 s。各基因临界值:根据ACTBCt 临界值26.86,ACTB的Ct 值<26.86 为阳性,Ct 值≥26.86 为阴性;SDC2Ct 临界值38.97,SDC2的Ct值<38.97 为阳性,Ct 值≥38.97 为阴性。阳性率=阳性标本例数/总例数×100%。
1.4 统计学处理
运用SPSS 22.0 统计学软件处理;计数资料以n(%)表示,行χ2检验;计量资料用()表示,行t检验,F值采用方差分析;采用受试者工作特征(ROC)曲线分析ACTB的Ct 值、SDC2甲基化的Ct值及两项联合预测价值;采用Spearman 法分析相关性;以P<0.05 为差异有统计学意义。
2 结果
2.1 两组ACTB 基因水平和SDC2 甲基化水平比较
两组SDC2甲基化检测Ct 值、阳性率比较,差异无统计学意义(P>0.05),观察组ACTB的阳性率高于对照组,ACTBCt 值低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组ACTB 基因水平和SDC2 甲基化水平比较[n(%),(±s)]Table 1 Comparison of actb gene level and SDC2 methylation level between the two groups[n(%),(±s)]
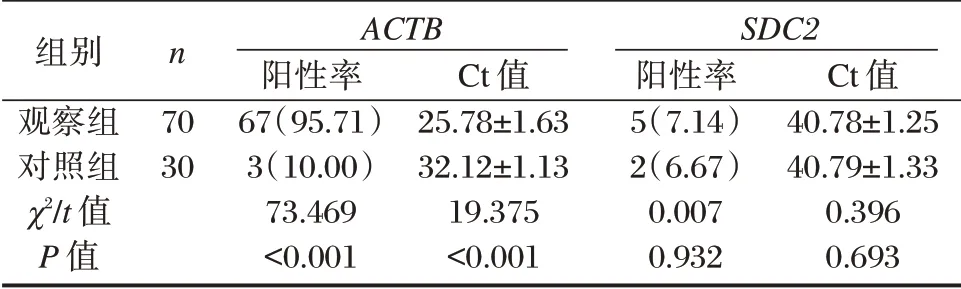
表1 两组ACTB 基因水平和SDC2 甲基化水平比较[n(%),(±s)]Table 1 Comparison of actb gene level and SDC2 methylation level between the two groups[n(%),(±s)]
组别观察组对照组χ2/t 值P 值n 70 30 ACTB阳性率67(95.71)3(10.00)73.469<0.001 Ct 值25.78±1.63 32.12±1.13 19.375<0.001 SDC2阳性率5(7.14)2(6.67)0.007 0.932 Ct 值40.78±1.25 40.79±1.33 0.396 0.693
2.2 ROC 曲线分析
经ROC 曲线分析,内参基因ACTB、SDC2甲基化Ct 值预测炎症性肠病的AUC 分别为0.918、0.473(P<0.05)。见表2、图1。

表2 分析各项指标预测预后的AUC 值Table 2 Analysis of the AUC value of various indicators to predict prognosis

图1 ACTB Ct、SDC2 Ct 预测的ROC 曲线图Figure 1 ACTB Ct,SDC2 Ct predicted ROC curve
2.3 观察组不同临床病理特征的ACTB 基因水平的比较
不同性别、年龄段患者内参基因ACTB的Ct值比较,差异无统计学意义(P>0.05),不同病程、病变位置患者内参基因ACTB的Ct 值比较,差异有统计学意义(P<0.05)。见表3。
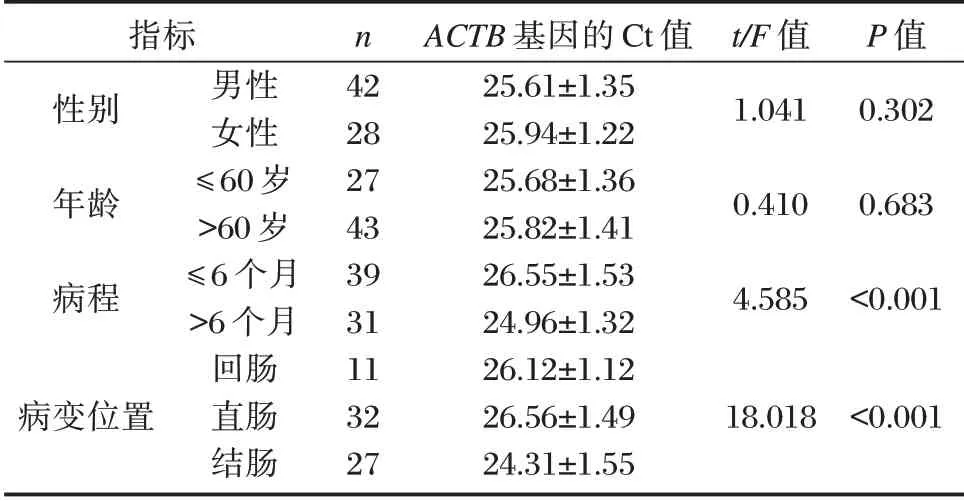
表3 观察组不同临床病理特征的ACTB 基因水平的比较Table 3 Comparison of ACTB gene levels with different clinicopathological characteristics in observation group
2.4 相关性分析
经Spearman 法分析,内参基因ACTB水平与年龄、性别不存在相关性(P>0.05),与病程、病变位置呈正相关性(P<0.05)。见表4。

表4 内参基因ACTB水平与临床病理特征的相关性分析Table 4 Correlation between ACTB level of internal reference gene and clinicopathological features
3 讨论
诊断IBD 金标准为肠镜联合组织学病理检查,虽准确率较高,但属于创伤性操作,且存在出血、穿孔等风险,患者依从率较低[7]。粪便潜血实验是早期临床推荐的非侵入手段,虽具有无创、简便优势,但特异性、敏感性低,尤其是对于微小病变者,误诊率较高。因此,基于粪便、血液等生物样本的精准无创检测便成为肠道炎症病变新选择。有研究表明[8],病变患者粪便中脱落细胞在碱性环境下,可减慢降解速度,因此学者提议将粪便中脱落细胞DNA 基因作为检测标本。随着分子生物学发展,分子生物学标记已逐渐成为肠道病变新型无创检测技术,通过测序技术分析DNA 基因突变,具有更好的特异性和敏感性,但测序技术成本较高,步骤复杂,不利于推广于IBD 中。相比之下,实时荧光定量PCR 检测更值得推广,具有成本低廉、步骤简便优势,且作为非侵入性操作,更易被人们接受。
DNA 甲基化是肠道癌症病变发生、发展中一个早期重要事件,故异常DNA 甲基化可作为早期诊断、预测病变的分子标记物[9]。SDC2基因甲基化是肿瘤早期筛查分子标记物;SDC2是硫酸乙酰肝素蛋白聚糖家族中成员之一,属于I 型细胞表面跨膜蛋白聚糖,目前常作为肿瘤标志物,能够调节机体内基因转录,与多种癌症发生、发展密切相关[10]。ACTB是actin 家族中一员,在细胞生理活动方面发挥着重要作用[11]。本研究结果显示,观察组ACTB基因水平阳性率高于对照组,ACTBCt 值低于对照组,说明IBD 病变存在明显脱落细胞异常增多。主要是IBD 病变发展阶段,NO 大量生成,会破环小肠上皮细胞肌动蛋白,导致肌动蛋白丝网络解体,从而引起上皮细胞功能失调,而ACTB基因参与了细胞迁移和分裂,在IBD 充质细胞中存在异常表达,故引起内参基因ACTB表达异常升高[12-13]。经ROC 曲线分析,内参基因ACTB、SDC2甲基化Ct 值预测炎症性肠病的AUC 分别为0.918、0.473,说明内参基因ACTB检测效能较高,能有效避免盲目大规模肠镜筛查带来的弊端和创伤性,同时节约了医疗资源,提高检测阳性率[14]。而SDC2基因甲基化在肠炎中无特异性表现,敏感性和特异性较低,曹亚萍[15]学者发现SDC2基因在肠癌患者以及癌前病变中表现为异常的高度甲基化,在其他良性疾病(包括肠炎)中则没有表现为高度甲基化。此外,经Spearman 法分析,ACTB与年龄、性别不存在相关性,与病程呈正相关性,说明ACTB可受到疾病严重程度影响。而与病变位置也存在正相关性的原因可能是基因组DNA 来源不同,且本研究纳入例数也较少,可对结果造成一定影响,故关于病变位置与脱落细胞ACTB基因的相关性还有待进一步探索。
综上所述,粪便中脱落细胞基因检测是一项灵敏性高、无创、简便、检测迅速的筛查技术,内参基因ACTB用于IBD 筛查中,可提高诊断效能,对疾病发生、发展起到一定预测评估作用,而SDC2甲基化与肠炎无直接关系。但本次研究样本量较小,可造成分类偏差大,并未进行长期随访,故关于脱落细胞ACTB基因检测效能还需进一步探索。
