利奈唑胺联合环丝氨酸胶囊治疗肺结核的疗效分析
2021-12-16任淑君刘新王旭赵勇
任淑君 刘新 王旭 赵勇
作者单位:1.商丘市结核病防治所结核内科一病区,河南,商丘476000
2.河南省胸科医院微创外科,河南,郑州450000
肺结核是结核分枝杆菌感染引起的慢性传染性肺部疾病,具有病程长、传染性强等特点[1]。现阶段临床一般采用常规化疗方案治疗肺结核,但随着抗结核药物的广泛应用,结核分枝杆菌耐药性不断增加,导致治疗无法达到预期目标[2]。肺结核患者存在不同程度的免疫功能损伤,也增加了治疗难度[3]。此外,抗结核药物存在较强的肝毒性作用,长期服用会对肝功能造成损伤[4]。因此,如何在确保疗效的基础上改善肺结核患者免疫功能、减少肝功能损伤已成为临床研究的热点。环丝氨酸可通过抑制结核分枝杆菌的合成发挥抗结核作用,且耐药率较低[5]。利奈唑胺是恶唑烷酮类合成抗生素,对结核分枝杆菌耐药菌株具有良好的抗菌活性[6]。本研究探讨利奈唑胺联合环丝氨酸胶囊治疗肺结核的疗效,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取本院2019年6月至2020年6月84 例肺结核患者作为研究对象。纳入标准:①符合《肺结核诊断和治疗指南》[7]中诊断标准;②痰结核菌培养为阳性,经影像学检查确诊;③年龄超过18 岁;④首次确诊;⑤近期未接受相关抗结核治疗;⑥药敏试验证明对利奈唑胺、环丝氨酸胶囊不耐药;⑦患者签署知情同意书。排除标准:①合并其他类型肺结核;②对本研究药物过敏者;③合并心、肾、肝功能严重损伤者;④精神、认知功能障碍者;⑤临床资料不全者;⑥合并矽肺、气胸、肺部肿瘤等疾病者;⑦合并感染性疾病、免疫变态反应性疾病者。所有患者经随机数字表法分为观察组(n=42)和对照组(n=42)。两组一般资料比较差异无统计学意义(P>0.05)。见表1。本研究经医学伦理委员会批准。
表1 两组一般资料比较[n(%),(±s)]Table 1 Comparison of eneral data between 2 groups[n(%),(±s)]
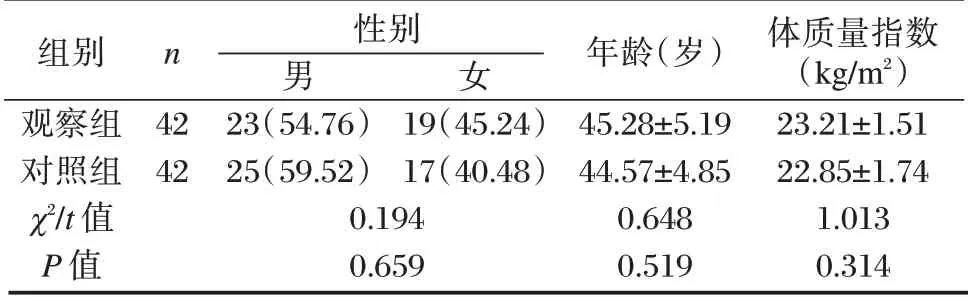
表1 两组一般资料比较[n(%),(±s)]Table 1 Comparison of eneral data between 2 groups[n(%),(±s)]
组别观察组对照组χ2/t 值P 值n 42 42性别男23(54.76)25(59.52)0.194 0.659女19(45.24)17(40.48)年龄(岁)45.28±5.19 44.57±4.85 0.648 0.519体质量指数(kg/m2)23.21±1.51 22.85±1.74 1.013 0.314
1.2 方法
两组均接受常规抗结核治疗,2 个月强化期予以乙胺丁醇、吡嗪酰胺、利福平及异烟肼治疗,4 个月巩固期予以乙胺丁醇、利福平及异烟肼治疗。乙胺丁醇(生产厂家:广东华南药业集团有限公司,H44020758),0.75 g/d;吡嗪酰胺(生产厂家:上海上药信谊药厂有限公司,H31020800),1.5 g/d;利福平(生产厂家:杭州民生药业有限公司,H33022466),0.45 g/d;异烟肼(生产厂家:西南药业股份有限公司,H50020124),0.3 g/d。对照组:在常规抗结核治疗的基础上予以环丝氨酸胶囊治疗,口服环丝氨酸胶囊(生产厂家:Dong-A ST Co.Ltd,H20140984),250 mg/次,2 次/d,连续治疗6个月。观察组:在对照组基础上联合利奈唑胺治疗,口服利奈唑胺片(生产厂家:Pfizer Pharmaceuticals LLC,H20090516),600 mg/次,2 次/d,连续治疗6 个月。
1.3 观察指标
1.3.1 临床疗效
判定标准[8]:显效:胸部X 片显示病灶基本吸收,空洞闭合,痰菌转阴;有效:胸部X 片显示病灶及空洞缩小,痰菌转阴;无效:病灶及空洞无变化甚至加重,痰菌阳性。临床治疗总有效率为有效率及显效率之和。
1.3.2 症状改善时间
统计并比较两组痰培养转阴时间、空洞闭合时间、病灶吸收缩小时间。
1.3.3 血清指标
在治疗前、治疗后6 个月,于清晨取两组空腹静脉血5 mL,离心速度为3 000 r/min,离心10 min,取上清液存于-80℃环境待用。采用全自动生化分析检测两组血清天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、碱性磷酸酶(alkaline phosphatase,ALP)等肝功能指标;采用流式细胞仪检测两组全血CD3+、CD4+、CD4+/CD8+等免疫功能指标;采用酶联免疫吸附法检测两组血清干扰素-γ(interferon gamma,INF-γ)、白细胞介素-6(interleukin-6,IL-6)、转化生长因子-β(transforming growth factor-β,TGF-β)水平。
1.4 统计学方法
采用SPSS 20.0 统计学软件分析数据。计量资料采用()表示,组内行配对t检验,组间行独立样本t检验;计数资料采用n(%)表示,行χ2检验;等级资料比较采用秩和检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床疗效比较
观察组临床治疗总有效高于对照组,差异有统计学意义(P<0.05)。见表2。
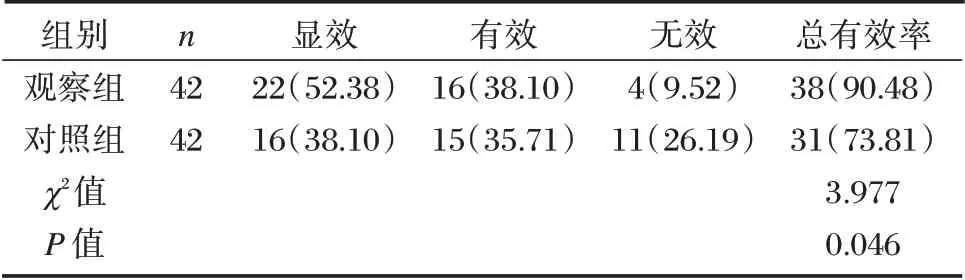
表2 两组临床疗效比较[n(%)]Table 2 Comparison of clinical efficacy between 2 groups[n(%)]
2.2 两组症状改善时间比较
观察组痰培养转阴时间、空洞闭合时间、病灶吸收缩小时间均短于对照组,差异均有统计学意义(P<0.05)。见表3。
表3 两组症状改善时间比较(±s)Table 3 Comparison of symptom improvement time between the two groups(±s)
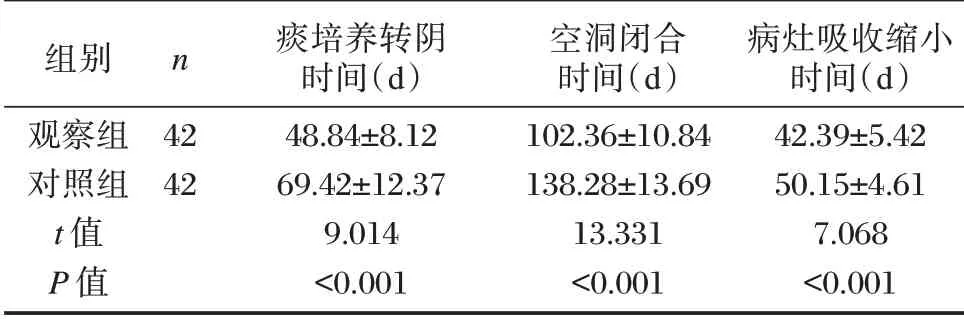
表3 两组症状改善时间比较(±s)Table 3 Comparison of symptom improvement time between the two groups(±s)
组别观察组对照组t 值P 值n 42 42痰培养转阴时间(d)48.84±8.12 69.42±12.37 9.014<0.001空洞闭合时间(d)102.36±10.84 138.28±13.69 13.331<0.001病灶吸收缩小时间(d)42.39±5.42 50.15±4.61 7.068<0.001
2.3 两组治疗前后肝功能比较
治疗前,两组AST、ALT、ALP 比较差异无统计学意义(P>0.05)。治疗后,两组AST、ALT、ALP高于治疗前,但观察组低于对照组,差异均有统计学意义(P<0.05)。见表4。
表4 两组治疗前后肝功能比较(±s,U/L)Table 4 Comparison of liver function between the two groups before and after treatment(±s,U/L)
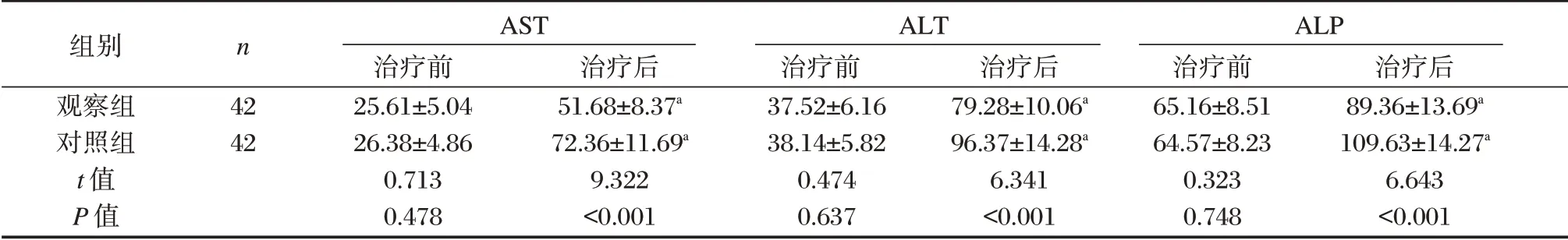
表4 两组治疗前后肝功能比较(±s,U/L)Table 4 Comparison of liver function between the two groups before and after treatment(±s,U/L)
注:与本组治疗前比较,aP<0.05。
组别观察组对照组t 值P 值n 42 42 AST治疗前25.61±5.04 26.38±4.86 0.713 0.478治疗后51.68±8.37a 72.36±11.69a 9.322<0.001 ALT治疗前37.52±6.16 38.14±5.82 0.474 0.637治疗后79.28±10.06a 96.37±14.28a 6.341<0.001 ALP治疗前65.16±8.51 64.57±8.23 0.323 0.748治疗后89.36±13.69a 109.63±14.27a 6.643<0.001
2.4 两组治疗前后免疫功能比较
治疗前,两组CD3+、CD4+、CD4+/CD8+比较差异无统计学意义(P>0.05)。治疗后,两组CD3+、CD4+、CD4+/CD8+高于治疗前,且观察组高于对照组,差异均有统计学意义(P<0.05)。见表5。
表5 两组治疗前后免疫功能比较(±s)Table 5 Comparison of immune function between the two groups before and after treatment(±s)
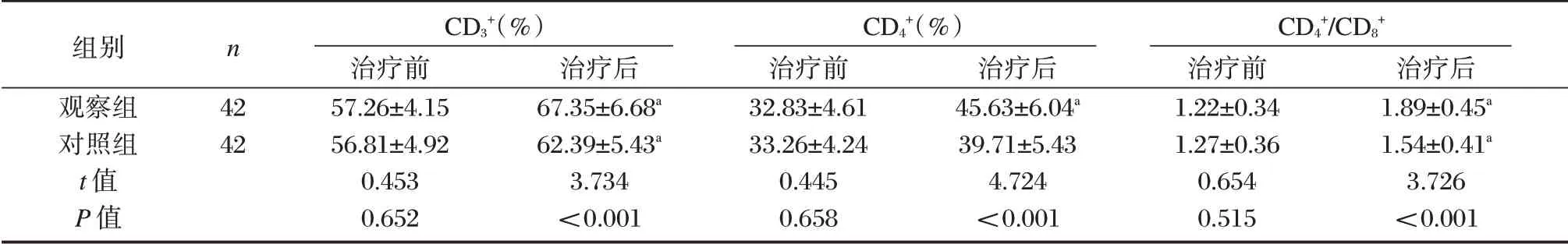
表5 两组治疗前后免疫功能比较(±s)Table 5 Comparison of immune function between the two groups before and after treatment(±s)
注:与本组治疗前比较,aP<0.05。
组别观察组对照组t 值P 值n 42 42 CD3+(%)治疗前57.26±4.15 56.81±4.92 0.453 0.652治疗后67.35±6.68a 62.39±5.43a 3.734<0.001 CD4+(%)治疗前32.83±4.61 33.26±4.24 0.445 0.658治疗后45.63±6.04a 39.71±5.43 4.724<0.001 CD4+/CD8+治疗前1.22±0.34 1.27±0.36 0.654 0.515治疗后1.89±0.45a 1.54±0.41a 3.726<0.001
2.5 两组治疗前后血清INF-γ、IL-6、TGF-β水平比较
治疗前,两组血清INF-γ、IL-6、TGF-β水平比较差异无统计学意义(P>0.05)。治疗后,两组血清INF-γ水平高于治疗前,且观察组高于对照组,差异有统计学意义(P<0.05)。治疗后,两组血清IL-6、TGF-β水平低于治疗前,且观察组低于对照组,差异有统计学意义(P<0.05)。见表6。
表6 两组治疗前后血清INF-γ、IL-6、TGF-β水平比较(±s)Table 6 serum inf before and after treatment in two groups- γ、IL-6、TGF-β Level comparison(±s)
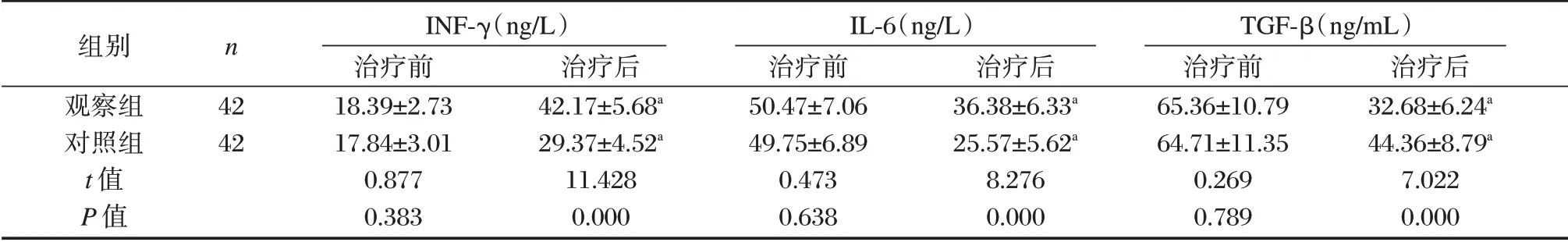
表6 两组治疗前后血清INF-γ、IL-6、TGF-β水平比较(±s)Table 6 serum inf before and after treatment in two groups- γ、IL-6、TGF-β Level comparison(±s)
注:与本组治疗前比较,aP<0.05。
组别观察组对照组t 值P 值n 42 42 INF-γ(ng/L)治疗前18.39±2.73 17.84±3.01 0.877 0.383治疗后42.17±5.68a 29.37±4.52a 11.428 0.000 IL-6(ng/L)治疗前50.47±7.06 49.75±6.89 0.473 0.638治疗后36.38±6.33a 25.57±5.62a 8.276 0.000 TGF-β(ng/mL)治疗前65.36±10.79 64.71±11.35 0.269 0.789治疗后32.68±6.24a 44.36±8.79a 7.022 0.000
3 讨论
肺结核具有发病率高、易复发、病死率高等特点,主要表现为咳嗽、低热、盗汗及咳血等症状[9]。临床常使用乙胺丁醇、利福平及异烟肼等药物治疗肺结核,但随着结核分枝杆菌耐药性的增加,药物治疗效果并不理想。因此,采取有效的治疗方案对改善肺结核患者病情具有重要的临床价值。环丝氨酸能抑制结核分枝杆菌的合成过程,是临床常用的抗结核药物。利奈唑胺是结核分枝杆菌蛋白质合成抑制剂,具有不良反应较少、耐药率较低等优点。本研究中结果显示利奈唑胺联合环丝氨酸治疗能缩短病灶吸收缩小时间、痰培养转阴时间及空洞闭合时间,具有良好的临床疗效,与高岭等[10]研究结果相符。其机理可能为环丝氨酸胶囊能抑制细菌细胞浆中丙氨酸合成酶、丙氨酸消旋酶活性,从而阻断结核分枝杆菌细胞壁N-乙酰胞壁酸五肽合成,破坏细菌细胞壁,发挥抗菌作用。利奈唑胺通过作用细菌核糖体50S 亚基的RNA 位点,抑制核糖体与mRNA 连接,进而阻止70S 起始复合物的形成,阻断细菌蛋白质的合成过程,最终发挥抗结核作用。
有报道显示,长时间、持续性接受抗结核药物治疗,不仅可能会增加耐药菌株数,还会对肝脏造成不同程度损伤,进而影响治疗效果[11]。程雯雯等[12]研究发现,利奈唑胺治疗结核性疾病患者并不会对肝功能造成额外损伤。本研究结果与上述研究结果一致,表明利奈唑胺联合环丝氨酸治疗能减少肺结核患者肝功能的损伤。可能原因为利奈唑胺口服后可以被快速吸收到达肺部,具有血药浓度稳定、绝对生物利用度高等优点,其主要经肾脏代谢后随尿液排出,对肝功能的损害程度较小。
临床研究发现,肺结核患者通常存在免疫功能减退,T 细胞亚群主要表现为CD3+、CD4+水平降低[13]。国内研究发现,利奈唑胺对结核性疾病的疗效确切,能有效改善患者免疫功能[14]。本研究结果与上述研究结果相符,说明利奈唑胺联合环丝氨酸胶囊治疗可以明显提高肺结核患者的免疫功能。分析原因为,利奈唑胺能减少机体能量消耗,缓解炎症反应,进而改善机体免疫功能。INF-γ 能促进T淋巴细胞增殖,有利于巨噬细胞的活化,与肺结核保护性免疫反应相关。IL-6 是促炎因子,在结核杆菌感染引起的自身免疫反应中发挥着重要作用。TGF-β 能有效抑制T 淋巴细胞增殖,有利于结核分枝杆菌增殖。国内外研究发现,肺结核患者血清INF-γ水平降低,IL-6、TGF-β水平明显升高[15]。本研究中观察组治疗后血清INF-γ水平高于对照组,IL-6、TGF-β水平低于对照组,提示利奈唑胺联合环丝氨酸胶囊治疗能调节INF-γ、IL-6、TGF-β水平。
综上所述,在肺结核的治疗中,利奈唑胺联合环丝氨酸胶囊治疗可以提高临床治疗效果,缓解临床症状,减少肝功能损伤程度,提高免疫功能。
