混合碱效应对Li2O-Al2O3-SiO2系玻璃结构和热膨胀性能的影响
2021-12-15黄守佳林鸿剑赵会峰马艳平
曾 麟,黄守佳,林鸿剑,赵会峰,3,姜 宏,,3,马艳平
(1.海南大学,南海海洋资源利用国家重点实验室&海南省特种玻璃重点实验室,海口 570228; 2.海南海控特玻科技有限公司,澄迈 571924;3.特种玻璃国家重点实验室,澄迈 571924)
0 引 言
硅酸盐玻璃已经从基本的结构材料发展成为先进应用的材料。随着电子产品种类的增多,其中高铝玻璃作为电子玻璃在市场上被广泛应用,占据手机屏保行业的半数以上,具体生产公司主要有美国康宁和中国电子彩虹集团等。大量研究[1]表明,美国康宁发布的Gorilla®玻璃中,从第一代GG1到第四代GG4其氧化铝含量(质量分数)分别为13%、14.9%、20.46%、23.1%。后续发布的第五、六代Gorilla®玻璃GG5和GG6均为锂铝硅玻璃。锂铝硅系高铝玻璃拥有优异的耐高压、耐高温和抗划伤性能,目前已广泛应用于电子、光电子、微电子等科技领域。其利于人眼观察的良好通透性,顺应了多种多样的智能终端的推广使用。其中碱金属氧化物的加入而引发的混合碱效应对其结构和性能的影响各有不同。盖板触摸玻璃正是其进行化学强化后的一种电子玻璃[2]。
玻璃的基础组分和网络结构决定了其相应的物理化学性能[3]。碱金属氧化物作为玻璃结构中的网络修饰体,提供的碱金属阳离子一方面可以达到修饰玻璃三维网络骨架的目的,另一方面也可以破坏玻璃网络形成体的结构,同时该离子的存在提供了玻璃化学强化时离子交换的物质基础。然而,随着近年来金属锂的价格不断升高,而金属钠的制作成本低廉且资源丰富,故探究其两者在玻璃成分中用量问题也开始备受关注,同时也具有重大的现实意义。
由相关研究可知,当玻璃中碱金属氧化物总含量不变时,用一种碱金属氧化物逐渐取代另外一种碱金属氧化物时,玻璃的性质不是呈线性变化的,而是会出现极值[4]。由于玻璃的许多性质表现出作为碱含量函数的非线性行为,在现有的玻璃体系中观察到的动态结构模型可归因于碱离子之间以及碱离子与玻璃三维网络之间的相互作用[5],故混合碱效应是玻璃科学多年来的研究主题之一。近年来,玻璃体系中混合碱效应越来越受到重视。
据研究可知,由于受到混合碱效应的影响,玻璃的静态性质与线性趋势的偏差相对较小,如密度;而对于玻璃的动态性质却表现出较为显著的非线性变化,如玻璃化转变温度。在不同的玻璃系统中,如硅酸盐、硼酸盐、铝酸盐、铝硅酸盐和磷酸盐[6]等体系中,对混合碱效应的研究非常重要。Hou等[7]研究了SiO2-CaO-Al2O3-TiO2玻璃陶瓷中的混合碱效应,结果表明,当氧化锂取代氧化钠时,玻璃的聚合度先升高后降低。He等[8]研究了利用氧化锂替代氧化钠对Na2O-MgO-Al2O3-SiO2玻璃形成、结构以及性能的影响,结果表明,随着氧化锂逐渐取代氧化钠,玻璃化转变温度、结晶温度和软化温度呈现先降低后升高的趋势。Kojima等[9]研究了混合碱效应对混合铯硼酸锂玻璃的影响,结果表明单锂和铯硼酸盐玻璃的玻璃化转变温度显示出显著的碱含量依赖性。Money等[10]研究了第二玻璃改性剂氧化钠对Na2O-Li2O-P2O3玻璃的结晶动力学和热稳定性的影响,使用差示扫描量热法研究了玻璃化转变温度的经典“混合碱效应”。
综合国内外研究,可知混合碱效应对锂铝硅系高铝玻璃的影响这一方面的研究较少,故本实验在不改变玻璃组分中其他组分的含量和玻璃中碱金属氧化物总含量的基础上,通过改变玻璃结构中作为网络修饰体(网络外体)的碱金属氧化物氧化锂和氧化钠的含量比例,结合混合碱金属效应,研究其对玻璃结构和热膨胀性能的影响。
1 实 验
1.1 基础玻璃制备
本实验设计玻璃组成见表1,在固定其他成分的基础上改变碱金属氧化物n(Li2O)/n(Na2O)的比例,定义R=n(Li2O)/[n(Li2O)+n(Na2O)](摩尔比),即为Li2O占碱金属氧化物总量的摩尔比。
所用原料均选用化学纯,将原料准确称量好后(总质量约100 g,考虑到玻璃高温熔制过程中碱金属氧化物的挥发情况,前期对初步熔制的玻璃进行全分析测试后对Li2O进行5%的补偿)在玛瑙研钵中充分混合后转移到石英坩埚中,在高温井式炉达到1 350 ℃时加料,接着再以5 ℃/min的速率缓慢升温至1 650 ℃将原料配合料完全熔化,并在1 650 ℃保温2 h,再将熔融的玻璃液倒入石墨模具中快速冷却以形成块状的玻璃,把玻璃块放置600 ℃马弗炉中退火至室温。
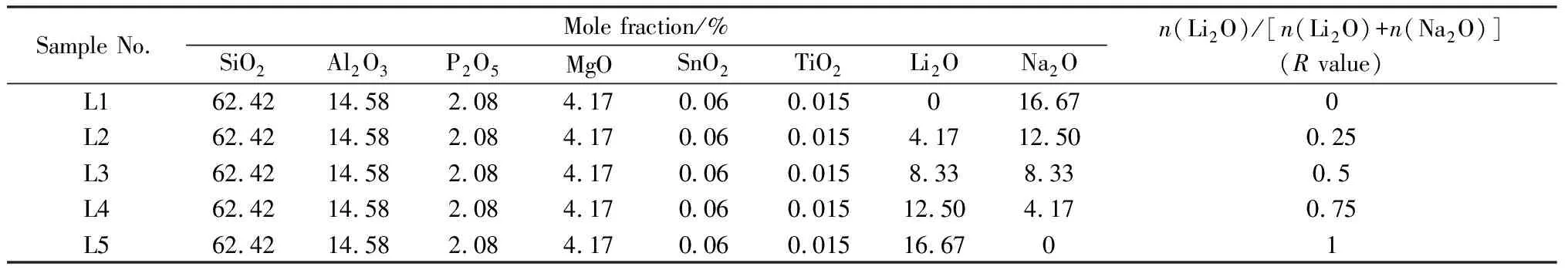
表1 不同锂钠比的锂铝硅玻璃组成Table 1 Composition of Li-Al-Si glasses with different Li-Na ratios
1.2 密度测试
使用高温熔融烧制浇注成型再经退火后的块状玻璃样品,根据阿基米德排水法的原理,采用悬浮法测定样品玻璃的密度。分别准确测量出样品玻璃在空气中的质量M、悬浮于水中的质量M0,由此得出被测样品密度为ρ样=ρ水×M/(M-M0)[11],ρ水为水在室温时的密度。
1.3 热膨胀性能测试
采用来自德国林赛斯公司研发的L75 Platinum Series型热膨胀仪测量玻璃样品的热膨胀系数、玻璃转变温度Tg和玻璃软化温度Tf。测试要求样品尺寸为5 mm×5 mm×20 mm的柱状玻璃,升温速率为5 ℃/min,测试范围为室温至800 ℃。
1.4 差热测试
将熔制浇注成型退火后的基础玻璃磨制成粉末,用瑞士产Mettler Toledo同步热分析仪进行差热分析(DSC),升温速率为5 ℃/min,升温至1 000 ℃,根据不同样品的差热曲线图分析其析晶行为。
1.5 玻璃结构测试
将基础玻璃研磨成粒径为75 μm的玻璃粉末,采用Thermo Nicolet Nexus式470傅里叶红外光谱仪进行波数范围为400~1 400 cm-1的红外光谱(FT-IR)测试,采用Renishaw拉曼光谱仪进行波数范围为300~4 000 cm-1的拉曼光谱(Raman)测试。
2 结果与讨论
2.1 密度结果分析
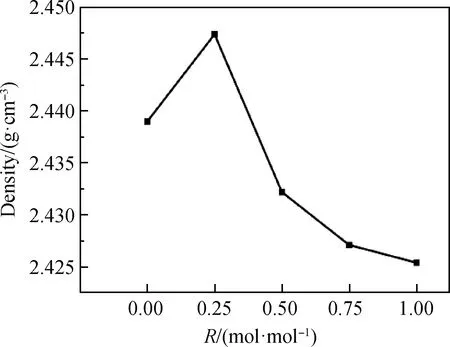
图1 Li2O-Al2O3-SiO2玻璃密度随R值含量变化关系图Fig.1 Relationship between density of Li2O-Al2O3-SiO2 glass and R value content
密度在一定程度上可以反映材料本身网络结构的紧密程度[12]。由于玻璃成分和其自身热性能的影响,密度又可作为表征性能的一个指标。图1为玻璃样品密度随n(Li2O)/n(Na2O)比例变化的关系图。由图1可知,当样品中Li2O的含量逐步增多,Na2O的含量逐步减少时(R值增大),样品的密度变化趋势为先增高,随后减小,R=0.25时达到最大值2.447 4 g/cm3。
氧化锂和氧化钠在玻璃结构中作为主要的网络外体存在,氧化铝作为中间体。在玻璃三维结构中游离氧的数量决定了Al3+的配位情况,Al3+分别以铝氧四面体[AlO4]和铝氧八面体[AlO6]这两种形式存在,其中[AlO4]需要由碱性氧化物的阳离子进行电荷补偿。本实验条件下玻璃组分中n(M2O)/n(Al2O3)>1(摩尔比,M2O为碱金属氧化物),氧化铝的存在方式主要是[AlO4][13],一定的[AlO4]含量可协同[SiO4]进行补网增强空间网络的连接性,使玻璃结构具有良好的聚合度。
当L1~L5样品中逐渐加入Li2O并减少Na2O含量时,碱金属阳离子的摩尔总量不变,大部分的Al3+与碱金属氧化物阳离子进行电荷补偿,形成高稳定性的[AlO4],然而[AlO4]和[SiO4]的结构也会在Al3+的电荷补偿完成后被剩余的碱金属氧化物破坏,结果是玻璃网络结构的聚合度大幅减弱。由于Li+的离子半径小于Na+(Li+离子半径为76 pm,Na+离子半径为102 pm),导致Li+拥有较高的电场强度,与O2-的结合倾向更高,它的存在会干扰[AlO4]配位,此时氧化铝以[AlO4]和[AlO6]这两种形式共存。相比于Na+在空间结构上的断网作用而言,Li—O—Li键可将玻璃网络体系中不连续的网络结构和Si—O—Si断键连接起来,改善三维网络结构,达到增强空间网络的作用[14];另一方面,Li+的存在不仅会干扰到[AlO4]的配位,而且会争夺[SiO4]中的桥氧,破坏结构的紧密程度,故密度的变化受到这两方面的共同作用。在L2中,R=0.25时,引入适量的Li+,此时积聚空间网络的作用占主导,导致密度增大。而L3~L5中,R由0.5逐渐增大到1时,越来越多的Li+进入玻璃结构中,加大[SiO4]中桥氧键的破坏程度,生成Si—O—Li键,影响玻璃致密度,导致密度减小。
由图1总体变化趋势还可知,只添加Na2O样品的密度高于只添加Li2O样品的密度,这是由于Li+的离子半径小于Na+的离子半径,随着Li2O的含量增加,碱金属氧化物的摩尔总量不变,其样品的相对分子质量在降低,故密度也降低。
2.2 热膨胀系数结果分析
热膨胀系数的大小与材料本身化学组成、内部空间结构和化学键强度有关。其本质是材料内部受热运动的结果,运动类型为非简谐振动[15]。图2为200~400 ℃玻璃样品平均热膨胀系数随碱金属氧化物比例变化的关系图。通常结构越致密的材料,热膨胀系数越大[16]。从图2中可知,R值从0增大到1时,其热膨胀系数先增大后减小,R=0.25时达到最大值7.811 7×10-6/℃,可见,热膨胀系数与密度变化趋势一致,两者均受到混合碱金属效应的影响,变化过程中会出现极值且不成线性变化。当R值从0.25逐渐增加到1时,过量的Li+会使Si—O—Si键断开,转而形成Si—O—Li键,其键长小于Si—O—Si键键长,故Si—O—Li键键强更高,线膨胀系数随之减小。
2.3 特征温度结果分析
在测试后所得膨胀曲线上取偏离单纯热膨胀规律的开始点,即为曲线的拐折点,在拐点前后曲线的两侧作出两条相应的切线,玻璃转变温度Tg即为该两条切线相交处对应的横坐标值,而膨胀曲线上的极大值点的横坐标值则为样品的玻璃软化温度Tf[17],这两种温度的变化记录如图3所示。
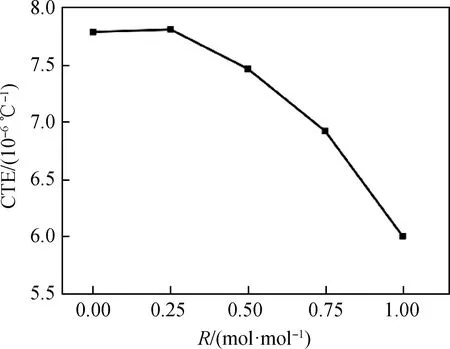
图2 Li2O-Al2O3-SiO2玻璃热膨胀系数随R值变化关系图Fig.2 Relationship between thermal expansion coefficient of Li2O-Al2O3-SiO2 glass and R value content
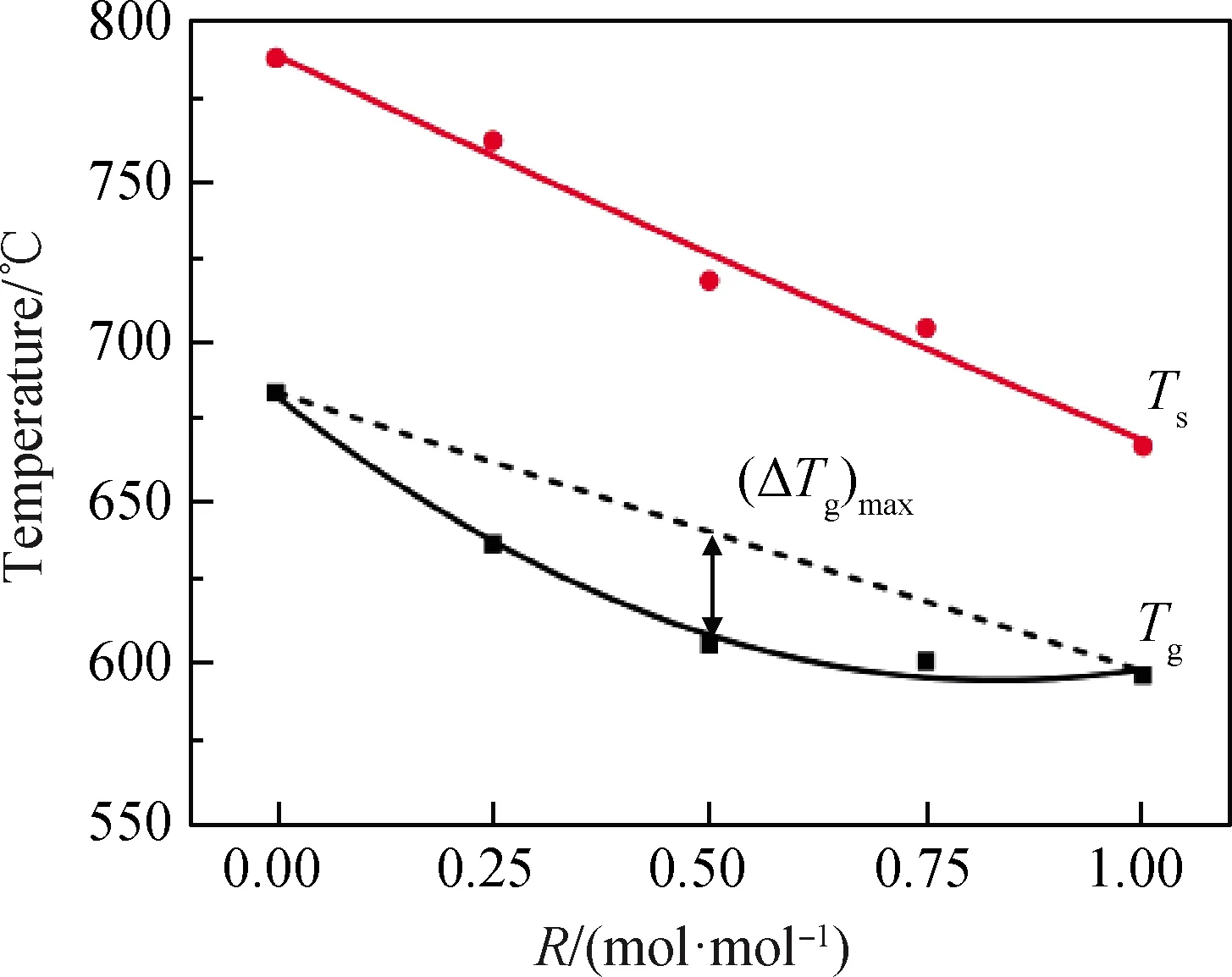
图3 Li2O-Al2O3-SiO2玻璃的特征温度随R值变化关系图Fig.3 Relationship between characteristic temperature of Li2O-Al2O3-SiO2 glass and R value content
从图3可以看出,R值从0逐渐增大到1的过程中,玻璃转变温度Tg的变化趋势经拟合后为负偏差非线性下降,当R=0.5时存在偏离线性的最大点。玻璃软化温度Tf的变化经拟合后呈线性变化且随R值的增大而减小。
玻璃转变温度主要由离子半径的差异和不同化学键的强度共同决定。大量研究表明,玻璃转变温度Tg的变化是碱含量的函数[2]。用Li2O代替Na2O,Li+比Na+而言拥有独特的熔化性能,离子半径更小,对硅氧键的极化作用更强,可加速石英砂粒的熔解,从而达到降低玻璃熔体黏度的作用[18],故锂铝硅玻璃的特征温度均随R值增大而降低。在玻璃组分中,主要的网络骨架是硅氧四面体[SiO4],碱金属离子在这个网络骨架中并不是固定不动的,而是处于不断地运动中,由于热激活,会一直作热运动而发生空位跃迁[19]。当玻璃组分中只存在同种类型的碱金属阳离子时,只会形成相同种类和大小的空位,而当有不同种类的碱金属阳离子加入时,会随之产生不同种类和大小的空位。这种空位不匹配的程度会在两种不同阳离子的含量比为1 ∶1时达到最大。故当R=0.5,即n(Li2O)/n(Na2O)为1 ∶1时,Tg的变化受到混合碱金属效应的影响最大,样品的玻璃转变温度Tg出现偏离线性的最大值。
从图3可以看出,玻璃转变温度Tg是偏离线性趋势变化的,而玻璃软化温度Tf却是呈线性变化,即软化温度Tf的变化不受混合碱金属效应的影响。说明混合碱金属效应对锂铝硅系玻璃特征温度的影响随着温度的升高作用在减弱直至消失。Li2O和Na2O在玻璃结构中作为网络外体存在,对玻璃特征温度的影响是有一定限度的。在较低温度时,改变网络外体的种类和含量对玻璃特征温度带来的影响占主要地位;当温度升高时,其玻璃内部热运动加剧,网络外体对玻璃特征温度的影响在逐渐减弱。
2.4 DSC结果分析
图4为不同n(Li2O)/n(Na2O)比例玻璃样品的DSC曲线图,从图中结果得知,当n(Li2O)/n(Na2O)<1,即R=0和0.25时,DSC图形中不存在放热峰,无析晶行为的出现。当n(Li2O)/n(Na2O)≥1,R值从0.5增大到1的三个玻璃样品均出现了放热峰,代表对应温度范围内有晶体析出,该析晶峰的强度随着R值的增大有增强的趋势,且其析晶峰的峰宽逐渐变窄,表明析晶速率越来越快。
从表1中玻璃组分可知,该体系玻璃中存在一定含量的成核剂,特定条件下会出现自发析晶的可能。Na+的离子半径比Li+大,有更强的释氧能力,断裂玻璃主要三维网络骨架,Li+还存在积聚紧凑网络骨架的作用。Li+含量的增加,也在逐步提高玻璃自身的析晶能力,存在促进析晶的作用[20],这也解释了开始时n(Li2O)/n(Na2O)<1的玻璃样品性能较稳定基本不析晶,而n(Li2O)/n(Na2O)≥1时,玻璃处于介稳状态,开始析晶且析晶速率随着n(Li2O)/n(Na2O)的增加而加快。
观察图4中R为0.5、0.75、1时对应的析晶峰温度Tp的变化为正偏差非线性下降。当样品中n(Li2O)/n(Na2O)<1时,此时碱金属氧化物离子中大部分为Na+,Na+没有Li+可以促进析晶的作用,故此时无析晶峰;当样品中n(Li2O)/n(Na2O)=1 ∶1时,样品开始出现析晶行为,而析晶峰温度Tp的变化随着R值增大并不成线性变化,可知其析晶峰温度Tp的变化受到混合碱金属效应的影响,且析晶峰温度Tp在R=0.75时受到碱金属效应影响程度最大。当Li2O完全取代Na2O时,对应的析晶峰温度Tp降到最低710 ℃,这均是由于Li2O降低玻璃黏度的能力强于Na2O,故用氧化锂取代氧化钠可达到改善玻璃析晶条件的效果。
2.5 红外光谱结果分析
图5为不同n(Li2O)/n(Na2O)比例的红外吸收光谱,其中Ob为桥氧,Onb为非桥氧[21]。
由图5可知,位于400~1 400 cm-1谱带区域内,包含三个明显的吸收峰:400~540 cm-1、640~830 cm-1和830~1 350 cm-1。

图4 Li2O-Al2O3-SiO2玻璃的DSC曲线随R变化关系图Fig.4 DSC curves of Li2O-Al2O3-SiO2 glass varies with R value content
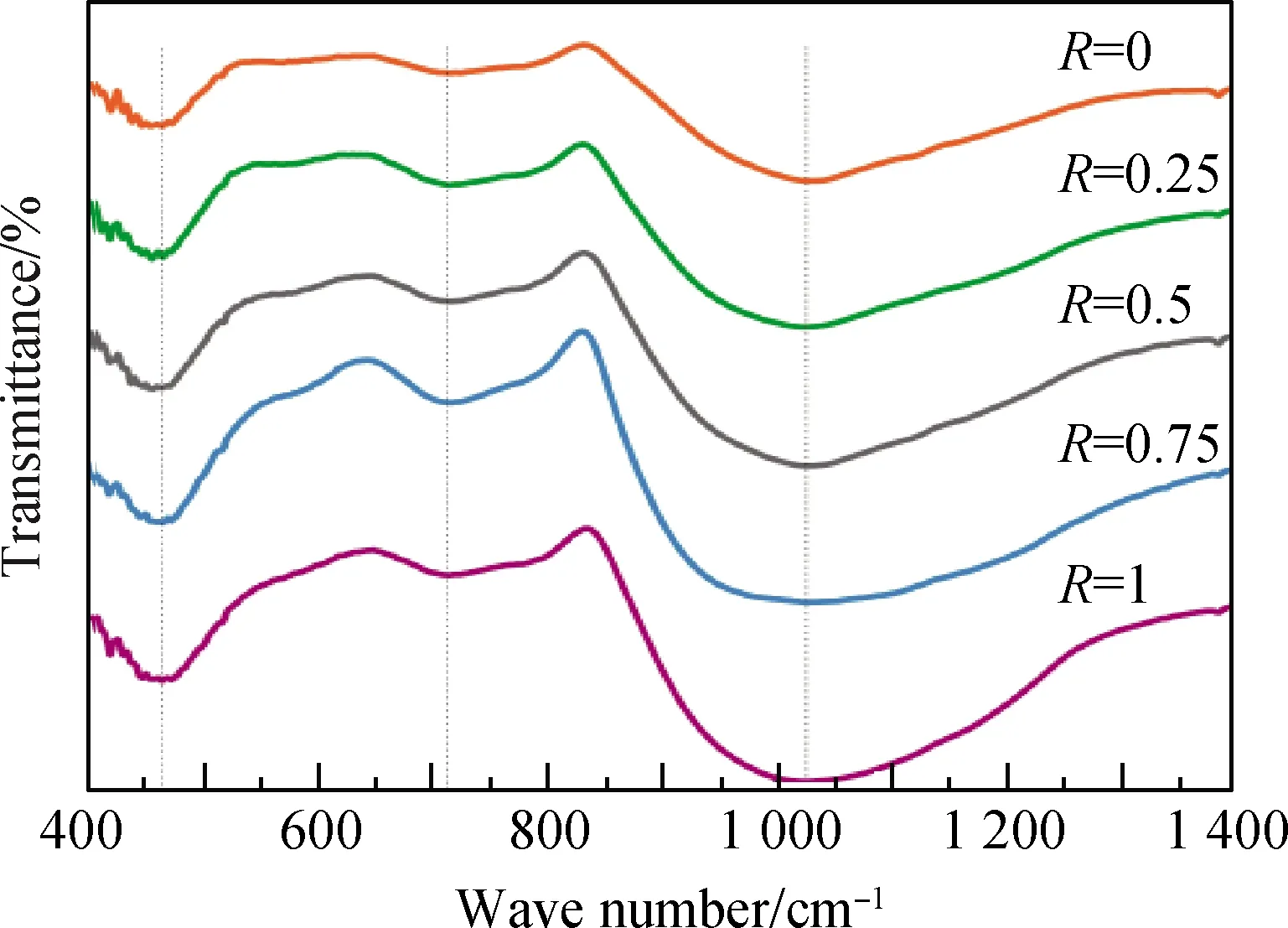
图5 不同R值玻璃样品的红外光谱Fig.5 IR spectra of glass samples with different R value
表2为Li2O-Al2O3-SiO2系玻璃中一些常见基团特征振动,400~540 cm-1波数范围内的谱带是由Si—Ob—Si的弯曲振动形成的吸收峰。从图中可以看出从470~540 cm-1处峰肩从上到下有逐渐增大的趋势,该峰肩处由434~547 cm-1波数范围内的Si—Ob—Si的弯曲振动峰和520 cm-1处的[AlO6]中的Al—O弯曲振动峰复合而成。当R=0时,n(M2O)/n(Al2O3)>1,只存在Na2O这一种碱金属氧化物,氧化铝主要以[AlO4]的形式存在[7],此时该峰肩处只存在Si—Ob—Si的弯曲振动峰。当加入Li2O后,n(Li2O)/n(Na2O)比例增大,R值增大,Li+的存在干扰[AlO4]进行配位,此时氧化铝以[AlO4]和[AlO8]这两种形式共存,即在520 cm-1波数处附近会出现[AlO6]中的Al—O弯曲振动峰,导致470~540 cm-1处峰肩增大。
640~830 cm-1波数范围内的谱带出现不对称峰形,故其是复合峰,主要由该波数范围内所包含的[AlO4]中的Al—O弯曲振动峰、Si—Ob—Si的对称伸缩振动峰和O—Si—O的对称弯曲振动峰复合而成。由图5可看出,R值从0到1,720~830 cm-1波数范围内的峰肩有逐渐增强的趋势,随着n(Li2O)/n(Na2O)比例的增大,Li+的加入既可以聚网紧凑,又破坏硅氧四面体中的桥氧键,非桥氧数量增多,该处对应的复合振动峰均有增强的趋势。
830~1350 cm-1波数范围内的谱带同样出现了不对称的峰形,故该处同样为复合峰,主要由Si—Onb反对称伸缩振动峰和Si—Ob—Si反对称伸缩振动峰复合而成,二者的合峰有向高波数偏移的趋势。从上至下五条谱线位于830~1 040 cm-1范围内的峰肩和1 040~1 350 cm-1范围内的峰肩均有逐渐增强的趋势,可得知随着n(Li2O)/n(Na2O)比例的增大,玻璃内部网络结构中的Li+含量越来越多,对Si—O—Si键的反极化作用越来越强,更多的桥氧键遭受到破坏,从而导致非桥氧键数目上升。
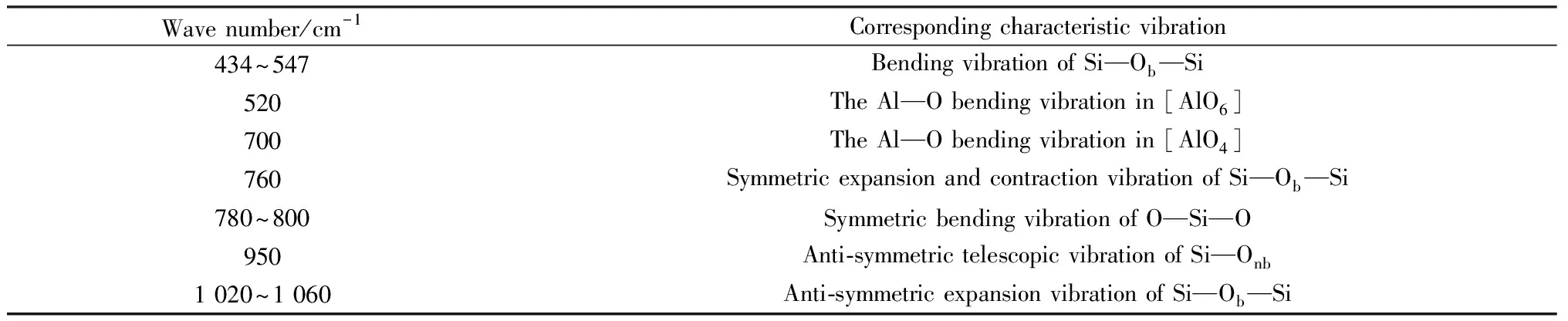
表2 Li2O-Al2O3-SiO2系玻璃中一些常见基团特征振动Table 2 Characteristic vibration of some common groups in Li2O-Al2O3-SiO2 glass
2.6 Raman结果分析
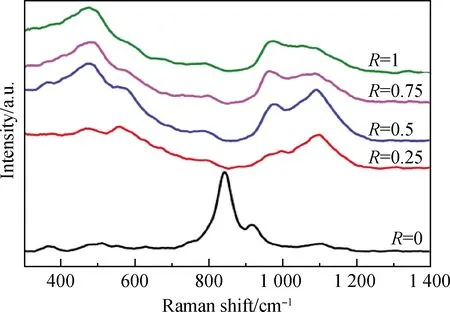
图6 不同R值璃样品的拉曼光谱图[22]Fig.6 Raman spectra of glass samples with different R values[22]
图6为不同n(Li2O)/n(Na2O)比例的拉曼光谱[22]。从图中可看出样品R=0的拉曼光谱与含Li样品的拉曼光谱走势存在较大差异。当玻璃样品中n(Li2O)/n(Na2O)比例逐渐增大时,出现位于484 cm-1处的Si—Ob—Si的弯曲振动和850~1 200 cm-1处的Si—Onb的反对称伸缩振动。而只添加Na2O样品的Si—O—Si的伸缩振动主要在750~850 cm-1区域内出现。这是由于Li2O和Na2O都作为网络外体,在玻璃内部网络结构中同时存在时会出现混合碱金属效应。
为分析不同n(Li2O)/n(Na2O)比例玻璃样品的拉曼光谱图,需进一步对850~1 200 cm-1范围内的振动峰进行分析(当R=0时考察的波数范围为700~1 200 cm-1)。不同类型的[SiO4],即Qn(n为[SiO4]中的桥氧个数,其值为1、2、3、4)在拉曼光谱测试图中对应的主要峰位和形状如表3所示[23]。用高斯函数对850~1 250 cm-1处拉曼光谱振动图形进行卷积积分,拟合得到不同样品的硅氧四面体Qn的含量分布。
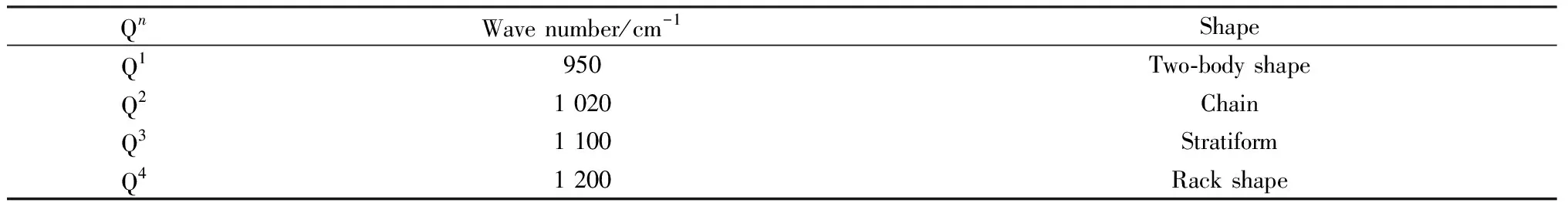
表3 锂铝硅系玻璃中硅氧四面体Qn在拉曼光谱图中对应峰位和形状Table 3 Corresponding peak position and shape of silicon-oxygen tetrahedron Qn in Li-Al-Si glass in Raman spectrogram
图7为不同R值玻璃样品振动峰经高斯卷积积分拟合后的分峰图形。图8为经分峰拟合后各个玻璃样品中硅氧四面体Qn面积所占百分含量的变化曲线图,硅氧四面体Q1、Q2、Q3和Q4的分布含量变化都受到了一定程度的混合碱金属效应的影响。
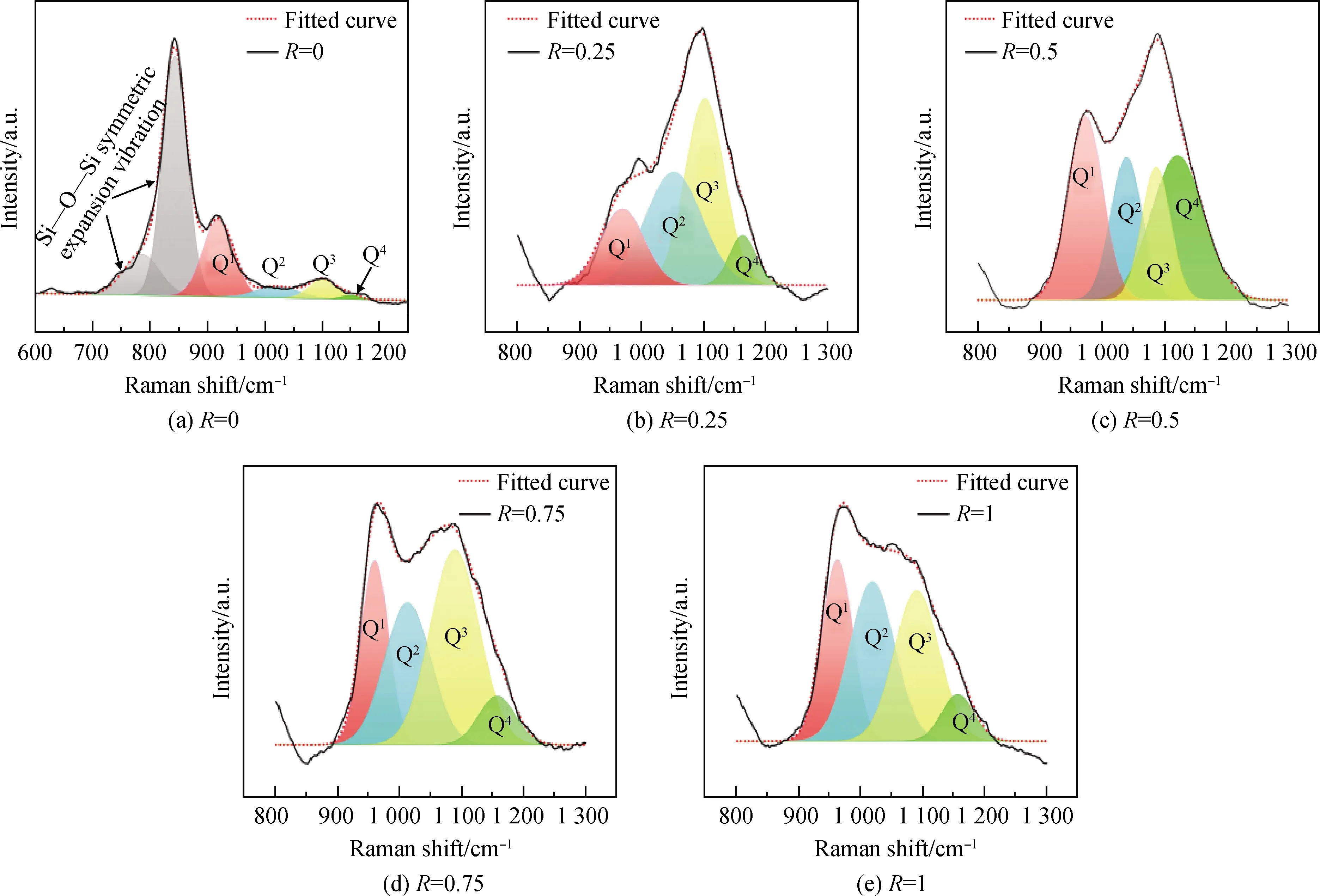
图7 不同R值玻璃的高波数处的拉曼峰进行高斯卷积积分拟合的分峰图Fig.7 Peak-splitting diagram fitted by Gaussian convolution integral for Raman peaks at high wave number of glasses with different R values
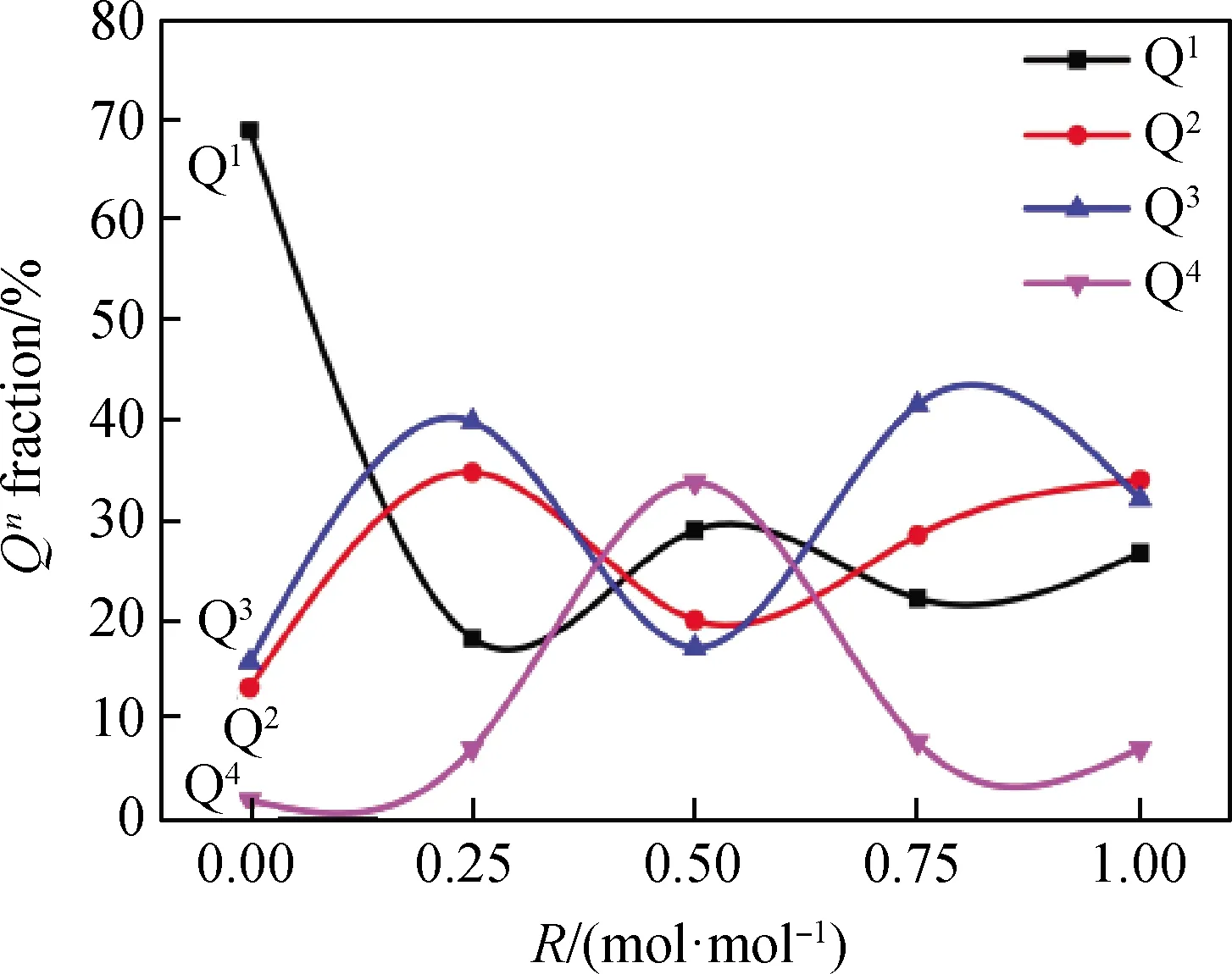
图8 Qn含量随R值变化的函数图Fig.8 Function diagram of Qn content changing with Li-Na ratios in components
结合图7和图8,针对五个样品中自身不同硅氧四面体Qn含量进行比较,R=0的玻璃样品中主要的硅氧四面体Qn为Q1;R=0.25时的玻璃样品中主要硅氧四面体Qn为Q2和Q3;R=0.5时的玻璃样品中主要硅氧四面体Qn为Q4和Q1;R=0.75时的玻璃样品中主要硅氧四面体Qn为Q3和Q2;R=1时的玻璃样品中主要硅氧四面体Qn为Q2和Q3。
针对同种硅氧四面体Qn在不同样品中含量变化进行比较,R=0时Q1含量大于R=1样品中Q1含量,说明Na+的断网能力强于Li+,Q1含量的变化在开始加入Li+后大量减少,随后趋于平缓,表明混合碱金属效应对Q1分布含量的影响程度较弱。五个样品中Q2和Q3的整体变化较为一致,在图8中有相同的起伏趋势,说明混合碱金属效应在该体系玻璃中对Q2和Q3的影响大体一致。R值从0.25到0.75的玻璃样品中,Q2和Q3的含量先降低后增大,主要是n(Li2O)/n(Na2O)比例变化的过程中大部分Q2、Q3与Q4相互转化的结果,且在R=0.5时,Q4的含量达到最大,即当玻璃样品中n(Li2O)/n(Na2O)比为1 ∶1时,混合碱金属效应对Q4影响程度达到最大。
碱金属离子的存在,不仅可以为玻璃网络结构提供游离氧,一定程度上增加桥氧键,提高桥氧数目,此外对原玻璃结构中的桥氧键也有破坏效果。R值升高,随着Na+含量减少,对玻璃的断网能力下降;Li+含量增多,体现出其增强网络骨架的能力,同时Li+更高的场强作用、对硅氧键的反极化作用促使硅氧四面体Q2、Q3与Q4的生成和分解。R值从0.5到1,Q4含量略有降低且在硅氧四面体Qn中占最少部分,Q2和Q3含量接近且在硅氧四面体中占大多数部分,Q1含量先下降再升高,略有变化,此过程中由于混合碱金属效应的影响,玻璃内部网络结构呈现出无序性越来越强的状态。
3 结 论
(1)不同碱金属氧化物含量比对玻璃样品的密度和热膨胀系数的影响一致,随着R值的增大,其密度和热膨胀系数变化为先增大后减小:当R=0.25时,密度达到最大2.447 4 g/cm3,热膨胀系数达到最大7.811 7×10-6/℃;当R=1时,密度达到最小2.425 4 g/cm3,热膨胀系数达到最小6.001 8×10-6/℃。
(2)混合碱金属效应对锂铝硅系玻璃特征温度的影响随着温度的升高作用减弱直至消失。当温度较低时,玻璃转变温度Tg受到混合碱金属效应的影响,随R值增大出现负偏差非线性下降的趋势,且在R=0.5时受到该效应的影响最大,出现线性偏差最大值。当温度升高,玻璃软化温度Tf随R值增大呈线性减少,没有受到混合碱金属效应的影响。
(3)锂铝硅系高铝玻璃析晶行为在一定程度上受到混合碱金属效应的影响。R值从0增大到1的过程中,Li+含量增多,Na+含量减少,表现出Li+析晶促进作用。
(4)混合碱金属效应对玻璃网络骨架结构中的硅氧四面体Qn的影响不尽相同。其中,Q1分布含量受到的影响程度较弱;Q2和Q3受到的影响大体一致,表现为上下波动形;Q4受到的影响程度最大,并且在R=0.5时达到最大。
