对称性中位取代羟基卟啉荧光检测水体痕量汞离子研究
2021-12-15吕向菲陈瑞华赵永国陈静张潆心白天瑜
吕向菲,陈瑞华,赵永国,陈静,张潆心,白天瑜
(1.长安大学 水利与环境学院,陕西 西安 710054;2.中交第一勘察设计研究院有限公司,陕西 西安 710075;3.西安中交环境工程有限公司,陕西 西安 710065)
《关于汞的水俣公约》预示我国将进一步加强对水体中汞污染的治理[1-2]。《“十三五”生态环境保护规划》也将水体中的汞污染作为重点治理对象,加强水体汞离子的检测具有重要意义[3-4]。卟啉分子因具有良好的荧光发射特性,对光稳定、量子产率高、Stokes位移大,可作为高灵敏汞离子荧光探针[5-7]。研究拟选用具有对称性结构的羟基中位取代卟啉,借助其卟啉环的配位作用和环外中位取代的羟基与汞离子相互作用,实现对水体痕量汞离子的荧光检测。
1 实验部分
1.1 试剂与仪器
4-羟基苯甲醛、苯甲醛、吡咯、丙酸、无水乙醇、二氯甲烷、三氯甲烷、正己烷、氯化汞、无水硫酸钠均为分析纯,吡咯使用前需重新蒸馏提纯。
RE52AA旋转蒸发仪;S220-F 台式酸度计;岛津Shimadzu UV1800紫外-可见光谱仪;BEQ UZNDX550-FTIR红外光谱仪;MALDI-TOF飞行质谱仪;FP-550荧光光谱仪。
1.2 两种对称性羟基卟啉的合成与纯化
使用改进的丙酸合成法合成两种具有对称结构的中位取代羟基卟啉[8]。5,15-二-(4-羟基苯基)10,20-二苯基卟啉(P2OH)和5,10,15,20-四-(4-羟基苯基)苯基卟啉(P4OH),其结构见图1。
图1 两种羟基卟啉的分子结构Fig.1 The molecular structures of P2OH and P4OH
以H2P2-OH羟基卟啉合成为例,合成步骤如下:将100 mL丙酸加入250 mL三颈瓶中,再分别加入2.3 g的对羟基苯甲醛和5.7 mL苯甲醛,加热搅拌,使二者充分溶解,混合。继续升温至丙酸回流。缓慢滴入5.3 mL新蒸吡咯,待溶液变为棕黑色后,用锡纸包裹反应瓶,并继续维持丙酸回流状态,反应1.5 h后停止,撤去加热搅拌装置,静置冷却至室温。在旋转蒸发仪上减压蒸去大部分的丙酸。加入100 mL无水乙醇。将三颈瓶置于冰箱冷藏室,静置过夜,次日减压抽滤,用无水乙醇洗涤产物至滤液无色。70 ℃下真空干燥4 h,得1.56 g紫黑色固体。将紫黑色固体溶解,以二氯甲烷和正己烷体积比 4∶6 作为淋洗剂,进行硅胶柱层析分离,收集第三谱带即为P2OH。
P4OH的合成,需调整4-羟基苯甲醛和吡咯反应量为等摩尔比,合成步骤与P2OH的步骤类似,最终固体产物以二氯甲烷作为淋洗剂,收集第六谱带。
1.3 两种对称中位取代羟基卟啉荧光检测水体Hg2+
1.3.1 溶液的配制 取0.016 2 g P2OH和0.017 0 g P4OH分别溶解于30 mL CH3Cl3中,以乙醇作为稀释剂,定容于250 mL的容量瓶中,分别得到 0.1 mmol/L P2OH和0.1 mmol/L P4OH的储备液,避光冷藏、备用。
配制10 mmol/L的HgCl2溶液,作为Hg2+的储备液,冷藏备用。
用乙醇和水体积比1∶1的混合溶剂配制醋酸-醋酸钠缓冲液(pH=6)。
1.3.2 荧光光谱仪的测试条件 因pH值对检测体系有较大影响,本研究所有检测溶液,如无特殊说明,均使用醋酸-醋酸钠缓冲溶液作为溶剂,定容于10 mL容量瓶中。测试过程中,如无特殊说明,羟基卟啉的浓度均为0.01 mmol/L。在探针的选择性测试过程中,所有检测溶液中 Hg2+浓度均为 0.02 mmol/L。为保证检测效果,所有溶液配制完成后,均需在2 h内进行测试。设定427 nm为荧光激发波长,在550~700 nm的发射波长范围内采集体系荧光光谱。在此条件下,分别比较两种检测体系的选择性、时间稳定性和pH稳定性。
2 结果与讨论
2.1 P2OH和P4OH的合成分析
P2OH和P4OH的合成均选取反应时间短、产率较高的Alder丙酸法,此方法用于合成羟基卟啉,反应简单、易控制、产率较高。反应完成后,要蒸去至少2/3的丙酸,防止卟啉酸化形成二氢卟啉,分离提纯。通过对两种卟啉进行质谱分析,正离子模式下,显示较强的[M+H]+峰(见表1)[8-9],证明卟啉合成成功。分别测试0.1 mmol/L P2OH和P4OH乙醇溶液的紫外-可见吸收光谱(见图2),P2OH和P4OH的S带峰分别位于416 nm和418 nm左右,Q带在450~700 nm范围内有4个峰,这些也作为羟基卟啉的佐证。

表1 两种对称中位取代羟基卟啉的[M+1]峰Table 1 [M+1] peaks of two symmetricallysubstituted hydroxyporphyrins
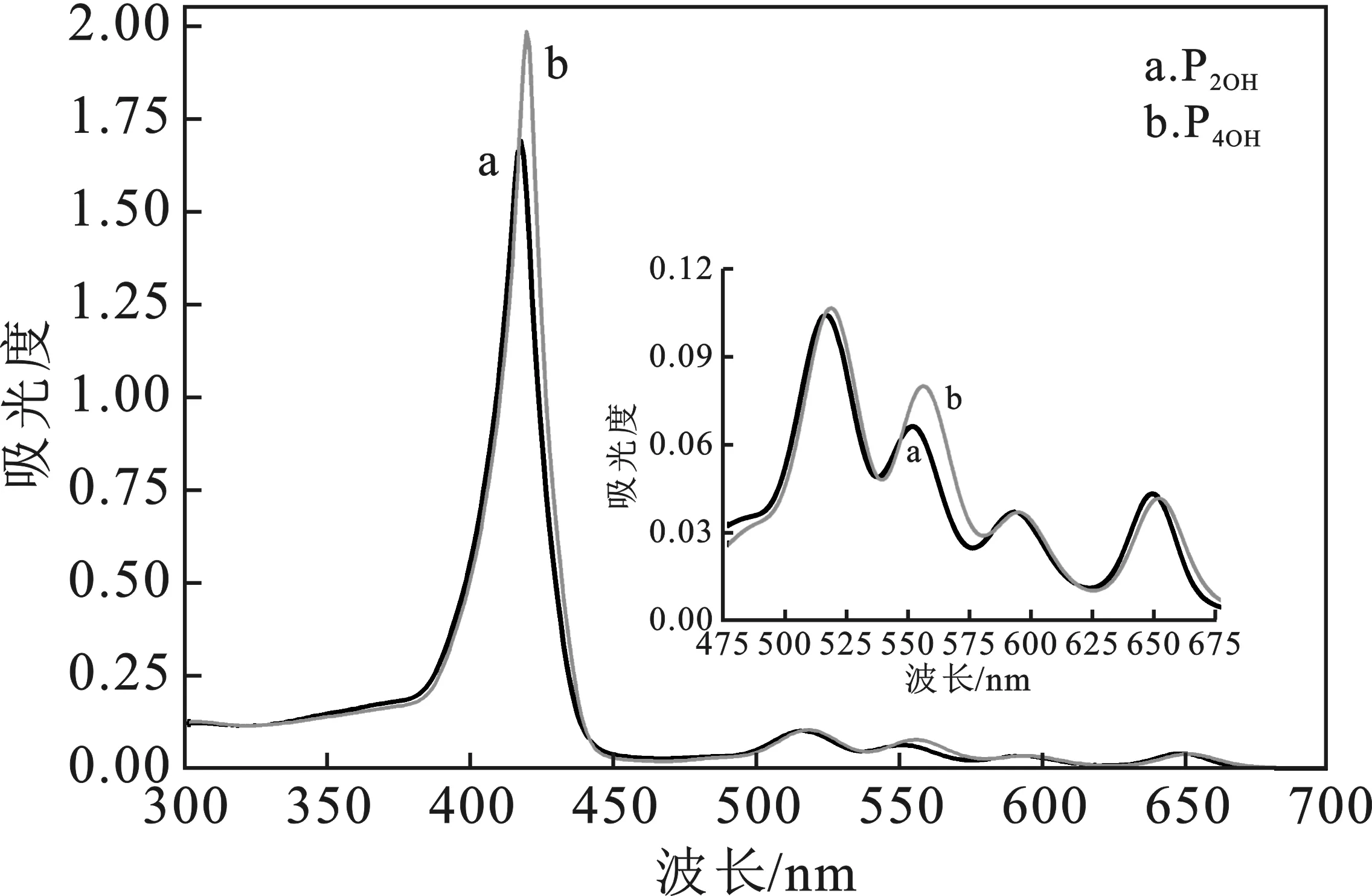
图2 P2OH和P4OH的紫外可见光谱图Fig.2 UV-Vis spectra of P2OH and P4OH
2.2 两种对称中位取代羟基卟啉检测水体Hg2+
2.2.1 两种卟啉荧光检测选择性比较 分别称取0.034 55 g K2CO3、0.034 02 g CH3COONa·3H2O、0.027 75 g CaCl2、0.023 81 g MgCl2、0.059 43 g NiCl2·6H2O、0.032 46 g CoCl2、0.043 26 g Mn(CH3COO)2、0.045 87 g Zn(CH3COO)2、0.067 88 g HgCl2、0.069 51 g FeSO4·7H2O、0.042 5 g AgNO3于烧杯中溶解后,配制25 mL 10-2mol/L的金属离子储备液。进行选择性测试时,以醋酸-醋酸钠缓冲液作为稀释剂,将金属离子溶液定容于10 mL容量瓶中。其中,卟啉及重金属离子浓度分别为 10-5mol/L 和20 μmol/L,在相同荧光测试条件下,检测体系的荧光光谱变化,结果见图3、图4。
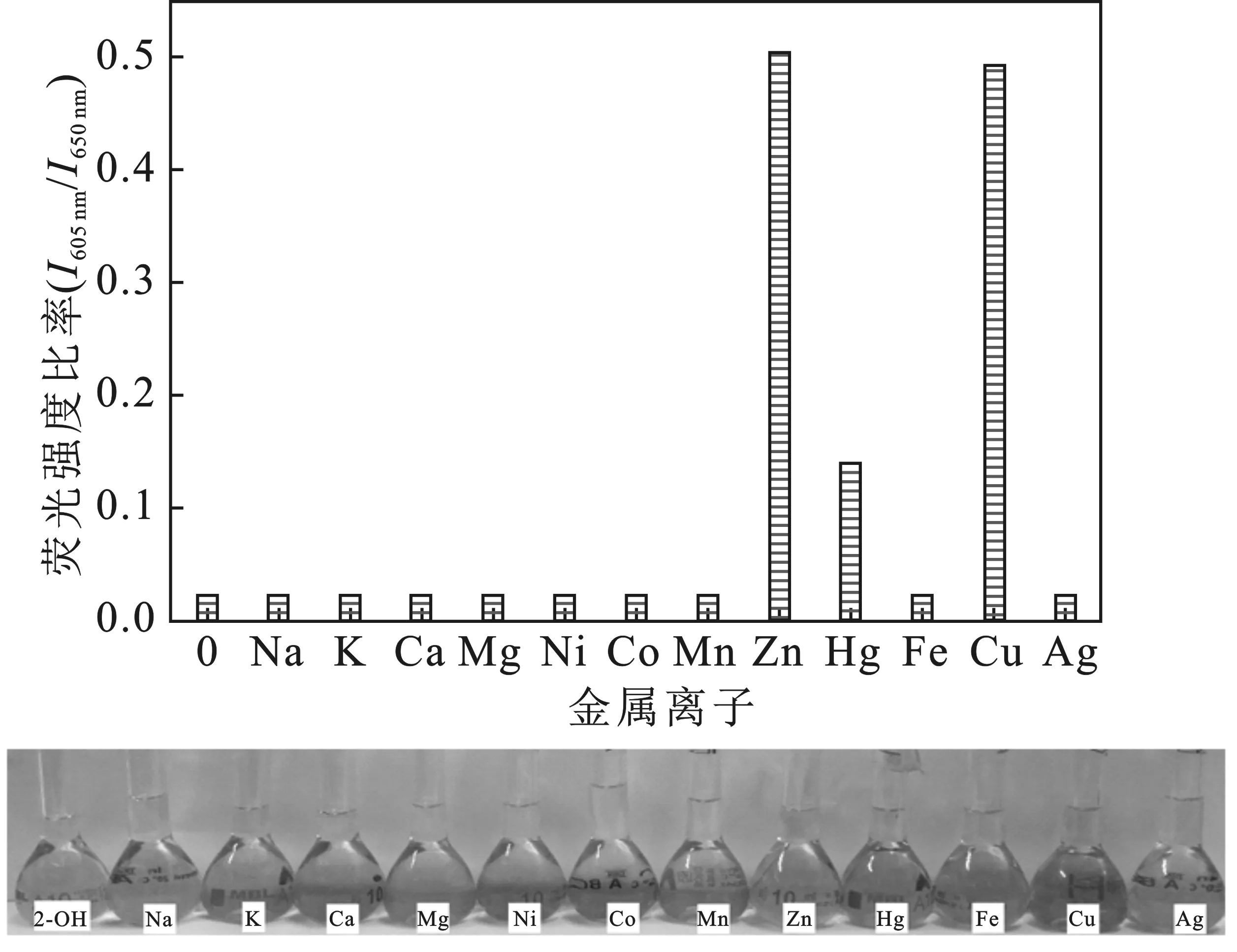
图3 P2OH检测不同金属离子的荧光比率变化Fig.3 The fluorescence ratio changes of P2OH bydetecting different metal ions
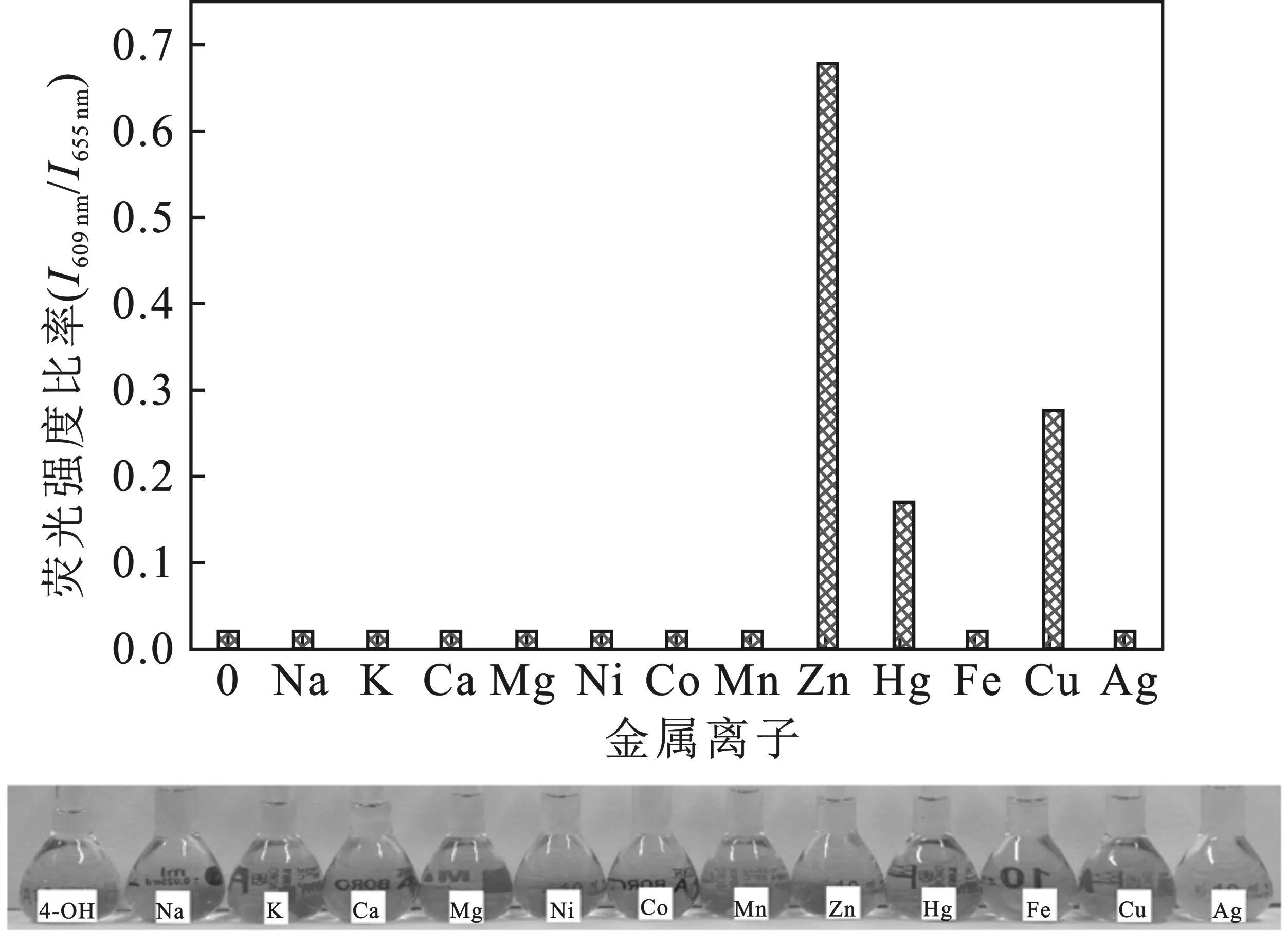
图4 P4OH检测不同金属离子的荧光变化Fig.4 The fluorescence ratio changes of P4OH bydetecting different metal ions
由图可知,只有在Hg2+存在下,检测体系才会发生明显的变色(由紫色变为黄绿色)。除了Zn2+,Cu2+和Hg2+,大部分金属离子的I605 nm/I650 nm和I609 nm/I655 nm荧光发射峰强度比值很小。Cu2+体系荧光衰减较快,荧光峰强度不稳定;Zn2+体系虽然有两个峰,对金属离子浓度改变不敏感,且其系统无颜色变化,检测灵敏性低。只有Hg2+检测体系,既有有效的荧光峰强度,又保证在两个波长处发射峰明显的区别,且显示荧光体系从紫红变为黄绿色。
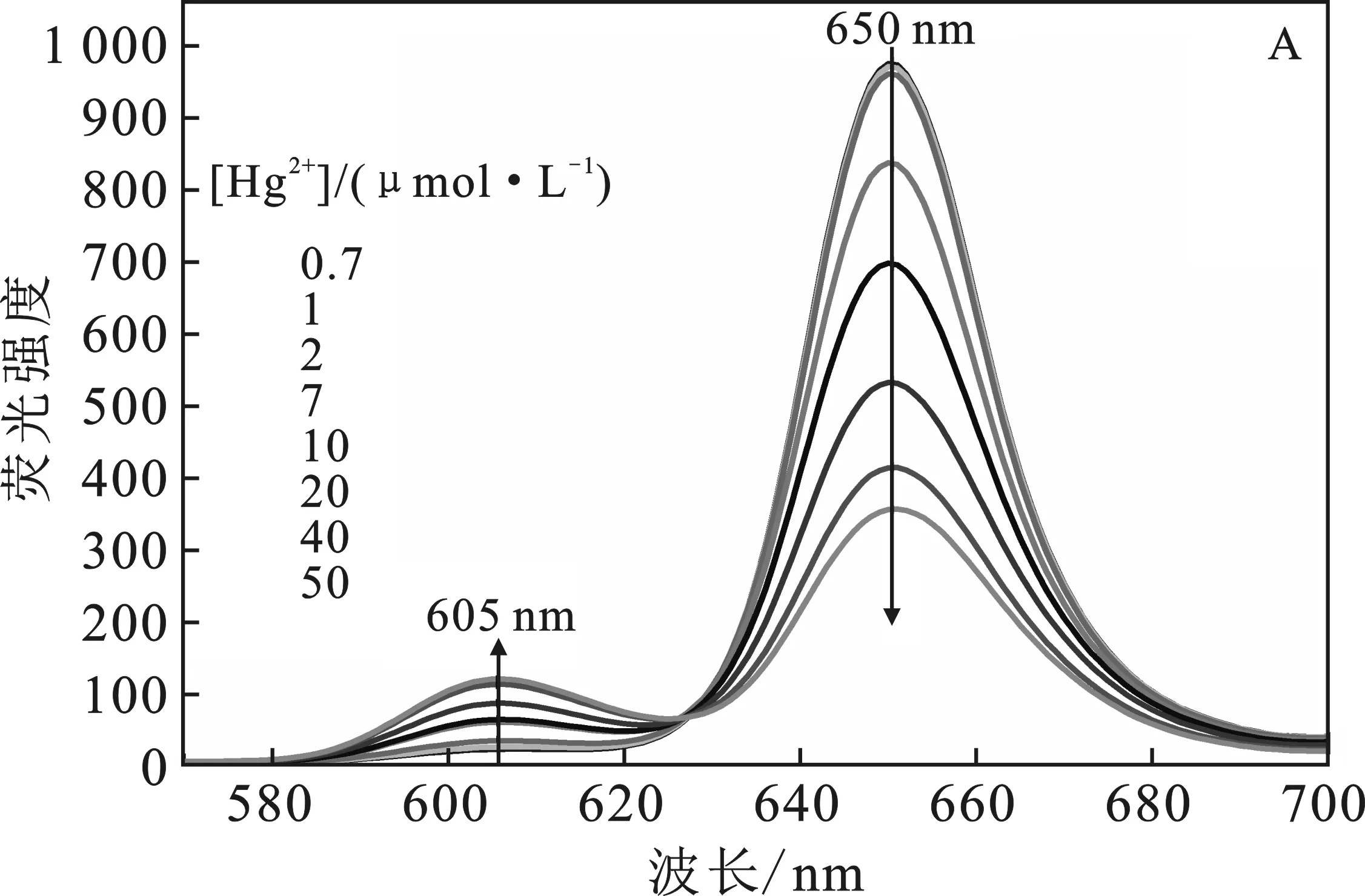
2.2.2 P2OH和P4OH荧光检测痕量Hg2+的灵敏度比较 在0.2~50 μmol/L Hg2+溶液中,分别利用P2OH和P4OH检测Hg2+,结果见图5A和图6A。
由图可知,随着Hg2+浓度的增加,P2OH和P4OH在605 nm和609 nm处荧光发射峰的强度升高,在 650 nm 和655 nm处的荧光发射峰的强度降低,导致荧光比率值增加。通过荧光比率值取对数后,对Hg2+浓度的对数值进行拟合,结果见图5B和图6B。
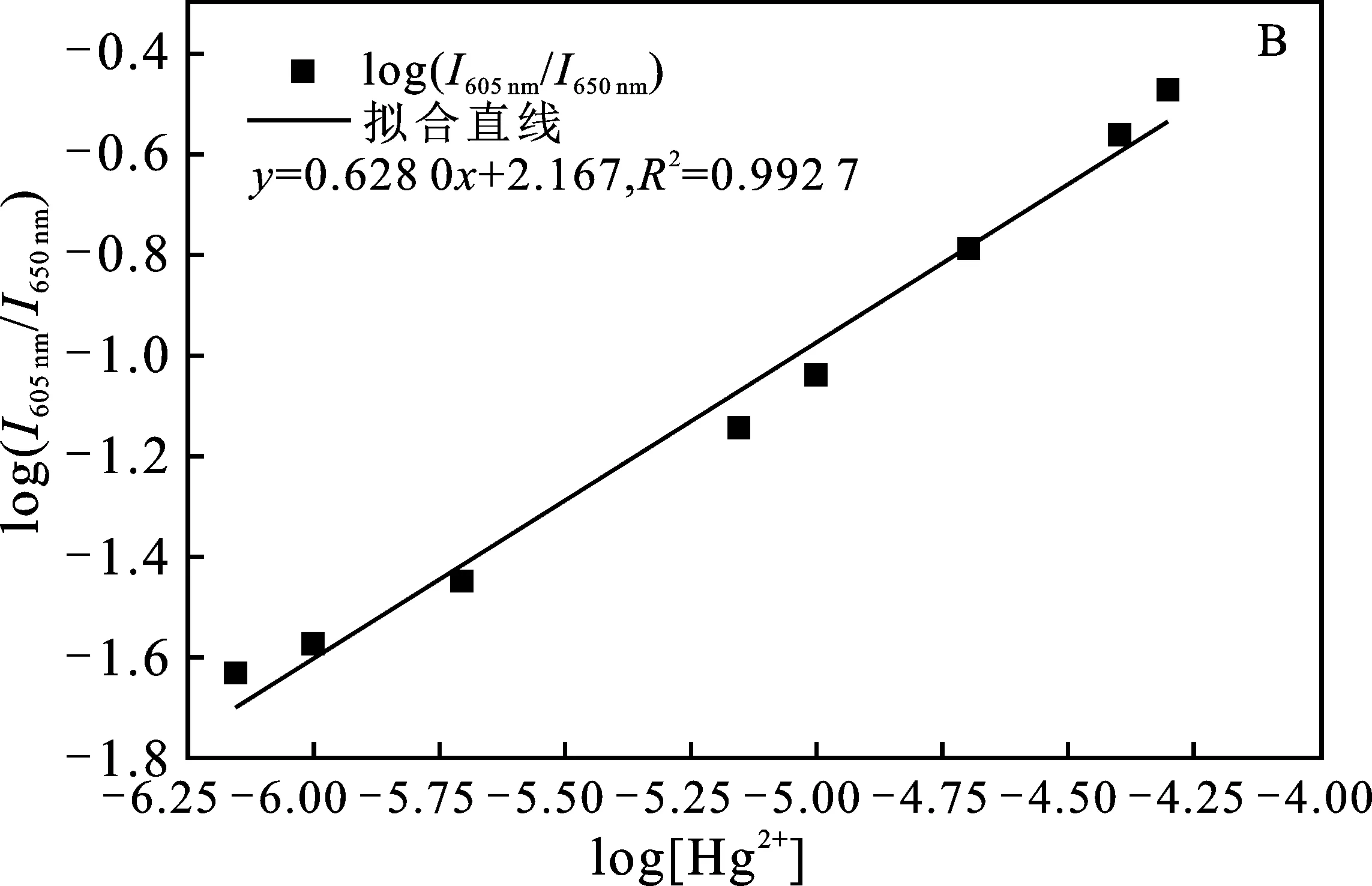
图5 P2OH检测不同浓度的汞离子Fig.5 The fluorescence detection of Hg2+ by P2OHA.荧光变化图;B.荧光比率变化拟合结果
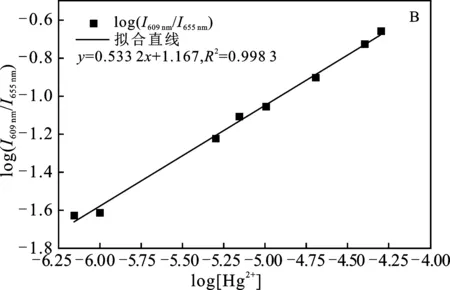
图6 P4OH检测不同浓度的汞离子Fig.6 The fluorescence detection of Hg2+ by P4OHA.荧光变化图;B.拟合直线
由图可知,拟合直线相关系数都在0.99以上,P2OH和P4OH对汞离子的检测均具有较高的准确性,P4OH的准确性更高,拟合系数达0.998 3。

参考文献[10],通过多次检测空白溶液,计算荧光标准偏差,得到P2OH和P4OH对Hg2+的检出限见表2。
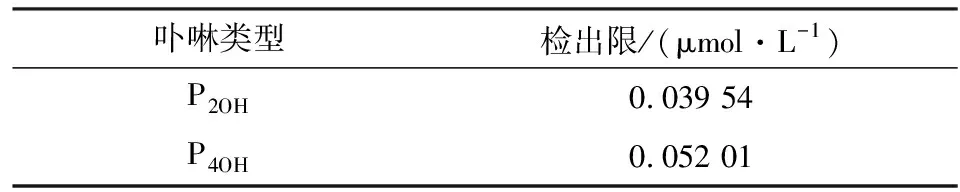
表2 两种对称中位取代羟基卟啉的荧光检测下限Table 2 Detection limits of two symmetricallysubstituted hydroxyporphyrins
由表2可知,检出下限总体处于同一数量级,且P2OH的检出限更低。这主要是P4OH分子中卟啉环外围中位含有更多的羟基,导致探针分子之间氢键作用较强,使其自身更容易聚集导致。
2.2.3 不同pH条件下P2OH和P4OH检测体系稳定性 选取Hg2+浓度为0.05 mmol/L体系,以pH=6的醋酸-醋酸钠缓冲溶液为基础,分别使用1 mol/L盐酸和1 mol/L 氢氧化钠在酸度计监测下,配制pH在2~10,不同的缓冲体系,作为不同的稀释剂,测试体系在不同pH值下的荧光光谱变化。记录P2OH和P4OH检测体系在 605 nm 和 609 nm、650 nm 和 655 nm 处的荧光强度,得到两种卟啉的荧光比率值随pH变化的关系曲线,见图7和图8。

图7 不同pH 条件下P2OH-Hg2+体系荧光变化Fig.7 The fluorescence ratios of P2OH-Hg2+under different pH
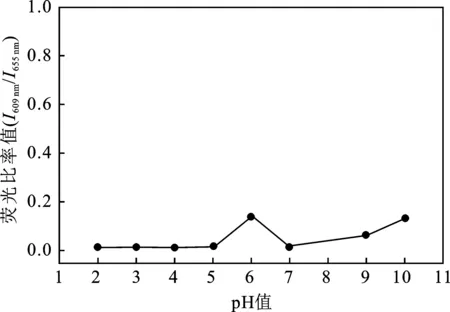
图8 不同pH 条件下P4OH-Hg2+体系荧光变化Fig.8 The fluorescence ratios of P4OH-Hg2+under different pH
由图可知,P2OH体系在pH值为3~9的范围内比较稳定,在pH为6时荧光比率值出现拐点;P4OH荧光体系在pH值为2~10的范围内,荧光比率值稳定。比较两个曲线发现,当对称性卟啉环外围取代羟基数目增加时,检测体系荧光比率值在上述pH范围内数值更稳定。尤其当溶液pH值在2~10内范围内变化,P4OH检测体系的荧光比率值几乎保持不变。这是因为P4OH外围取代羟基存在解离平衡,羟基上氢离子的数目较多,更易平衡体系的酸碱变化,从而增加检测溶液的pH稳定性。
2.2.4 P2OH和P4OH的时间稳定性比较 选取Hg2+浓度为0.05 mmol/L的检测体系,连续测定10 min内其溶液的荧光光谱,同时记录P2OH和P4OH在 605 nm 和 609 nm、650 nm和655 nm处的荧光强度,结果见图9、图10。
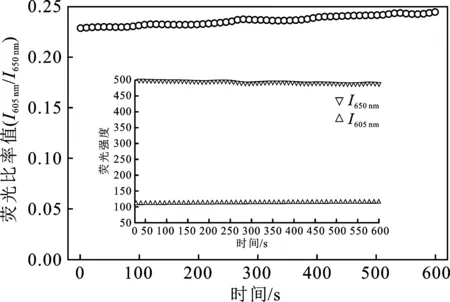
图9 P2OH-Hg2+体系时间稳定性Fig.9 The fluorescence ratios ofP2OH-Hg2+ in 10 mins
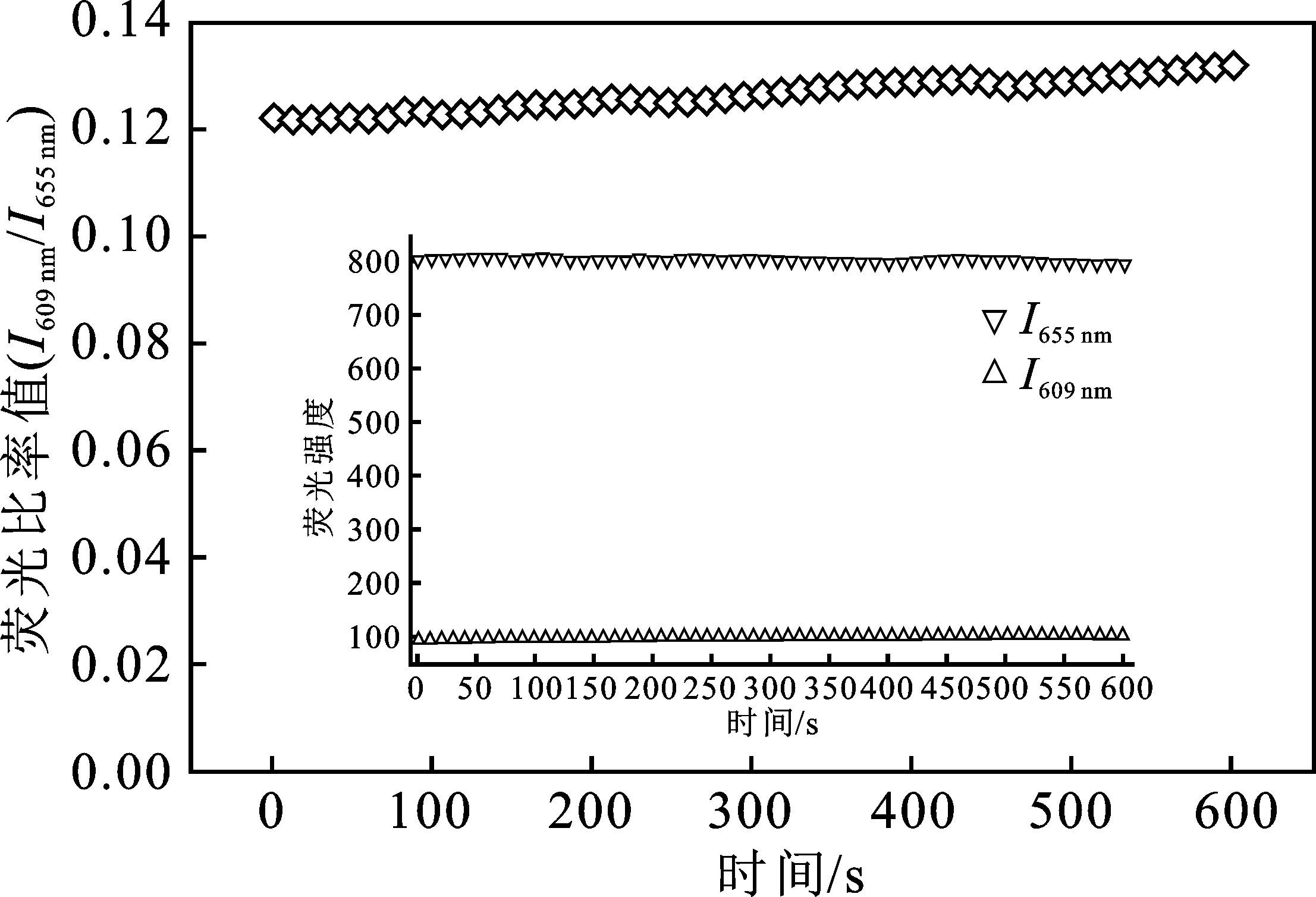
图10 P4OH-Hg2+体系时间稳定性Fig.10 The fluorescence ratios of P4OH-Hg2+ in 10 mins
由图可知,10 min内,P2OH和P4OH的荧光强度基本保持稳定,荧光比率值略有上升。因此,P2OH和P4OH荧光探针在10 min内检测体系荧光比率值稳定,满足实际观测的时间要求。
2.3 P2OH和P4OH与Hg2+的结合性分析
为探明P2OH和P4OH与Hg2+的结合性强弱,利用Gaussian09软件的B3LYP模式6-31G (d) basis set,对其轨道能量进行计算,并分析meso-羟基及中心N在卟啉轨道中的含量百分比,结果见图11和表3。

图11 两种羟基卟啉的轨道能量图Fig.11 Orbital energy of two hydroxyporphyrins
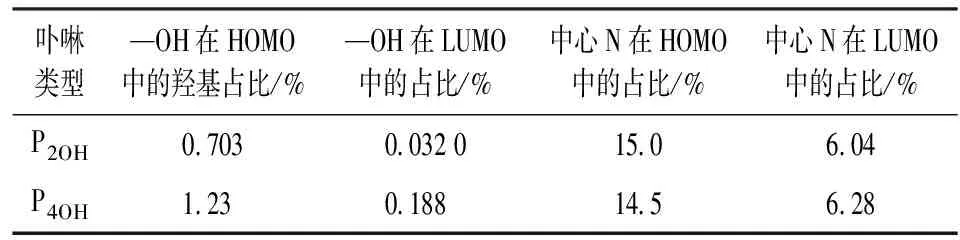
卟啉类型—OH在HOMO中的羟基占比/%—OH在LUMO中的占比/%中心N在HOMO中的占比/%中心N在LUMO中的占比/%P2OH0.7030.032 015.06.04P4OH1.230.18814.56.28
当meso-羟基数目增加时,探针分子最高占据分子轨道(HOMO)和最低未占分子轨道(LUMO)的轨道能量均上升,但其禁带宽度呈下降趋势。这表明,P4OH分子在检测过程中更容易被激发。从 —OH及中心N的轨道占比可推测:当探针分子中的meso-羟基数目增加时,其对探针分子的HOMO和LUMO轨道能量的贡献均有不同程度的上升,meso-羟基取代对HOMO的增加更显著。这说明随着meso-羟基数目的增加,外围羟基作为金属离子配位点的结合几率增加,而中心N与金属离子的配位几率下降。
3 结论
(1)合成了两种对称结构的中位羟基取代卟啉P2OH、P4OH,并利用二者荧光检测水体Hg2+,检测体系不但显示明显的颜色变化(从紫红到黄绿色),而且显示荧光比率变化。两种羟基卟啉荧光检测体系的荧光比率值对数与水体汞离子浓度的对数,具有较强的线性相关性,拟合系数均高于0.99,检测下限分别达0.039 54 μmol/L和0.052 01 μmol/L。
(2)检测体系荧光稳定性较强,P2OH和P4OH检测体系在10 min荧光强度均稳定,且在pH值为3~9范围内均维持稳定。
(3)轨道计算结果显示,随着meso-羟基数目增加,羟基卟啉倾向于通过中位N及卟啉环外围 —OH 共同结合更多Hg2+,卟啉环外围中位羟基作为金属离子配位点的结合几率增加,而中心N与金属离子的配位几率下降。
(4)对水体Hg2+的检测过程中,P4OH比P2OH显示了更优异的荧光检测特性。
