改性膨润土对水中全氟辛酸的吸附性能研究
2021-12-15丁倩云孙建强洪雷
丁倩云,孙建强,洪雷
(兰州交通大学 环境与市政工程学院,甘肃 兰州 730070)
全氟辛酸(PFOA)是一种代表性的全氟烷基酸类化合物(PFAAs),具有疏水疏油性、难降解性及毒性,可在大多数水体中检出[1-4]。传统水处理技术不能将其有效去除,吸附法作为一种高效且操作便捷的处理方式被广泛用于水中PFAAs的去除研究[5]。膨润土(BENT)是具有较强离子交换和吸附能力的亲水性矿物材料,常作为吸附剂使用。利用十六烷基三甲基溴化铵(CTAB)改性BENT,可使其转为疏水性的同时,层间距增大,有利于吸附水中的低溶解性有机污染物[6-7],CTAB-BENT吸附水中PFOA的机理和性能研究较少。
本研究以CTAB-BENT为吸附剂,从吸附热力学和动力学角度探讨了PFOA在CTAB-BENT上的吸附机理,并考察了溶液pH值的影响。
1 实验部分
1.1 试剂与仪器
膨润土(BENT,钠基),购自甘肃白银;全氟辛酸 (PFOA,纯度≥96%),购自SIGMA-ALDRICH公司;十六烷基三甲基溴化铵(CTAB)、聚合硫酸铁(PFS)均为分析纯;甲醇,色谱纯;去离子水。
Waters Alliance型高效液相色谱-质谱联用仪;HC-C18液相色谱柱 (5 μm,250 mm×4.6 mm);SHA-82A恒温振荡器;WD900L23-2家用微波炉。
1.2 CTAB-BENT的制备
将一定质量的CTAB与聚合硫酸铁溶液混合,搅拌30 min。加入预处理的钠基膨润土,于80 ℃的微波反应器中反应一段时间,以进行有机改性。所得溶液静止,并离心分离,用去离子水洗涤材料至废液中溴离子不得检出。于105 ℃烘干。研磨为 100目,即为吸附用有机改性膨润土CTAB-BENT。
1.3 吸附实验
以250 mL的聚丙烯锥形瓶作为反应容器,加入20 mg的CTAB-BENT和100 mL含不同浓度PFOA的水样,进行静态吸附实验。使用0.1 mol/L盐酸和0.1 mol/L氢氧化钠调节溶液的pH值。经 0.2 μm 的玻璃纤维膜过滤后,用高效液相色谱-质谱联用仪测定水样中PFOA含量。所有实验均重复3次,取平均值。
2 结果与讨论
2.1 CTAB-BENT表征
2.1.1 XRD 有机改性前后膨润土的XRD图谱见图1。
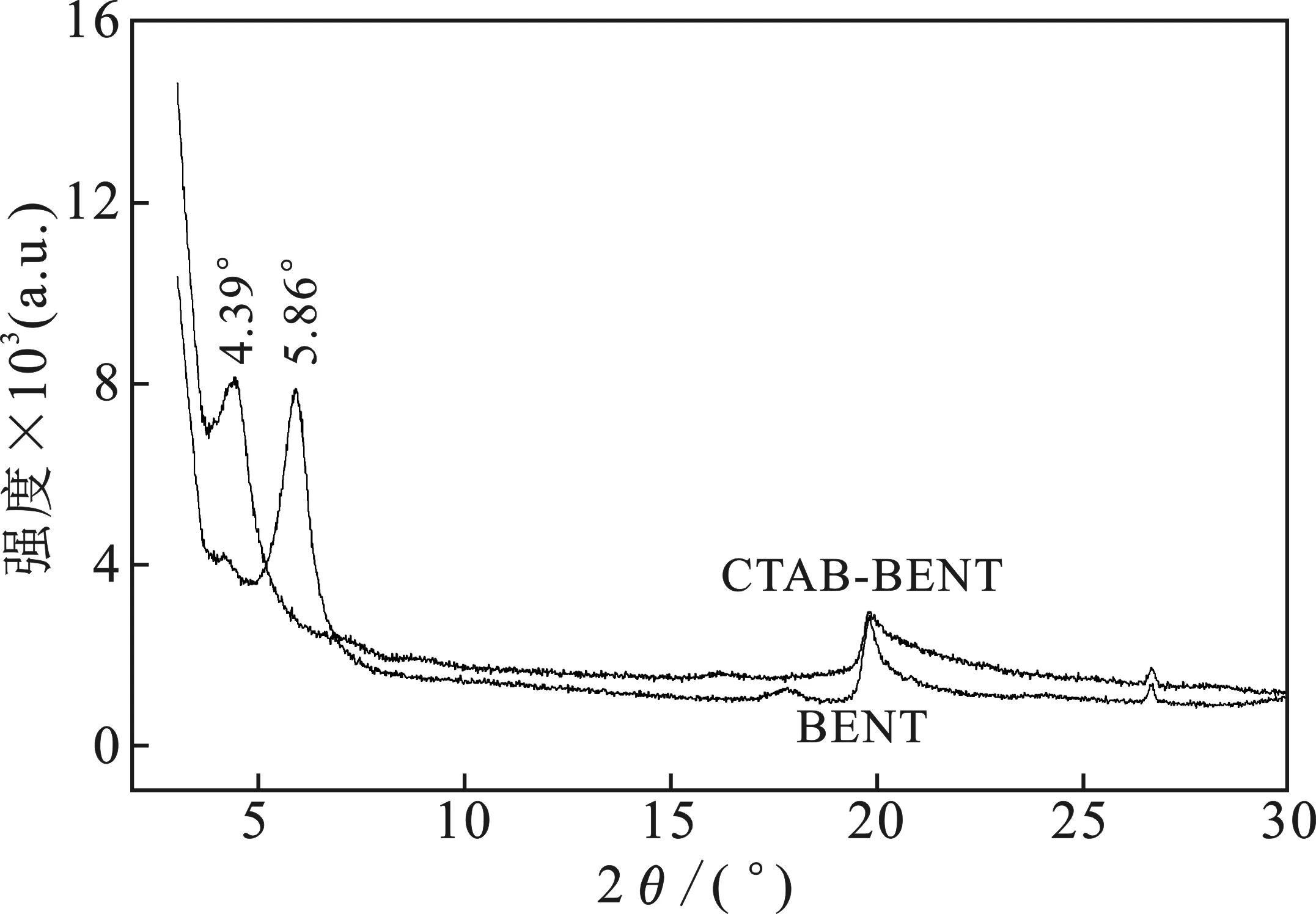
图1 原膨润土和CTAB-BENT的XRD图谱Fig.1 XRD map of BENT and CTAB-BENT
由图1可知,改性前的膨润土特征峰2θ为 5.86°,其层间距为1.06 nm;有机改性后的膨润土CTAB-BENT特征峰为4.39°,其层间距增至 1.48 nm,表明CTAB的引入使得膨润土层间距变大。改性前后特征峰所处位置几乎未变,证明改性后膨润土晶型仍为较完整的晶体结构。
2.1.2 FTIR 图2为有机改性前后膨润土的傅里叶红外光谱图(FTIR)。

图2 原膨润土与CTAB-BENT的傅里叶红外光谱图Fig.2 FTIR of BENT and CTAB-BENT
由图2可知,改性前后,膨润土的FTIR图中峰形基本不变,证明膨润土的片层结构并未因改性而破坏。BENT的特征峰在CTAB-BENT的FTIR中大部分存在,但在CTAB-BENT的FTIR上产生了新的特征峰,CTAB中C—H不对称伸缩振动的特征峰在2 918.3 cm-1处显示,C—H弯曲振动的特征峰在 2 848.16 cm-1处显示,证明了长碳链的出现,故CTAB可通过阳离子交换进入膨润土双层结构,并使膨润土的层间距增大,这与XRD的结果一致。
2.2 吸附等温线
图3为CTAB-BENT在288,298,313 K三个温度下对PFOA的吸附等温线。
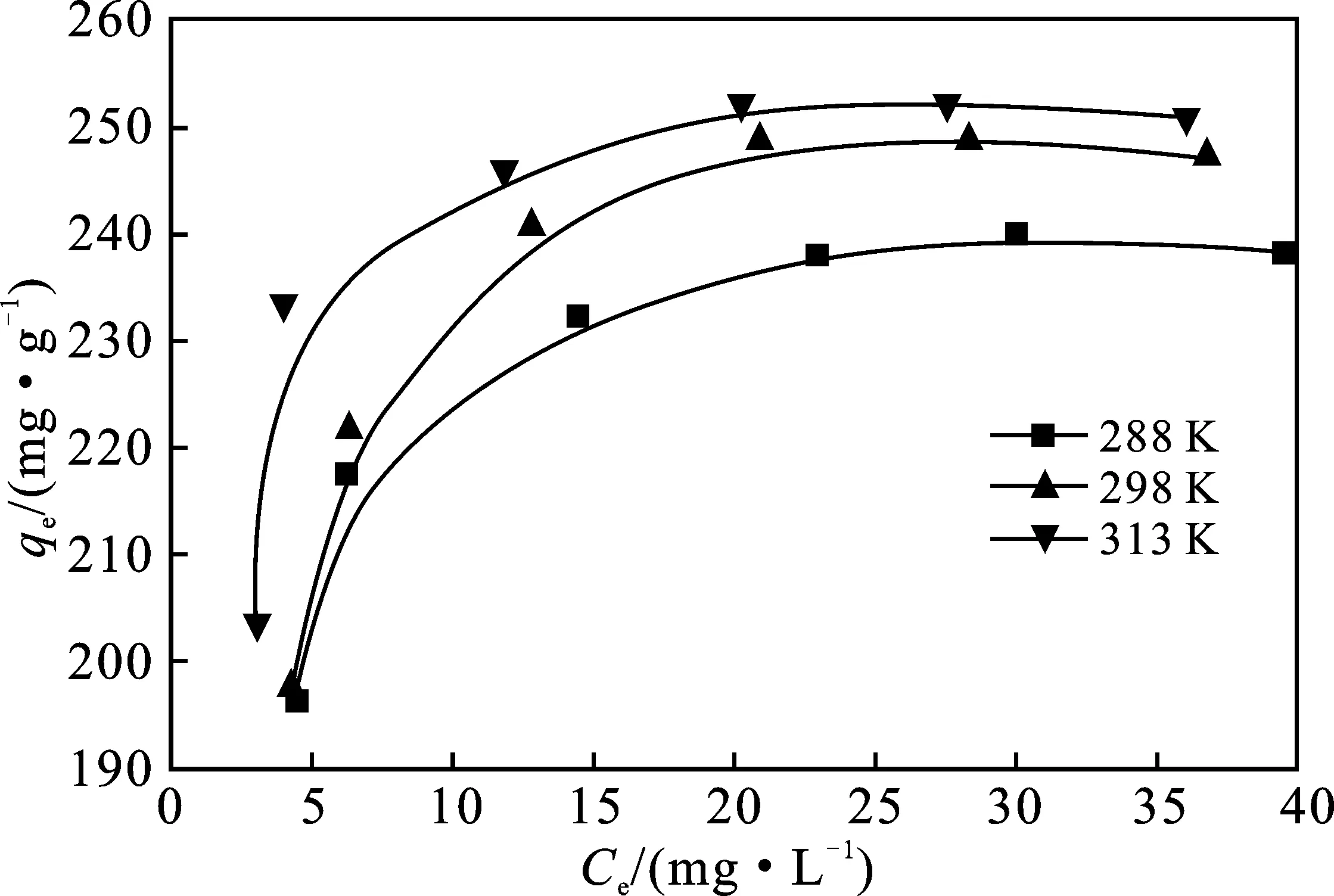
图3 PFOA的吸附等温线Fig.3 Adsorption isotherm of PFOA
为探究CTAB-BENT对PFOA的吸附机理,分别用Langmuir、Freundlich模型拟合上述实验数据[8],结果见表1。
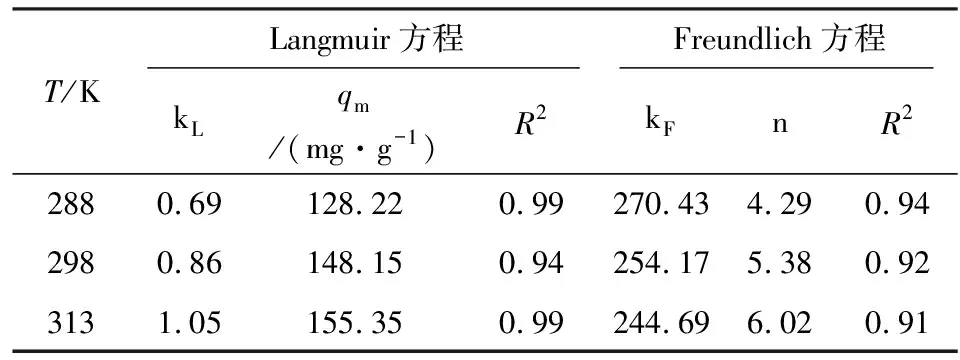
表1 Langmuir和Freundlich模型拟合相关参数Table 1 Parameters of Langmuir and Freundlich model
(1)
(2)
式中qe——吸附平衡时单位质量吸附剂吸附容量,mg/g;
Ce——溶液平衡浓度,mg/L;
qm——饱和吸附量,mg/g;
kL——Langmuir系数;
kF——Freundlich模型系数;
n——代表非线性程度。
由表1可知,Langmuir模型可以更好地描述CTAB-BENT对PFOA的吸附行为,这说明CTAB-BENT对PFOA的吸附更倾向于单层吸附,在温度为288,298,313 K时,CTAB-BENT对PFOA的最大吸附量分别为128.22,148.15,155.35 mg/g。
2.3 吸附热力学
CTAB-BENT对PFOA的吸附热力学参数可由下式求得[9]:
(3)
ΔG0=-RTlnKd
(4)
(5)
式中 ΔG0——吸附吉布斯自由能,kJ/mol;
ΔS0——标准熵变,J/(mol·K);
ΔH0——标准焓变,kJ/mol;
R——气体常数,8.314 J/(mol·K);
T——绝对温度,K;
Kd——热力学常数。
根据上式可得到不同温度下的Kd,再对lnKd和1/T作图,由拟合式的斜率及截距值计算出ΔS0和ΔH0值[10-11]。CTAB-BENT对PFOA吸附标准热力学参数ΔG0、ΔS0和ΔH0见表2。
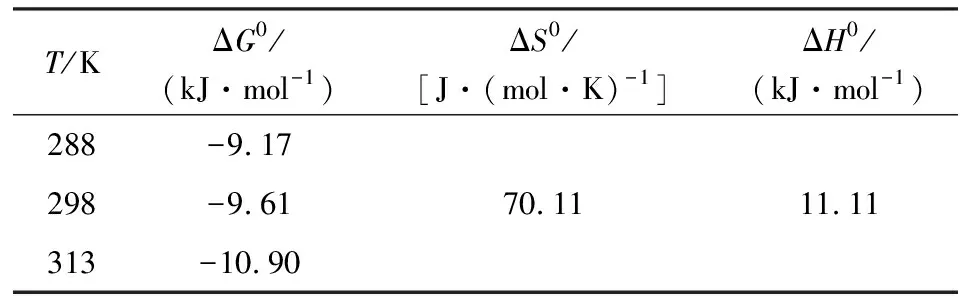
表2 PFOA吸附的热力学参数Table 2 Thermodynamic parameters of PFOA adsorption
由表2可知,吸附自由能变(ΔG0)在不同温度下均为负值,且其值介于-20~0 kJ/mol,表明CTAB-BENT对PFOA的吸附属于自发的物理吸附反应,吸附过程中自由能的减小,使得CTAB-BENT有吸附水中PFOA的驱动力。ΔG0绝对值随温度的增大而增大,则表明吸附的驱动力随温度升高而增大,升温有利于PFOA的吸附反应[12]。
ΔH0值为正值11.11 kJ/mol,说明该反应为吸热过程,同时吸附过程中几乎不存在范德华力、化学键、配位体交换等作用力[13]。分析ΔH0为正值原因,当溶液中PFOA浓度增加时,CTAB-BENT会吸附更多的PFOA,使得其表面可用吸附位点减少,随着反应的进行,吸附剂的表面拥挤而反应强度减弱,造成热效应增加趋势变小,吸热效应强于此时的放热效应,反应整体呈吸热趋势。
ΔS0为正值70.11 J/(mol·K),说明整个吸附过程是一个无序度增大的过程。原因是吸附过程中,PFOA在吸附剂CTAB-BENT上的吸附伴随着其他官能团在活性位点上的脱附,当溶质分子吸附引起的熵减效果不如溶剂分子脱附引起的熵增时,整个吸附过程便呈现熵增现象,导致吸附剂表面的固-液界面无序性增强[14]。
2.4 吸附动力学
图4为CTAB-BENT对PFOA在288,298,313 K三个温度下的吸附动力学曲线。
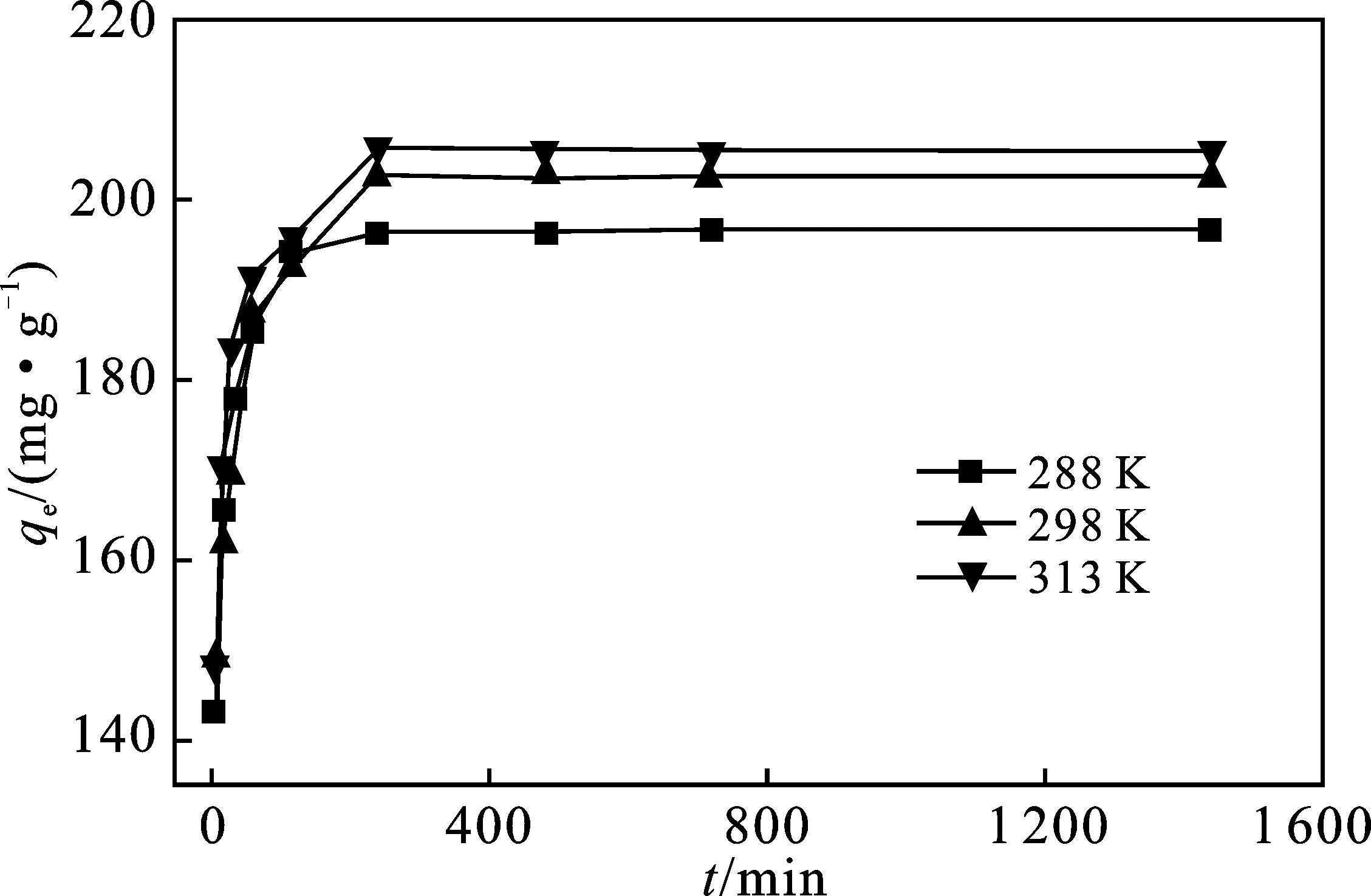
图4 PFOA的吸附动力学Fig.4 Adsorption kinetics of PFOA
由图4可知,三种温度下,在4 h内PFOA在CTAB-BENT上的吸附量均迅速增大,而4 h后吸附量几乎不再变化。
分别用伪一级、伪二级动力学方程拟合实验数据[15],结果见表3。
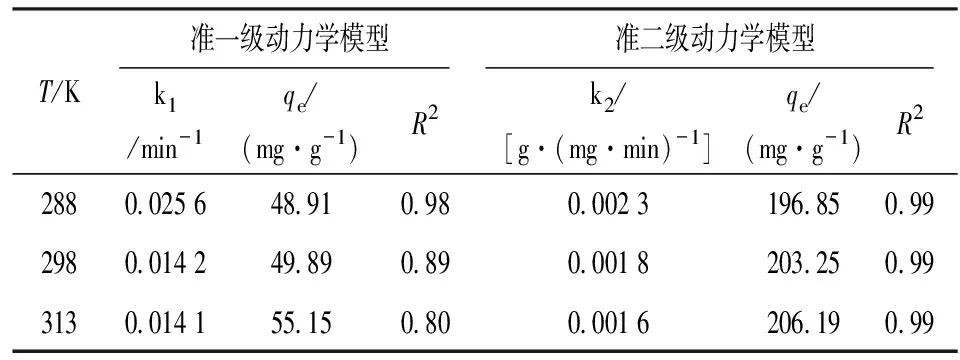
表3 PFOA吸附的动力学拟合参数Table 3 Kinetic fitting parameters of PFOA adsorption
伪一级动力学方程ln(qe-qt)=lnqe-k1t
(6)
(7)
式中qe——平衡时的吸附容量,mg/g;
k1——伪一级反应速率常数,min-1;
k2——伪二级反应速率常数,g/(mg·min)。
由表3可知,伪二级动力学方程可更好地描述CTAB-BENT吸附PFOA的过程,说明整个吸附过程除表面吸附外,还包括液膜扩散现象、颗粒内部扩散等现象[16]。
2.5 溶液pH的影响
溶液pH的变化可导致吸附剂的表面化学性质及PFOA在水溶液中的存在形式和溶解度发生变化,从而影响吸附过程[17]。配制40 mg/L的PFOA溶液100 mL,于25 ℃时投加20 mg的吸附剂CTAB-BENT,调节溶液pH,4 h后各pH情况下PFOA的去除率见图5。
由图5可知,pH值在3~9内,随着溶液pH值的升高,CTAB-BENT对PFOA的去除率降低。原因是pH较低时,使CTAB-BENT表面带有正电荷,与以阴离子形式存在的PFOA间形成较强的静电引力作用,从而增强吸附效果。相反,当溶液pH较高时CTAB-BENT表面开始带有负电荷,静电排斥作用使得吸附能力减弱。
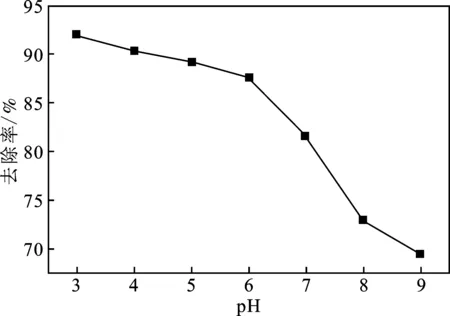
图5 溶液pH值对PFOA吸附的影响Fig.5 Effect of pH on the adsorption of PFOA
3 结论
(1)PFOA在CTAB-BENT上的吸附行为符合伪二级动力学模型及Langmuir等温模型。在温度为288,298,313 K条件下的最大吸附量分别为 128.22,148.15,155.35 mg/g,显示出较好的温度正相关性。
(2)吸附热力学表明,PFOA在CTAB-BENT上的吸附是一个自发的物理吸附过程,过程中无配位交换、化学键作用。CTAB-BENT对PFOA吸附是熵增过程,熵变值为70.11 J/(mol·K),吸附自由能减小是CTAB-BENT吸附PFOA的主要驱动力。
(3)pH介于3~9时,随pH的增大,CTAB-BENT对水中PFOA的去除率降低。
