聚合物纳米粒子对毒素蛋白的抑制性能研究
2021-12-15高胜李晓晓鲁希华
高胜,李晓晓,鲁希华
(东华大学 化学化工与生物工程学院,上海 201620)
贫困地区的蛇咬伤问题一直难以攻克[1-2]。目前只能通过注射抗蛇毒血清治疗[3],但是抗蛇毒血清生产成本高,周期长,且不易携带,在贫困地区施用困难[4-5]。因此需要一种廉价且有效的替代药物。无毒共聚物纳米粒子作为替代治疗方案,逐渐显示出优势[6-7]。通过在聚合物中掺入具有与靶标大分子互补官能团的单体,其可以与毒素蛋白大分子的多个表面位点相互作用,从而有效抑制靶标的毒性[8-9]。且该纳米粒子成本低,易合成,方便携带[10-11]。本文以尖吻蝮蛇毒蛋白为实验对象,合成了多种含有不同官能团的聚合物纳米粒子,以筛选出对其具有良好抑制作用的粒子。为今后毒素蛋白的抑制研究提供理论依据。
1 实验部分
1.1 材料与仪器
N-异丙基丙烯酰胺、丙烯酸、N,N-亚甲基双丙烯酰胺、十二烷基硫酸钠、过硫酸铵(APS)、N-叔丁基丙烯酰胺、N-苯基丙烯酰胺、N-环己基丙烯酰胺、N-(4-(三氟甲基)苄基)丙烯酰胺、N-苯乙基丙烯酰胺、N-丙烯酰基苯丙氨酸、磷酸缓冲液、酪蛋白、血清、氢氧化钠、考马斯亮蓝R250和分子量Mark、尖吻蝮蛇毒液干粉末均为分析纯。
BI-200SM型动态光散射仪;JEM-2100型透射电子显微镜;UV-1800型紫外分光光度计;164-5050型基础电泳仪。
1.2 纳米凝胶的制备
采用乳液聚合法制备纳米凝胶NPs。将单体、交联剂和乳化剂在超纯水中混合至最终摩尔浓度为65 mmol/L,在氮气保护下搅拌60 min脱气。加入引发剂APS,并加热至70 ℃反应4 h。将反应混合物暴露于空气中,终止聚合。将反应混合物转移至透析袋中透析,除去反应原料和乳化剂等[12]。

图1 NPs合成示意图Fig.1 The synthesis of the NPs
1.3 蛋白酶抑制实验
将纳米凝胶浓缩,配制成5 mL凝胶溶液,加入1 mL粗蛇毒液,在37 ℃下温育15 min。加入1%酪蛋白,在37 ℃下孵育24 h。添加750 μL 5%的三氯乙酸,以沉淀未被蛇毒水解的酪蛋白。在25 ℃下以5 000 r/min离心10 min。将上清液与NaOH(1∶1体积)混合,在340 nm处测量UV吸光度(A样品)。实验平行进行3次。蛇毒抑制率0%和100%对照组的紫外数值分别为A空白和A对照。
抑制率(%)=[1-(A样品-A空白)/(A对照-A空白)]×100%
1.4 纳米凝胶的吸附选择
取等体积纳米凝胶与蛇毒在37 ℃下孵育 60 min。以10 000 r/min离心10 min。取出所有上清液,并连续4次用新鲜的磷酸盐缓冲液替换上清液,直到上清液中的蛋白质耗尽为止。纳米颗粒沉淀中添加10 μL的2X加载染料和10 μL缓冲溶液进行染色。同样,向纯蛇毒中加入10 μL 2X染料和10 μL缓冲液进行染色。将染色的样品在95 ℃下加热10 min,以5 000 r/min离心5 min。通过SDS-PAGE进行电泳实验,并对完成的凝胶拍照,以进行进一步的后续分析。
1.5 纳米凝胶生物相容性实验
将人体纤维细胞离心分散于PBS中,并以每孔20 000个细胞接种在96孔板中。加入150 μL培养基,在37 ℃,5%CO2培养箱中孵育30 min。离心沉淀,除去上清液,并用100 μL新鲜培养基代替。加入MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐),在37 ℃,5%CO2培养箱中温育4 h。离心,将所有培养基替换为DMSO。在37 ℃温育 20 min,通过酶标仪在570 nm处测定吸光度[13]。
2 结果与讨论
2.1 纳米凝胶的合成
NPs与蛋白质之间的相互作用非常复杂,涉及静电作用、氢键作用、空间位阻和疏水作用等多种相互作用[14]。对于大多数NPs,它们与靶蛋白的相互作用与NPs中的单体结构密切相关[15]。通过乳液聚合法合成并组建了一个丙烯酰胺基聚合物NPs库,见表1。

表1 具有不同功能性单体的凝胶库Table 1 Summary of NPs with various functional groups
使用单体包括N-异丙基丙烯酰胺(NIPAm)、丙烯酸(AA)、N,N-亚甲基双丙烯酰胺(BIS)、N-叔丁基丙烯酰胺(TBA)、N-苯基丙烯酰胺(PAA)、N-环己基丙烯酰胺(HAA)、N-(4-(三氟甲基)苄基)丙烯酰胺(3FPAA)、N-苯乙基丙烯酰胺(PEAA)、N-丙烯酰基苯丙氨酸(Aphe),都含有不同的功能性官能团(图2)。这些单体对某些蛋白质具有极好的亲和力[9,16-17]。
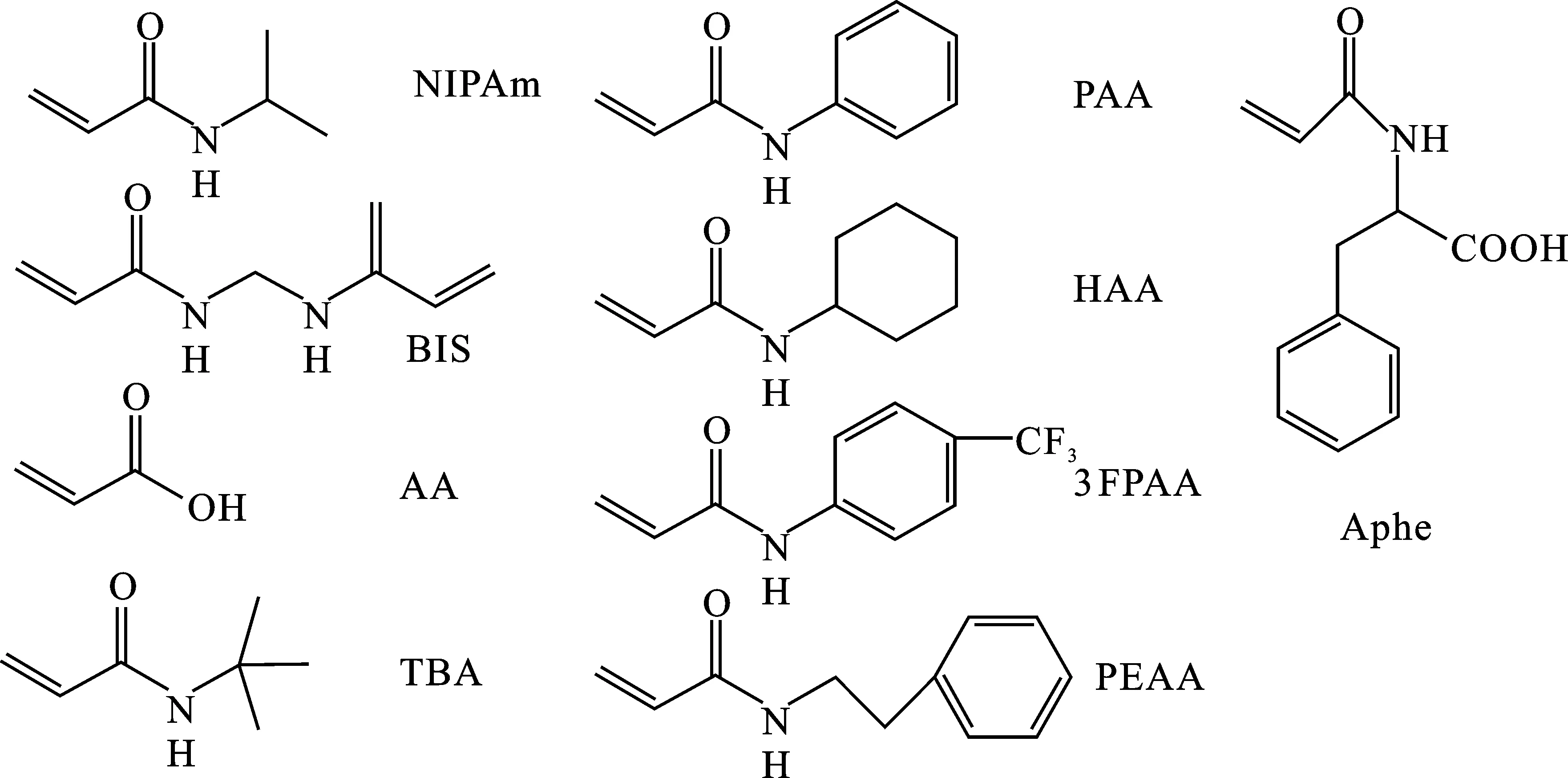
图2 不同单体结构示意图Fig.2 Monomers of the NP library
2.2 纳米凝胶的表征
将透析纯化好的共聚纳米水凝胶用超纯水稀释后,使用动态光散射仪(DLS)观察其尺寸和分散性,结果见表2。

表2 纳米水凝胶的粒径及分散性Table 2 Diameter and PDI of NPs with variousfunctional groups
由表2可知,所有NPs均显示出良好的分散性(PDI <0.1),平均动力学直径为80~100 nm。
使用透射电子显微镜(TEM)观察纳米凝胶的形貌,以 NP 1-3 为例,结果见图3。
由图3可知,合成的纳米水凝胶呈球形,分散良好。

图3 NP 1-3纳米凝胶的TEM形貌图Fig.3 TEM image of NP 1-3
2.3 纳米凝胶的筛选
将NPs与蛇毒混合后,再与偶氮酪蛋白混合,测定NPs(6 mg/mL)对蛇毒(0.25 mg/mL)的抑制作用。该方法是定量分析和研究蛇毒抑制作用的最有效方法(图4),蛇毒中的蛋白水解酶通过破坏底物酪蛋白酶的肽键,使其裂解,并将其片段化为氨基酸,释放的氨基酸可以被定量测定,并且蛇毒中的蛋白酶活性越高,分解的底物酪蛋白酶就越多。因此,可以使用定量分光光度法测定凝胶对蛇毒的抑制率,结果见图5。

图4 蛋白酶实验测定步骤示意图Fig.4 Protease assay used to analyze inhibition of enzymatic hydrolysis of Agkistrodon acutu to casein

图5 不同NPs对尖吻蝮蛇毒的抑制实验Fig.5 Inhibition of Agkistrodon acutu venom by NPswith various functional groups
由图5可知,带有Aphe的NP 1-7对蛇毒的抑制作用高达80%,远高出其他NPs对蛇毒的抑制作用,单体Aphe的存在使得NPs对蛇毒的吸附抑制具有良好的正效应。另外,NP 1-2 与NP 1-1相比,含有阴离子基团的NP 1-2抑制率更高,验证了聚合物中阴离子存在的必要性;NP 1-2、 NP 1-3、 NP 1-4中含有单体的疏水性依次增大,三者对蛇毒的抑制作用也逐次增加,说明NPs保持一定的疏水性更有利于NPs-蛋白的吸附;NP 1-5和NP 1-6中含有的PEAA和3FPAA比NP 1-4的PAA分别多了一个乙基和碳氟基团,但是两者的蛇毒抑制率却小于 NP 1-4,结构中多含有的基团对蛇毒的抑制并没有促进作用;最后,NP 1-5与NP 1-7含有完全相同的官能团,但是两者对蛇毒的抑制作用却分别为20%和80%,差别很大,说明NPs与生物大分子相互作用时,正确的空间效应也不可忽视。综上可知,凝胶NP 1-7对尖吻蝮蛇毒的抑制作用最好。
2.4 NP 1-7的蛋白吸附实验
使用SDS-PAGE观察尖吻蛇毒在NP 1-7上的亲和吸附情况,在反复清洗和过滤毒液与NP 1-7的亲和复合物后,对复合物进行了电泳实验,结果见图6。NPs吸附的蛇毒蛋白显示在吸附蛋白条带中,在吸附条带中有多个纯蛇毒蛋白对应的条带(方框处),证明了NP 1-7对蛇毒的吸附作用。

图6 NP 1-7对尖吻蝮蛇毒的吸附电泳实验Fig.6 SDS-PAGE visualization of venom andstrongly bound proteins by NP 1-7
2.5 血清存在下NPs对蛇毒的抑制率
NPs在体内的功效会受到NPs与血清中其他生物大分子非特异性相互作用的影响[18]。基于 NIPAm 的纳米材料可以在体内迅速的吸附其他生物蛋白,获得蛋白质电晕,初始冠状成分的很大一部分由高度丰富的血清蛋白质白蛋白组成。为了确定血清和NPs之间的相互作用是否会阻碍凝胶对毒液蛋白的中和,在血清存在的环境中进行NPs对蛇毒的抑制实验。将血清和NP 1-7孵育后,再与蛇毒进行孵育,结果见图7。

图7 在不同的血清中NP 1-7(6 mg/mL)对蛇毒(0.25 mg/mL)的抑制作用Fig.7 Inhibition of venom (0.25 mg/mL) by NP 1-7(6 mg/mL) in variable serum
由图7可知,血清与NP 1-7之间的相互作用对NPs的蛇毒中和作用产生了影响,与不存在血清相比,随着体系中血清浓度的逐步增大,NP 1-7对蛇毒抑制作用从80%逐步降低到20%;但是在较低浓度血清下(<40 mg/mL),NP 1-7对蛇毒的抑制作用在50%左右,仍然可观,此时体系中的血清蛇毒含量比已经高达160∶1。
2.6 血清存在下的吸附电泳实验
同样在血清存在的环境下,使用SDS-PAGE电泳实验观察NP 1-7对蛇毒的吸附情况,结果见图8。左边两个条带分别为对照蛇毒条带和血清条带,凝胶吸附条带为血清存在下NP 1-7对蛇毒的吸附情况。

图8 血清和蛇毒同时存在下的NP 1-7吸附实验图Fig.8 NP 1-7 incubated in serum and venom fromAgkistrodon acutus venom
由图8可知,在血清存在的环境下,NP 1-7吸附条带上同样可以看到纯蛇毒所对应的条带(方框处),这说明该凝胶在血清和蛇毒同时存在的情况下,对蛇毒蛋白仍具有一定的吸附作用。也证明了本实验中血清存在下的蛇毒抑制实验结果。
2.7 细胞活性实验
为了评估NPs的安全性和生物相容性,使用MTT法确定与NP 1-7共同培养后人体纤维细胞的存活率,结果见图9。

图9 细胞在不同浓度NP 1-7中的存活率Fig.9 Survival of cells after incubation withdifferent concentrations of NP 1-7
由图9可知,将不同浓度的凝胶NP 1-7(125~1 000 μg/mL)与细胞共同培养24 h,细胞的存活率均可达到95%以上。说明NP 1-7具有良好的安全和生物相容性,有望在将来应用于生物医学或组织工程领域。
3 结论
(1)设计合成并组建了基于NIPAm的共聚物凝胶纳米粒子库,筛选对尖吻蝮蛇毒有抑制作用的粒子。DLS和TEM显示,合成的多种纳米凝胶分散性良好(PDI<0.1);蛋白酶实验发现,含有Aphe单体的纳米粒子NP 1-7对尖吻蝮蛇毒具有较好的抑制作用,抑制率高达80%。
(2)SDS-PAGE电泳实验证明了NP 1-7对蛇毒的吸附作用,即使在血清存在的环境下,凝胶poly(NIPAm-Aphe)对蛇毒仍然具有50%左右的吸附抑制作用。
(3)细胞实验证明NP 1-7纳米凝胶粒子无明显毒性,细胞的存活率均可以达到95%以上,进一步优化的poly(NIPAm-Aphe)纳米凝胶粒子有望应用于人工合成抗体。
