钛氧化物锂离子筛的研究进展
2021-12-15史丹丹许乃才
史丹丹,许乃才
(1.青海省科学技术信息研究所有限公司,青海 西宁 810008;2.青海师范大学 化学化工学院,青海 西宁 810008)
盐湖卤水提锂方法主要有沉淀法[1]、蒸发结晶法、溶剂萃取法[2]、盐析法[3]和吸附法[4]。沉淀法和蒸发结晶法工艺成熟,但步骤繁琐、能耗高,不适用于高Mg/Li比盐湖中提锂。溶剂萃取法虽然对盐度要求不苛刻,但萃取剂价格昂贵,存在一定的毒性和污染。盐析法技术上可行,但存在设备腐蚀严重和锂总回收率低的弊端。吸附法选择性高、对环境友好、锂回收率高、工艺简单,是盐湖卤水提锂最有效的方法。
目前使用的锂离子吸附剂主要包括铝系、锑系、锰系及钛系等。铝系吸附剂选择性高、稳定性好、但制备工序周期长和原料消耗多等弊端至今未能实现工业化[4]。锑系吸附剂选择性高,吸附容量大、溶损小,但目前锑酸盐研究较少且锑具有一定的毒性[5]。锰系特别是尖晶石型锰氧化物锂离子筛具有诸多优势,但高的Jahn-Teller效应和锰溶损率一直是提锂过程中的2个重要缺陷[6]。钛系锂离子筛制备简单、选择性高、吸附容量大且溶损率低,被认为是一种优于锰系锂离子筛的吸附剂[7]。本文从钛氧化物锂离子筛的分类、制备、改性及应用进展等方面对其进行综述。
1 钛氧化物锂离子筛的分类
钛氧化物锂离子筛是以钛盐和锂盐作为原料,通过高温固相、水热/溶剂热、溶胶凝胶等化学物理手段合成离子筛前驱体,再经过酸洗后得到的新型锂离子吸附剂。钛系锂离子筛前驱体主要有两种[8],一种是基于单斜晶相TiO2的偏钛酸型Li2TiO3,另一种是基于立方晶相TiO2的尖晶石型Li4Ti5O12。下面是Li2TiO3和Li4Ti5O12的晶体结构图。
见图1,Li2TiO3中存在有序的层状岩盐结构,也称岩盐型偏钛酸锂,属于C2/c空间群,Z=8,晶格常数a=0.506 23 nm,b=0.878 76 nm,c=0.975 33 nm,β=100.212°,V=0.427 01 nm3。其中Ti原子和O原子以[TiO6]八面体形式存在,两个相邻[TiO6]八面体层之间为Li原子,纯Li原子层和LiTi2原子层交替排列[11]。Li4Ti5O12晶体具有尖晶石结构,属于立方体系,其空间群为Fd3m,晶格常数a=0.836 nm。从晶体结构角度看,Li4Ti5O12具有较好的锂离子扩散路径。其中,O2-离子位于32e的位置,构成FCC点阵,部分Li+位于8a的四面体间隙中,同时部分Li+和Ti4+位于16d的八面体间隙中,其结构式为[Li]8a[Li1/3Ti5/3]16d[O4]32e[12]。
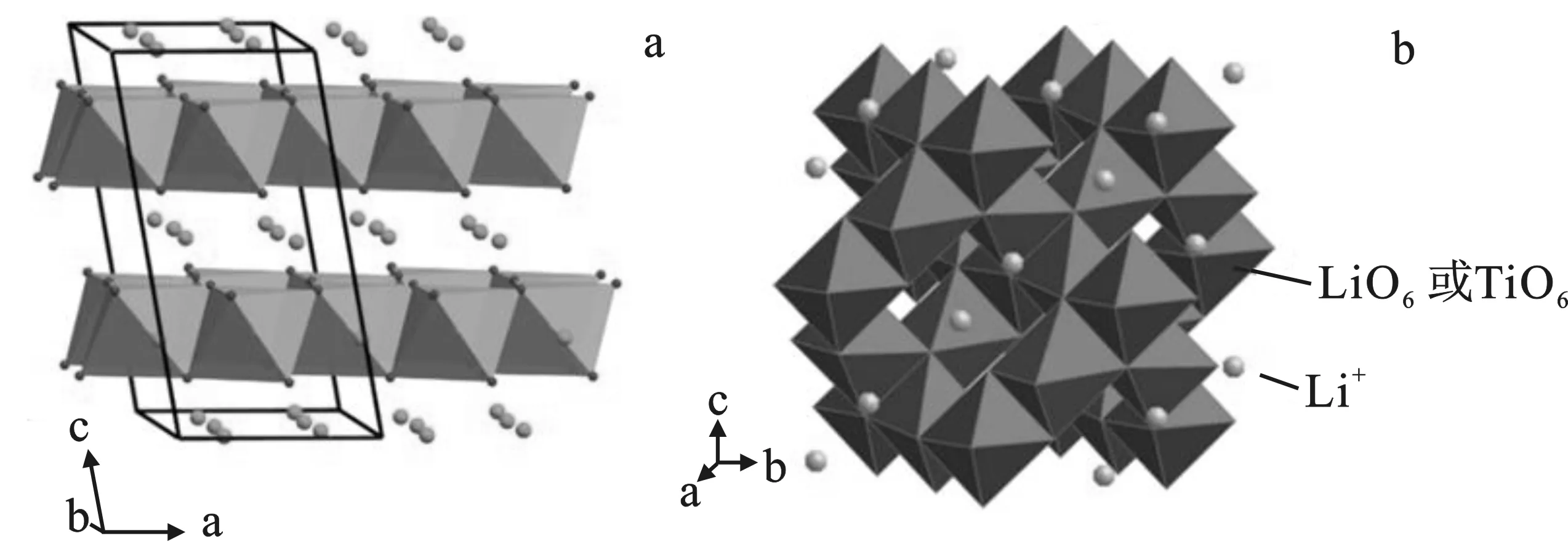
图1 Li2TiO3(a)和Li4Ti5O12(b)的晶体结构示意图[9-10]Fig.1 Crystal structure diagram of Li2TiO3(a)and Li4Ti5O12(b)
2 钛氧化物锂离子筛的制备
钛氧化物锂离子筛制备分两步完成。首先,钛盐和锂盐作为原料在一定条件下合成前驱体;然后脱Li+后得到锂离子筛吸附材料,通常所用的洗脱液为无机酸,洗脱前后前驱体和离子筛的晶型和形貌基本保持不变。下面介绍钛氧化物锂离子筛前驱体的主要合成方法。
2.1 高温固相法
高温固相法,即选用固体钛源和锂源为原料,按照一定计量比例混合后充分研磨,然后将其转移至马弗炉在一定温度下煅烧即可得到锂离子筛前驱体。例如,王妮等[13]以Li2CO3和TiO2为原料,采用高温固相法合成了Li2TiO3锂离子筛前驱体。实验结果表明,当Li2TiO3/TiO2摩尔比为1.05,升温速率为4 ℃/min,温度控制在850 ℃焙烧5 h后,即可制得纯度较高的单斜晶系Li2TiO3。孙冬舒等[14]将TiO2和Li2TiO3以摩尔比为9∶10充分混合后研磨,将其放入马弗炉内900 ℃煅烧24 h后制备了离子筛前驱体Li4Ti5O12。然后将酸洗后锂离子筛H4Ti5O12与PVDF混合,通过相转化法制备了PVDF基锂钛离子筛膜。杨宇彬等[15]以H2TiO3和LiOH为原料,确定Li/Ti摩尔比为0.83,充分研磨混匀后放入马弗炉内煅烧2 h,再升温至700 ℃保温8 h,制得了正钛酸型锂离子筛前驱体。
高温固相法的优点是技术成熟,工艺简单。但存在原料混合不充分,受热不均匀,煅烧后颗粒尺寸大小不易控制,纯度不高,能耗大等缺点。
2.2 溶胶凝胶法
溶胶凝胶法是将锂源和钛源按一定比例在去离子水或有机溶剂中进行溶解,然后将其置于加热装置或空气中进行陈华变成凝胶,再将其放入马弗炉中进行煅烧即可得到锂离子筛前驱体。例如,张理元等[16]将无水醋酸锂、钛酸丁酯、无水乙醇、冰醋酸等配成溶液后按一定比例混合,经过搅拌、升温等程序制备成溶胶、凝胶。然后将高岭土、滑石粉、氧化铝等制备成的多孔陶瓷与凝胶接触,经处理后在高温下煅烧即可得到负载钛酸锂(Li4Ti5O12)的前驱体材料。董殿权等[17]用乙酸盐和柠檬酸为原料,采用溶胶凝胶法制备了LiNi0.05Mn1.95O4锂离子筛前驱体,然后用过硫酸铵洗涤Li+后制得了掺杂型锂镍锰复合锂离子筛,吸附量达到 42.3 mg/g。杨银丛[18]以聚合物纳米管为模板和碳源,以氢氧化锂和钛酸丁酯为原料,通过溶胶凝胶法制备了 Li2TiO3@CNT一维复合锂离子筛前驱体,经盐酸洗涤后得到TiO2@CNT锂离子筛,吸附容量达39.09 mg/g,可以重复利用。
溶胶凝胶法制备的离子筛前驱体晶相纯,粒径小,分布均匀。但操作过程繁琐,反应时间长,且反应条件较苛刻。
2.3 水热/溶剂热法
水热/溶剂热是在高温高压密闭环境中,金属锂源和钛源与其他沉淀剂在有机溶剂或水中发生反应得到超细粉末或纳米孔径离子筛前驱体的方法。例如,陈自正等[19]以TiO2和LiOH·H2O为原料,经水热和煅烧程序制备了纳米级锂离子吸附剂前驱体β-Li2TiO3。然后用盐酸将Li+洗脱后得到锂离子吸附剂H2TiO3,吸附容量达36.16 mg/g,模拟卤水中Li+对Mg2+的分离因子达154.17。孟祥坤[20]以乙酸锂、钛酸丁酯、乙酸铈为金属源,柠檬酸为络合剂,在一定温度下溶剂热处理后将所得产物经干燥、焙烧制备了金属铈掺杂的Li4Ti5O12前驱体,然后通过酸浸制备了钛氧化物锂离子筛。H4Ti5O12的饱和锂吸附容量高达6.849 6 mmol/g,且经过5次循环实验后仍然保持较高的吸附容量。
水热/溶剂热法操作简便,反应温度低,有利于晶体大小控制,制备的离子筛前驱体纯度高,尺寸均一,分散性好。但该方法对反应条件较为严格,且产量不高,一定程度上限制了规模化应用和发展。
2.4 模板法
模板法是将一定浓度的锂源、钛源与模板剂接触,用物理或化学方法将目标物填充到模板剂中,最后通过洗涤或者煅烧的方式去除模板剂,便得到特殊孔道的钛系锂离子筛前驱体。例如,陈玲慧等[21]将合成的聚甲基丙烯酸甲酯作为模板剂,然后用 LiAc·2H2O、TiCl4、草酸、柠檬酸和乙醇等配成一定浓度的前驱液,将其填充至胶晶模板后得到复合物,再经高温煅烧得到三维有序大孔Li4Ti5O12离子筛前驱体。用盐酸对Li4Ti5O12进行酸浸后得到钛氧化物锂离子筛。吸附结果表明,三维有序大孔锂离子筛的吸附容量达7.26 mmol/g,循环利用率高。董殿权等[22]用聚苯乙烯(PS)微球组装晶体胶体模板,并以此作为模板剂合成了三维有序大孔锂离子筛前驱体Li4Ti5O12,通过HCl浸渍后得到钛氧化物锂离子筛。吸附结果表明,H4Ti5O12对Li+的饱和交换容量达56.70 mg/g。
模板法合成钛氧化物锂离子筛具有比表面积大、孔径均匀、排布规整有序等优点,但该方法对模板剂要求高,工艺复杂,步骤繁琐,通过模板剂生成的孔道易坍塌,结构不易控制。
2.5 共沉淀法
共沉淀法是将锂源、钛源等金属离子溶液混合后加入沉淀剂,经沉淀反应得到锂离子筛前驱体的方法。该方法制备的产物化学成分均一,粒度小且分布均匀,具有较大的比表面积,反应过程非常快,适合工业化规模生产。例如,张理元等[23]以硫酸钛、乙酸锂为主要原料,以氨水为沉淀剂,采用沉淀、胶溶、煅烧等程序制备了偏钛酸型锂离子筛前驱体,再用盐酸脱Li+后制备了H2TiO3锂离子筛。江津河等[24]以氢氧化锂、硫酸锰和硫酸钛为原料,以氨水为沉淀剂,双氧水为氧化剂,通过共沉淀和热结晶法制备了尖晶石结构的Li4Mn0.5Ti0.5O4复合氧化物,经HNO3酸洗Li+后得到了钛系锂离子筛。吸附结果表明,Li4Mn0.5Ti0.5O4对Li+具有较好的吸附性能,饱和吸附容量达到5.96 mmol/g,同时,酸洗过程中Mn4+和Ti4+保持了较低的浸出率。
3 钛氧化物锂离子筛的改性
为了进一步优化钛氧化物锂离子吸附剂的结构,通常通过离子掺杂、交联包覆、形貌控制等手段改性吸附材料,以期达到提高锂离子筛的吸附性能和延长循环使用寿命的目的。
3.1 离子掺杂
掺杂是在不破坏原有材料骨架结构的基础上用来优化材料微观结构和性能的常用手段,一般情况下掺杂量不能过高。在选择掺杂对象时,通常要考虑离子的半径、氧化态、化学键强度等性质[25]。对于Li2TiO3和Li4Ti5O12,在原有结构基础上掺杂Zr、Ce、Al等高价态金属离子,以改良原有骨架结构,制备出溶损率低、吸附容量大的掺杂型钛系锂离子筛。例如,王永顺等[26]以钛酸丁酯、乙酸锂和硝酸氧锆为原料,以柠檬酸为络合剂,甲基丙烯酸甲酯(PMMA)微球为模板,通过溶胶凝胶法制备了Zr4+掺杂的锂离子筛前驱体Li4Ti4.98Zr0.02O12,用盐酸洗出Li+后得到了尖晶石结构的钛氧化物锂离子筛。洗脱过程中Ti4+溶损率<0.05%(质量分数),与未掺入Zr4+的前驱体相比,溶损率有较大幅度改善。改型后的锂离子筛对 Li+的吸附容量达 6.43 mmol/g。董殿权等[27]以硝酸铝、硫酸钛、氢氧化锂为原料,通过共沉淀-热结晶法制备了Al3+掺杂的LiAlTiO4前驱体,然后用HNO3脱出Li+后得到了锂离子筛。吸附结果表明,用不同浓度HNO3处理LiAlTiO4时,Li+的抽出率在28%~72%,Al3+的浸出率低于 6.8%,酸型交换剂LiAlTi-700(H)对Li+的饱和交换容量达30.03 mg/g。Wang等[28]以二氧化钛、氢氧化锂和氧化铁为原料,通过高温固相法合成了Fe3+掺杂的锂离子筛前驱体Li2TiO3,再经盐酸脱Li+后得到了锂离子筛Fe/Ti-x(H)。吸附结果表明,材料的BET比表面积有所增加,24 h内 Fe/Ti-x(H)的饱和吸附容量为53.3 mg/g,较未掺杂前(50.5 mg/g)有所提升。
3.2 交联包覆
交联包覆是材料改性常用的手段之一,一种情况是在材料表面沉积一层惰性物质,从而阻止本体材料与溶液的接触,减少副反应发生。另一种是在材料表面生成一层活性物质,在发挥本身效果的同时有效减少本体材料与溶液的剧烈作用,从而降低其溶解损失[29]。受晶体结构和表面化学组成影响,锂钛氧化物存在稳定差的缺点,尤其在酸洗脱过程中存在一定溶损。为了解决这一问题,研究者通过交联包覆手段改性吸附材料,取得了有意义的结果。例如,Lawagon等[30]以TiO2和Li2CO3为金属源,用高温固相反应制备了离子筛前驱体Li2TiO3,再经盐酸脱Li+后得到了氢型钛氧化物锂离子吸附剂。然后将H2TiO3与多种聚合物混合电纺制备出了具有高比表面积的纳米纤维复合型吸附剂,其中 H2TiO3/PAN纳米纤维具有亲水性,有利的纳米纤维结构还进一步促进了吸附位点与Li+的接触,吸附容量高达72.75 mg/g,不仅提高了锂吸附容量,还增强了稳定性。王豪等[31]以MnO2和LiOH为原料,采用煅烧和水热技术合成了Li1.6Mn1.6O4离子筛前驱体。再采用液相沉淀法在其表面包覆ZrO2,得到包覆ZrO2的锂离子筛前驱体,最后经HCl洗涤后转型为包覆ZrO2的锂离子筛H1.6Mn1.6O4。吸附结果表明,包覆ZrO2的锂离子筛经过10次吸附-脱附循环后锰溶损率降低至0.34%,吸附容量仍保持为24.4 mg/g,高于未包覆的锂离子筛H1.6Mn1.6O4的吸附容量 (22.9 mg/g) 。
3.3 形貌控制
研究结果表明,具有微/纳米结构无机功能材料的物理/化学性质与其化学组成、尺寸、物相、形状、维度等因素紧密相关[32]。因此,功能材料的形貌和尺寸大小控制是非常重要的研究课题。笔者曾合成了表面生长有均匀刺状结构的纳米管状锰氧化物锂离子筛(H4Mn5O12)用于溶液中Li+的分离提取[33]。结果表明,该锂离子筛具有较大的比表面积(92.997 m2/g),吸附容量达37.0 mg/g。Park[34]课题组以锐钛矿型TiO2和NaOH为原料,通过水热法合成了Na2TiO3纳米管状锂离子筛前驱体,再经HCl洗脱Li+后得到H2TiO3锂离子筛。并通过浸渍-沉淀合成了尿素、三聚氰胺和聚丙烯腈功能化的纳米管锂离子吸附剂。吸附结果表明,尿素、三聚氰胺和聚丙烯腈功能化H2TiO3锂离子筛的吸附容量分别为35.31,40.26,31.81 mg/g,较原始H2TiO3纳米管锂离子筛的吸附容量有所改善(34.4 mg/g)。刘忠[35]课题组以TiO2、NaOH和LiOH为原料,用2步水热、酸浸和煅烧技术合成了纳米棒状H4Ti5O12锂离子筛。吸附结果表明,H4Ti5O12的最大吸附容量为23.20 mg/g,且5次吸脱附循环后,吸附容量仍在首次的90%以上。
4 钛氧化物锂离子筛的成型
钛氧化物锂离子筛虽然具有选择性高、吸附容量大、溶损率低等优点,但此类吸附材料和锰系锂离子筛一样,大多数为粉体状,存在固有流动性差和渗透性差的问题[36],并且易流失难回收。若将其直接应用于盐湖卤水提锂,仍存在许多问题。为了克服粉状锂离子筛的缺点,研究者在离子筛成型方面开展了大量研究工作,尤其在造粒和成膜方面尤为集中[14]。
4.1 造粒
造粒是纳米粉体颗粒成型最常用的方法之一。它是将粉体材料通过有机聚合物粘结从而形成不同粒径的微球,从而使离子筛具有良好的机械强度,增强流动性和渗透率,以便能够适应工业化柱式操作[37]。锰系锂离子筛的造粒技术研究较多,常用的造粒剂或粘结剂有聚氯乙烯(PVC)、水玻璃、硅藻酸钠等[38],而有关钛系锂离子筛造粒成型的研究报道相对较少。例如,闫树旺等[39]以TiO2和Li2CO3为原料,经高温煅烧和酸浸技术制备了H2TiO3锂离子筛,并采用三聚氰胺-甲醛缩聚高分子化合物作为造粒材料,通过聚合反应制备了颗粒状二氧化钛锂离子吸附剂,并研究了其对锂离子的吸附性能。吸附结果表明,造粒后锂离子吸附剂性能优良,饱和吸附容量达25.8~29.4 mg/g,仍保持了原粉状吸附剂的吸附特性。在循环使用过程中,每次洗脱粒状吸附剂的溶损约为0.025%(质量分数)。刘文涛等[40]以DMF为溶剂,加入一定量PVC溶解完全后,再加入锂离子筛前驱体T750(Li),在搅拌作用下加入蒸馏水后得到白色颗粒物,然后将粒状物取出去除溶剂后得到粒状前驱体,经盐酸洗脱后得到改性的粒状锂离子筛吸附剂。研究了PVC添加量与造粒后粒状前驱体强度之间的关系,并综合实验工艺需要确定PVC添加量为15%时用于柱交换实验。经比较,粒状锂离子筛的吸附容量(11.83 mg/g)远低于未造粒锂离子筛的吸附容量(26.4 mg/g),表明造粒对该锂离子筛的交换容量有较大影响。
钛系锂离子筛造粒后具有机械强度增加、便于柱式操作等优势,但由于成型过程中吸附材料的活性位点被粘结剂所覆盖,导致造粒后锂离子筛的吸附容量和吸附速率有所下降,且吸附剂在使用过程中的溶损率相对较高[41]。
4.2 成膜
成膜法也是粉体材料成型的一种简单可行方法,该方法将耐腐蚀性强、机械性能高并具有一定粘性的成型膜材料与离子筛粉体材料混合后制成薄膜结构,再用于Li+的分离提取。孙冬舒等[14]以硝酸铝、硫酸钛和氢氧化锂为原料,经过沉淀热结晶和高温煅烧法合成了LiAlTiO4前驱体,再经盐酸洗涤后制备了氢型锂离子筛(HAlTiO4)。然后以PVDF 粉末为基质材料,将其与HAlTiO4混合均匀后通过相转化法制备出了PVDF 基锂铝钛离子筛膜(LATISM)。吸附结果表明,LATISM具有优异的选择性吸附能力,对不同离子的选择性分离系数为 3.35。6次吸脱附循环后,膜的可再生性能大幅下降,吸附容量仅为最大吸附量的59.3%,这是由于在循环过程中离子筛发生脱落同时溶损率较大所致,因此该离子筛膜在实际中难以实现重复利用。许鑫等[42]以钛酸丁酯、硝酸锂为原料,通过溶胶-凝胶和煅烧技术合成了β-Li2TiO3离子筛前驱体,然后用稀盐酸洗脱Li+后制备出了H2TiO3锂离子筛。再将一定量的PVC粉末按比例溶解在DMF溶剂中,将H2TiO3加入到该溶液后经过系列处理得到了成型的PVC-HTO离子筛复合膜。研究结果表明,当PVC∶DMF∶HTO质量比为3∶12∶5时,采用涂膜机制备厚度为400 nm的薄膜,所得PVC-HTO复合材料机械性能和Li+吸附性能最佳。该复合膜经过 5次吸脱附循环过程后,薄膜质量从98.62 g/m2减少至98.14 g/m2,损失率仅为0.5%,表明PVC-HTO复合膜具有良好的机械稳定性。
膜状锂离子筛虽然克服了粉体材料流动性和渗透率较差的问题,有利于提升Li+的扩散速率;但是其锂吸附性能显著降低,吸附速率也明显下降,溶损率增加,不利于工业化应用[43]。
5 展望
盐湖提锂是当前锂资源获取的重要方式,未来将有更多的研究关注于盐湖提锂。吸附法由于其独特的优势仍然是当前和今后一段时间锂资源分离提取的重要方法,钛氧化物锂离子筛较锰系锂离子筛具有溶损率低、结构稳定、循环性能好等优点,对于高镁锂比盐湖体系有着较高的锂分离能力。从当前研究来看,离子掺杂、交联包覆和形貌控制依然是提高锂离子筛结构稳定性和改善吸附性能的有效手段,锰系锂离子筛在此方面的研究较多,而钛系锂离子筛由于研究起步较晚,相关文献报道屈指可数,在这方面需要进一步加强。钛系锂离子筛的成型技术还不成熟,仍需要大量的基础实验研究,在保持高吸附容量的同时提高吸附材料的稳定性,从而进一步增强循环使用寿命,实现经济效益最大化。另外,盐湖卤水成分复杂,开发过程中影响因素多。我们在盐湖锂资源分离提取过程中一定要兼顾其他资源的综合利用,保护盐湖环境,实现资源可持续发展。
