极化液对脓毒症休克兔肾损害的保护作用
2021-12-15王艺铮李洪琼杨宇焦万勇
王艺铮,李洪琼,杨宇焦,万勇
(川北医学院附属医院麻醉科,四川 南充 637000)
脓毒症患者易发生急性肾损伤,其致病机制复杂,且损伤的严重程度与患者的死亡率增加有关,改善肾脏损伤对临床结局有积极作用[1]。解决低灌注、微循环障碍、炎症反应、细胞凋亡等问题有望提高治愈率[2]。在心脏缺血再灌注相关研究中,极化液,尤其是其中成分之一胰岛素,可通过PI3K-Akt信号通路发挥抗凋亡作用,从而对缺血后再灌注的心肌提供保护[3]。众多研究[4-7]表明,葡糖糖-胰岛素-钾极化液(glucose-insulin-potassium,GIK)能起抗炎、抗凋亡、改善内皮细胞功能、减轻缺血再灌注损伤、促进生长因子生成等作用。本研究小组前期已经观察到GIK对内毒素血症大鼠脾脏[8]、肝脏[9]具有保护作用。本研究旨在观察GIK对脓毒性休克后肾脏损伤的保护作用。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 雄性清洁级新西兰大白兔(12~15周龄),共30只,体重2.0~3.0 kg,购于川北医学院实验动物中心,实验动物许可证编码:SYXK(川)20165108。本实验已通过川北医学院动物伦理委员会审查,实验人员具备动物实验从业资格。
1.1.2 主要试剂和设备 脂多糖(LPS)购于Sigma(USA)公司(货号:E:coli055:B5);兔TNF-α ELISA试剂盒购于上海瓦兰生物科技有限公司(货号:201610);兔 Cys-C ELISA试剂盒购于上海酶联生物科技有限公司(货号:m1027348);GIK配制方法为:将50%葡萄糖40 mL、10%氯化钾5 mL、胰岛素6.0 IU使用生理盐水配制成100 mL极化液。 监护仪(深圳迈瑞生物医疗,型号:MEC-2000);酶标仪(上海科华,型号:KHB ST-360);全自动生化分析仪(德国西门子,型号:Rapidiab348);透射电镜(Quantum Design,型号H-600IV)。
1.2 方法
1.2.1 动物分组与脓毒血症休克模型建立 30只大白兔随机分空白对照组(C组)、LPS组和GIK组,每组各10只。环境适应性喂养2 d,禁食2 h后称重记录。耳缘静脉注射3%戊巴比妥钠(2.5 mL/kg)实施麻醉。LPS 组和GIK组耳缘静脉注射脂多糖0.5 mg/kg,C组以同样速度注射同等剂量生理盐水,以LPS 组和GIK组动物2 h内直接平均动脉压降低至基础值30%~70%且稳定达5 min表示造模成功[10]。
1.2.2 干预治疗 建模成功后,GIK组经耳缘静脉泵注极化液5 mL/h治疗;C组和LPS组泵注相同单位体积和速度的复方氯化钠溶液治疗。
1.2.3 血气分析及HE染色 干预治疗6 h后,通过经左侧颈内动脉置入的24 G 动脉套管针连接压力传感器,连续监测动脉血压。设定动静脉置管操作结束后为时间点OT,模型建立成功为时间点T0,开始干预后的第3小时末为T3,第6小时末为T6。分别于0T、T0、T3、T6通过耳缘静脉抽取新鲜静脉血液,3 000 rmp离心5 min,取上清液,分别标记并置于-70 °C低温冰箱保存备用;分别于OT、T0、T3、T6通过颈内动脉抽取血液标本进行血气分析。6 h后实验结束,经耳缘静脉注射10 mL空气处死动物并立即开腹取右侧肾脏标本,右侧上1/2肾组织称重后使用缓冲液 PBS制备组织匀浆;右侧下1/2肾组织均分为两块,分别使用4%多聚甲醛溶液和3%戊二醛固定,用于病理切片HE染色和电镜切片。
1.3 观察指标
(1)平均动脉压(MAP):经左侧颈内动脉置入的24 G 动脉套管针连接压力传感器,使用上述监护仪连续监测动脉血压。记录OT、T0、T3、T6时间点血压值。(2)生化指标(血钾、乳酸、血糖)和肌酐(Scr)值:分别于OT、T0、T3、T6抽取颈内动脉血行血气分析,及测量血钾、乳酸、血糖值。使用-70℃低温冰箱保存的血浆检测Scr值。(3)肾脏组织肿瘤坏死因子-α(TNF-α)、丙二醛(MDA)和静脉血浆中胱抑素C(Cys-C):采用ELISA 法检测。取新鲜肾脏组织匀浆,3 500 rmp离心10 min,取上清液。在标准孔、样本孔分别加入50 μL标准品、样品,标准孔和样本孔加入100 μL辣根过氧化物酶标记抗体,空白孔不加。封板,37 ℃恒温箱孵育60 min。清洗液清洗5次,拍打去除孔内气泡。每个孔迅速加入50 μL显色试剂A,再立即分别加入50 μL显色试剂B,37 ℃恒温箱内避光孵育15 min。加入50 μL终止液,15 min内使用酶标仪测量450 nm处各孔的吸光光度值,根据标准曲线计算出样品中TNF-α和MDA浓度。于OT、T0、T3、T6从耳缘静脉抽取静脉血上清液样本,按照上文描述操作并计算Cys-C的实际浓度;(4)肾小管微观结构:将肾脏组织按照大小0.5~1.0 mm2修剪,3%戊二醛预固定,1%四氧化锇再固定,丙酮逐级脱水,脱水剂浓度梯度为30%→50%→70%→80%→90%→95%→100%→100%→100%,将脱完水的组织先后经过脱水剂和环氧树脂渗透液,两试剂比例分别为3∶1、1∶1、1∶3,每步30~60 min。将渗透好的样品块放到适当模具中,灌上包埋液包埋,经加温聚合形成包埋块。超薄切片机切出50 nm左右的超薄切片,切下的超薄切片漂浮在刀槽液面上,捞至于铜网上,室温下双染色法染色15~20 min。使用H-600IV透射电镜观察,记录拍照;(5)肾脏病理切片:将固定于4%多聚甲醛溶液中72 h的肾脏组织,经过全自动脱水机梯度脱水、修剪、石蜡包埋切片、HE 染色、封片后,采用光学显微镜进行病理组织学检查。先于40×镜下观察大体病变,再选择需观察区域采集400×图片。
1.4 统计学分析
2 结果
2.1 GIK对脓毒症休克兔生命体征的影响
组内比较,注射LPS后LPS组和GIK组实验动物血压下降(P<0.05);LPS组补液治疗后血压适当回升,但从T3不再升高,随后缓慢下降;而使用GIK治疗的动物血压回升程度始终高于LPS组,并持续保持到实验结束(P<0.05)。见图1。
2.2 GIK对脓毒症休克兔生化指标的影响
注射LPS后,动物血糖升高(P<0.05),随后逐渐下降,但LPS组血糖下降程度大于GIK组(P<0.05)。在T6时,LPS组血糖均值已经低于3.9 mmol/L,而GIK组稳定在正常范围内,且与OT时组内比较,差异无统计学意义(P>0.05);注射LPS后,动物的乳酸持续升高(P<0.01),并保持此趋势至实验结束,但至T6时GIK组升高程度低于LPS组(P<0.05);实验开始后,C组动物血钾逐渐降低(P<0.05),LPS组虽然也呈降低趋势,但程度小于C组(P<0.05),而GIK组血钾始终高于LPS组(P<0.05)和C组(P<0.05),并始终维持稳定。见图2。


2.3 GIK对脓毒症休克兔肾脏功能指标的影响
各组Scr水平从T3开始就出现差异(P<0.05),并持续至T6;GIK组和LPS组Scr水平水平高于正常对照组(P<0.05),且LPS组高于GIK组(P<0.05)。LPS组和GIK组动物Cys-C 水平从T3开始高于C组(P<0.05),且LPS组高于GIK组(P<0.05),直至实验结束。见表1及表2。
表1 各组兔各时间Scr水平比较

表2 各组兔各时点Cys-C水平比较
2.4 GIK对脓毒症休克兔肾脏组织炎症和过氧化水平的影响
LPS组和GIK组TNF-ɑ和MDA均高于C组(P<0.05),且LPS组高于GIK组(P<0.05)。见表3。
表3 各组兔肾组织TNF-ɑ和MDA水平比较
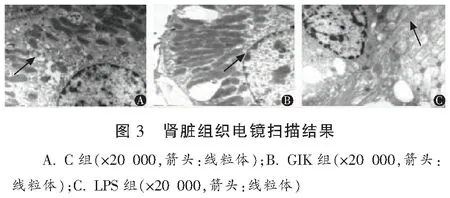
2.5 肾组织电镜观察结果
正常对照组内皮细胞、基底膜、上皮细胞结构清晰,肾小管上皮细胞表面微绒毛丰富,细胞核染色质分布均匀,胞浆内线粒体、粗面内质网、核糖体等细胞器清晰可见;LPS组肾小管上皮细胞细胞核染色质聚集,胞浆内线粒体肿胀;GIK组上皮细胞表面微绒毛丰富,细胞核染色质分布均匀,胞浆内线粒体粗面内质网,核糖体等细胞器清晰可见。见图3。
2.6 肾组织病理切片HE染色结果
正常对照组肾脏皮质和髓质分界清晰,皮质区域肾小球结构未见异常,肾小管和集合管排列规则、有序,未见明显病理变化;LPS组肾脏组织皮质区肾小管和集合管上皮细胞可见大量水肿坏死,间质内血管扩张充血;GIK组肾脏组织皮质和髓质分界清晰,皮质区域肾小球结构未见异常,肾小管和集合管排列规则、有序,可见部分上皮细胞水肿、空泡化。见图4。

3 讨论
本实验中,LPS组实验动物遭受LPS攻击后(T0)出现动脉血压剧烈下降,经过补液治疗,血压缓慢回升,但从T3开始,血压达到平台期,后再次下降;而GIK组动物的血压缓慢回升,在T3达到平台期后保持此血压水平至T6,说明GIK能在此动物模型休克早期更好地维持血流动力学稳定,与GIK可改善脓毒症休克患者血流动力学水平的报道一致[11]。文献表明在脓毒症休克早期尽快液体复苏至关重要[12-14],本研究结果也表明在早期使用GIK干预治疗对血流动力学稳定有积极意义。
线粒体功能障碍是脓毒症动物体内由微循环障碍、炎症介质和(或)过量活性氧攻击造成的,遭到损伤的线粒体内外膜通透性,最终形成线粒体内呼吸障碍,使线粒体无法通过正常的氧化磷酸化产生能量,进而严重影响肾脏的分泌和重吸收[15-16]。在本研究中,经过GIK干预的动物的血糖水平波动较LPS组更小。相关研究表明,高血糖、低血糖和血糖波动大与脓毒症患者的高死亡率直接相关[17],故GIK干预的动物血糖水平更稳定是有利于脓毒症结局的。且GIK组血钾水平波动也更小,乳酸升高幅度更平缓,表明GIK干预治疗使实验动物的微循环障碍得到改善。炎症反应也是脓毒症休克急性肾损伤的机制[18],在脓毒症和脓毒性休克中,TNF-α能够造成脏器损伤,最终发展为包括急性肾损伤在内的多器官功能障碍综合征[19],TNF-α表达受到抑制有利于促使失控的促炎/抗炎反应趋于平衡,减轻肾脏组织受到的攻击。有证据[20]表明,在脓毒症患者和脓毒症动物中血清及肾脏组织TNF-α水平升高程度与肾脏的器官损伤程度一致。本实验GIK组肾脏组织中TNF-α水平较LPS组显著降低,推测是由于GIK能通过减少NF-κB、MAPK通路激活,进而减少TNF-α的产生和释放。脓毒性肾损伤微循环障碍改变及炎性物质大量产生会导致过氧化水平升高,使氧化与抗氧化失衡,大量的过氧化物质会直接损伤DNA、抑制线粒体呼吸酶和Na+-K+-ATP酶、激活凋亡酶,造成组织结构和功能的损伤,减少过氧化物生成是减轻过氧化物损伤的主要手段[16]。丙二醛(MDA)是常用的膜脂过氧化的指标,本实验中LPS组肾脏组织MDA水平剧烈升高,经GIK干预后MDA明显降低。说明GIK干预能减轻肾脏细胞过氧化水平,可减少过氧化产物对组织的损伤。同时,高水平的MDA能直接降低线粒体脂质双层膜流动性,破坏线粒体结构,MDA水平下降有利于维持线粒体正常结构。本研究通过电镜观察肾小管上皮细胞,发现LPS组肾小管上皮细胞胞浆内线粒体肿胀明显,而GIK组胞浆内线粒体等细胞器超微机构清晰可见,肿胀程度明显减轻或者无线粒体肿胀及膜断裂。以上实验结果表明,极化液可通过减轻微循环障碍、减少炎症因子释放、减少过量活性氧的攻击而减轻脓毒症兔肾脏上皮细胞的线粒体损伤。
综上,极化液早期干预有利于维持脓毒症休克兔血流动力学稳定,并通过减轻微循环障碍、减少炎症因子释放、减少过量活性氧的攻击而减轻脓毒症兔肾脏上皮细胞的线粒体损伤,从而对脓毒症兔的肾脏损伤有一定的保护作用,但具体机制还有待进一步研究。
