ZNF139通过抑制miR-181a-5p增加胃癌细胞耐药性的机制
2021-12-15朱海星何新阳
朱海星,何新阳
(中国科学技术大学附属第一医院·安徽省立医院肿瘤外科,安徽 合肥230031)
胃癌(gastric cancer,GC)是世界范围内最常见的消化道恶性肿瘤之一,具有较高的发病率和死亡率[1]。目前,手术仍是治疗胃癌的主要方法,而大多数患者确诊时已属晚期,手术治疗的效果较为有限[2]。因此,化疗在根除恶性肿瘤细胞中起着关键作用,但其5年生存率低于30%,结果仍然不令人满意[3],原因主要是胃癌细胞的耐药性,而多药耐药是胃癌化疗失败的主要原因,也是导致胃癌患者死亡率较高的原因之一[4]。因此,探索新的、潜在的治疗策略以解决胃癌患者的耐药性具有重要的意义。多项研究表明,一些关键分子和信号通路参与了胃癌细胞的耐药性。锌指蛋白139 (ZNF139)是锌指蛋白家族成员之一,具有转录和调控下游基因的功能[5]。van Dekken等[6]研究发现,ZNF139的表达可能与肿瘤的生长和发展有关,ZNF139参与胃癌细胞分化的过程,促进胃癌细胞的侵袭和发育[7]。然而,ZNF139在胃癌耐药性中的主要下游靶点仍然未知。因此,要了解胃癌耐药性的机制,还需要进一步研究ZNF139的作用机制。在过去的几年里,miRNAs的作用一直是癌症研究的热点。有研究[8]表明,miR-181a-5p与肿瘤的生长、侵袭和转移密切相关。此外,另一项研究[9]发现,miR-181a-5p通过参与Wnt/β-catenin信号通路来调控结直肠癌的进展和化疗耐药。由此可见,miR-181a-5p可能参与了胃癌细胞的耐药性,但其具体的调控机制不完全清楚。本研究旨在探讨ZNF139与miR-181a-5p之间的关系及其在胃癌细胞耐药性中的作用和分子机制,为临床治疗提供参考。
1 材料与方法
1.1 材料
1.1.1 组织样本和细胞 采集2019年1月至2020年1月中国科学技术大学附属第一医院经病理证实的35例胃癌患者(年龄42~75岁)的癌组织和癌旁组织(对照组)样本。对照组样本为来自同一患者的邻近正常胃组织;胃癌临床分期包括I期3例,II期9例,III期18例,IV期5例。所有参与者术前均未接受放疗和化疗。每个癌组织和癌旁组织(约1.0 cm×0.5 cm ×0.5 cm)均取自参与者(距离切缘超过3 cm),样本浸泡于液氮中快速冷冻,后转移至-80 ℃低温冰箱保存。本研究获得医院伦理委员批准同意。 纳入标准:(1)均符合胃癌相关诊断标准[10];(2)40岁≤年龄≤75岁;(3)患者及家属知情同意。排除标准:(1)已发生肿瘤转移者;(2)合并其他脏器肿瘤、消化系统严重疾病者;(3)妊娠期及哺乳期妇女;(4)伴有其他系统疾患者。
1.1.2 主要仪器及试剂 人胃细胞系MKN45(货号:ACC 409)、正常胃粘膜上皮细胞系GES-1(货号:21875091)和阿霉素耐药GC MDR细胞系MKN45/ADR(货号:21127022)均购自美国American Type Culture Collection(ATCC) 细胞库。RPMI 1640培养基(货号:A10491)和胰蛋白酶(货号:31870-082)购自Gibco公司。TRIzol试剂和LipofectamineTM2000转染试剂购置自Invitrogen公司。荧光定量RT-PCR试剂(货号:25030-024)和反转录试剂盒购(货与:25-025)自Promega公司。蛋白提取试剂盒(货号:163-2084)购自中国Beyotime公司。兔ZNF139抗体 ZNF139(货号:ab32124)由美国Sigma公司提供。兔P-gp(货号:13978)、GST-π(货号:3498)、MRP-1(货号:14182)、Bcl-2(货号:2772)、TS(货号:3452)、Bax(货号:13598)和β-actin(货号:5174)抗体购自美国Santa Cruz Biotechnology;MTT试剂盒( 货号:M92050)购自美国Sigma公司。
1.2 方法
1.2.1 细胞培养和转染 人GC细胞系MKN45、MKN45/ADR和GES-1,用含10%胎牛血清、100 mg/mL链霉素和100 U/mL青霉素的RPMI 1640(Invitrogen) 培养。将细胞分为MKN45、MKN45/ADR和GES-1组,其中MKN45/ADR在含有0.4 mg/L的ADR中培养,维持耐药表型。实验前1周停止此干预。于37 ℃、5% CO2湿化气氛孵育后,用0.25%胰蛋白酶溶液加0.02% EDTA消化,进行传代培养。采用BLOCK-iTTMRNAi设计器(序列:5’-ACC TCG GAA GAT TCA GCA T-3’)设计ZNF139-siRNA序列,将其转染到ZNF139高表达的GC细胞株MKN45/ADR中,以转染非特异性siRNA序列(NS-siRNA:5’-GAC GAG TTG ACT GCG ATT G-3’)的细胞作为阴性对照,构建ZNF139-siRNA和NS-siRNA组;构建人ZNF139过表达载体。利用KpnI和NotI酶切位点将人ZNF139编码序列(NM_003439)亚克隆到pcDNA3.1载体中。转染前将GC细胞接种于六孔板24 h,密度为4 × 105/mL。按照试剂转染手册LipofectamineTM2000,将质粒载体、siRNA或miR-181a-5p模拟物转染到GC细胞或耐药细胞中,构建 pcDNA-ZNF139、miR-181a-5p和Anti-miR-181a-5p组,其中细胞用RPMI 1640冲洗,使其无血清和无抗生素。24 h后检测转染效率,并进行后续实验。
1.2.2 MTT试验 将胃癌组织和正常癌旁组织切片后研磨,随后,制备单细胞悬液。用0.02% EDTA-0.25%胰蛋白酶消化后的GC细胞,以5 × 104细胞/mL的密度接种于96孔板,转染ZNF139-siRNA,细胞生长至80%时加入化疗药物[阿霉素(ADR)、5-氟尿嘧啶(5-Fu)、奥沙利铂(L-OHP)]。实验结束前4 h,在孔中加入浓度为5 mg/mL的MTT 20微升。每孔加入DMSO 150微升,室温摇板15 min后,用酶标仪在570 nm波长下测定吸光度值(OD值)。以上实验重复3次。
1.2.3 RT-qPCR 采用TRIzol试剂(Invitrogen,美国)从转染细胞中分离总RNA,先采用预冷的PBS清洗2~3遍,加入1 mL Trizol裂解细胞15 min,待贴壁细胞完全脱落后,移至2 mL EP管,并使用紫外分光光度计测量RNA浓度。使用MultiscribeRTkit(Applied Biosystems,USA) 和oligo(dT),在40 ℃反应6 min,65 ℃反应25 min,35个循环条件下合成互补DNA(cDNA) ,得到cDNA产物,保存于-80 ℃,用于进一步的实验。体系总量为20 μL:PCR反应包含2 μL cDNA、0.4 μL正向引物、0.4 μL反向引物、7.2 μL H2O2和10 μL SYBR;扩增条件为25 ℃,10 min,48 ℃,30 min,95 ℃,5 min。采用2-ΔΔCt法计算表达水平,GAPDH作为实验内参。所用引物如下:ZNF139(411 bp):(F) 5′-CTT CCT GAG TTC TTG GTT TCG-3′,(R) 5′-CCT TTG ACC CAC TGG TTT ATG-3′;MDR-1(302 bp):(F) 5′-GAA TGT TCA GTG GCT CCG AG-3′,(R) 5′-ACA ATC TCT TCC TGT GAC ACC -3′;GST-π(341 bp):(F) 5′-ATA CCA TCC TGC GTC ACC TG-3′,(R) 5′-TCC TTG CCC GCC TCA TAG TT-3′;P-gp(480 bp):(F) 5′-CAT CAG CAG GCA CCA CAA C-3′,(R) 5′-TTC CAG GTC TCC TCC TTC TTG-3′;Bcl-2(459 bp):(F) 5′-TGT GTG GAG AGC GTC AAC C-3′,(R) 5′-TGG ATC CAG GTG TGC AGG T-3′; TS(397 bp):(F) 5′-TTT CTG ACG GCA ACT TCA AC-3′,(R) 5′-AGT CCA ATG TCC AGC CCA T-3′;Bax(452 bp) (F) 5′-TTT CTG ACG GCA ACT TCA AC-3′,(R) 5′-AGT CCA ATG TCC AGC CCA T-3′;GAPDH(580 bp):(F) 5′-GAC CCC TTC ATT GAC CTC AAC-3′,(R) 5′-CGC TCC TGG AAG ATG GTG AT-3′。
1.2.4 Western blot 采用RIA裂解缓冲液(Beyotime Biotechnology,中国)和蛋白酶抑制剂(Roche,中国)提取转染细胞的总蛋白,用BCA试剂盒(Thermo Fisher Scientific,Waltham,Massachusetts,USA)测定蛋白浓度。变性后,取相同量总蛋白上样,经10%聚丙烯酰胺SDS凝胶(SDS/PAGE)分离后,转移到PVDF膜上(Amersham Pharmacia Biotech),在37 ℃下用5%脱脂乳封闭1 h,将膜与ZNF139、P-gp、GST-π、MRP-1、Bcl-2、TS、Bax和β-actin的一抗在4 ℃下孵育过夜。然后用含Tween 20 (TBST)的Tris缓冲盐水洗涤膜,与二抗在室温下孵育2 h,用TBST洗涤。最后,用增强化学发光(ECL) western blot检测试剂反应后,检测蛋白条带。使用ImageJ软件对条带的灰度值进行分析。
1.2.5 染色质免疫共沉淀 将细胞在1%甲醛中室温培养15 min,使相关蛋白与DNA交联。随后,添加甘氨酸至最终浓度为0.125 M,交联终止。用300 μL的放射免疫沉淀缓冲液(50 mM Tris/HCl,pH 8.0,150 mM NaCl,5 mM EDTA,1% NP-40,0.5%去氧胆酸盐和蛋白酶抑制剂 )启动细胞裂解。裂解产物经过超声处理,生成约600 bp的染色质片段,然后使用琼脂糖凝胶电泳进行评估。将上清液以13 000 rpm离心10min,然后与30 μL蛋白A-Sepharose beads(Sigma,美国)和剪切后的鲑鱼精子DNA一起孵育,在4 ℃下预清除15 min。在13 000 rpm离心5 min后,将收集的上清液平均分为三份:一份用于提取DNA作为输入,另一份用于免疫沉淀,加入或不加入2 μg ZNF139抗体,在4 ℃摇动过夜。然后,用蛋白A-Sepharose beads和剪切的鲑鱼精子DNA沉淀免疫复合物。离心后,收集小球,用放射免疫沉淀洗涤缓冲液冲洗。将200微升洗脱缓冲液(1% SDS,0.1 M NaHCO3)加入到洗净的珠中,洗脱免疫沉淀,免疫沉淀在65 ℃孵育过夜。12 000 rpm离心10 min,苯酚-氯仿提取,乙醇沉淀提取DNA。PCR扩增含有ZNF139结合位点的启动子片段,ZNF139(411bp): (F) 5′-CTT CCT GAG TTC TTG GTT TCG-3′,(R) 5′-CCT TTG ACC CAC TGG TTT ATG-3′。
1.2.6 荧光素酶活性检测 用pGL3-miR-181a-5p-luc将miR-181a-5p(5′-AACAUUCAACGCUGUCGGUGAGU-3′)上游1.5 kb启动子区域亚克隆到pGL3-Basic载体中、pcDNA-ZNF139或pGL3-Basic,再加上pRL-TK,一式三份转染生长至70%汇合的细胞中。转染48 h后,根据制造商的手册,使用Dual-Luciferase® Reporter Assay System(Promega,Madison,WI)测量荧光素酶活性,室温裂解细胞15 min,加入Renilla luciferase的底物,终止LAR II反应,向40 μL的LAR II中加入10 μL细胞裂解液,混匀后,检测读数,即为Firefly luciferase的值,计算出每管的Firefly luciferase/Renillaluciferase的比值,以control组的比值为单位1,得到不同处理组的相对luciferase活性与pRL-TK的荧光素酶活性相比。
1.3 统计学分析
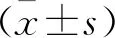
2 结果
2.1 ZNF139和miR-181a-5p在GC组织中的表达比较
与对照组相比,ZNF139 mRNA和蛋白在胃癌组织中表达上调(P<0.05),miR-181a-5p mRNA表达水平降低(P<0.05) 。见图1。
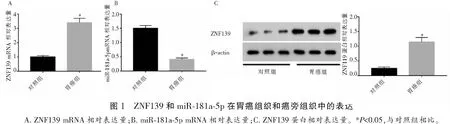
2.2 细胞化疗敏感性比较
药物敏感性结果表明,添加ADR、5-FU和L-OHP后,胃癌组织中的细胞抑制率低于胃癌旁组织 (P<0.05)。见图2。
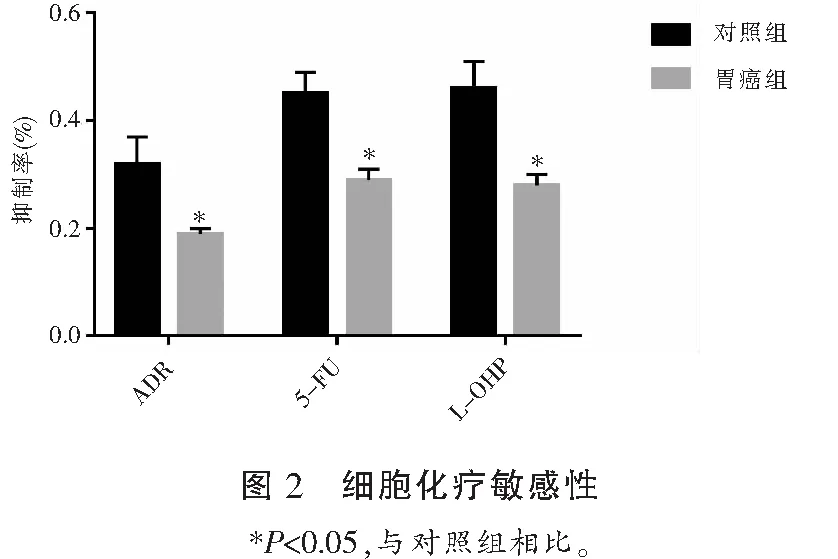
2.3 ZNF139和miR-181a-5p在不同胃细胞系中的表达比较
在MKN45、MKN45/ADR和GES-1三种细胞系中,ZNF139 mRNA和蛋白在MKN45/ADR中表达水平最高,其次是MKN45,在GES-1中表达水平最低(P<0.05)。而miR-181a-5p mRNA的表达趋势则相反,在MKN45/ADR最低,其次是MKN45,在GSE-1表达水平最高 (P<0.05)。添加ADR、5-FU和L-OHP后,MKN45/ADR细胞抑制率最低,MKN45次之,GES-1细胞抑制率最高(P<0.05)。见图3。
2.4 ZNF139过表达对细胞耐药性的影响
转染对照siRNA后,ZNF139蛋白在细胞内水平不变,而转染ZNF139-siRNA的MKN45/ADR细胞中,ZNF139蛋白有不同程度的降低(P<0.05)。ZNF139蛋白表达水平呈剂量依赖性降低,转染48 h后抑制作用最大(P<0.05)。转染ZNF139-siRNA的MKN45/ADR细胞中,ADR、5-FU和L-OHP降低了细胞存活率(P<0.05)。pcDNA-ZNF139转染MKN45 48 h后,ZNF139蛋白的表达增加(P<0.05)。pcDNA-ZNF139转染后,ADR、5-FU或L-OHP处理的细胞活性升高(P<0.05)。见图4。
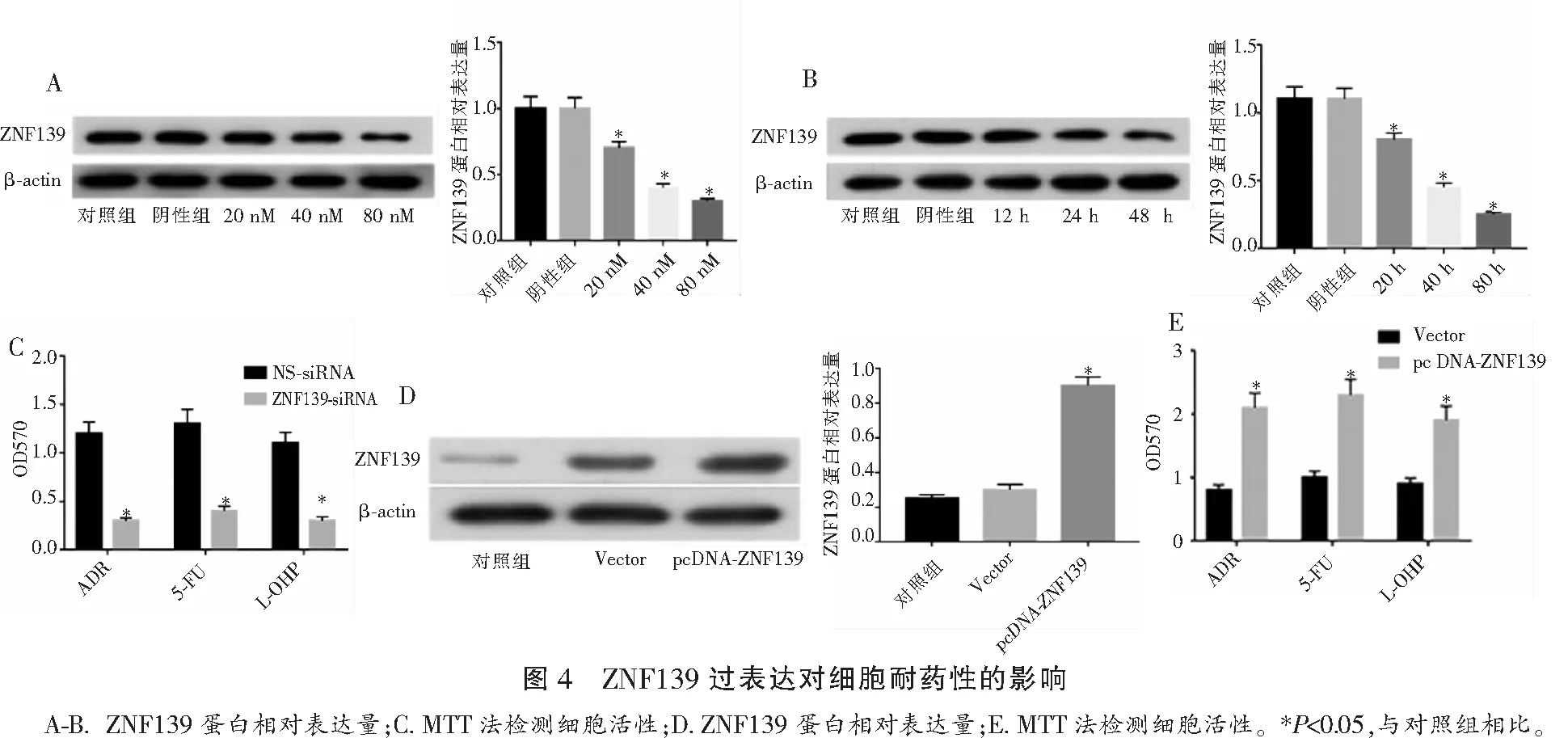
2.5 miR-181a-5p对MKN45/ADR耐药细胞的影响
miR-181a-5p模拟物转染MKN45/ADR后,miR-181a-5p mRNA表达上调(P<0.05)。转染miR-181a-5p模拟物后MKN45/ADR细胞存活率降低(P<0.05)。在MKN45/ADR细胞中转染Anti-miR-181a-5p抑制miR-181a-5p mRNA水平,转染后细胞存活率提高(P<0.05)。见图5。
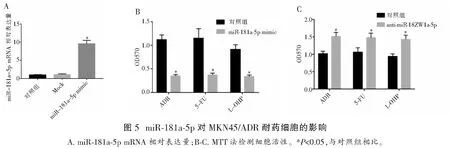
2.6 ZNF139抑制MKN45细胞中miR-181a-5p的转录
转染ZNF139-siRNA至MKN45/ADR细胞后,miR-181a-5p mRNA的表达升高(P<0.05)。同时,转染MKN45/ADR后,ZNF139 mRNA和蛋白的表达无明显变化(P>0.05)。转染pcDNA-ZNF139 48 h后,MKN45细胞中miR-181a-5p mRNA下调(P<0.05)。建立miR-181a-5p的荧光素酶报告基因质粒,该质粒位于启动子区上游,序列为2 kb,与pcDNA-ZNF139共转染细胞。基因分析结果显示,ZNF139可能抑制miR-181a-5p的启动子活性。通过ChIP分析进一步证实ZNF139直接与miR-181a-5p的启动子区结合。因此,ZNF139作为转录因子,可以通过直接偶联到miR-181a-5p的启动子区域来抑制MKN45中miR-181a-5p的转录活性。见图6。
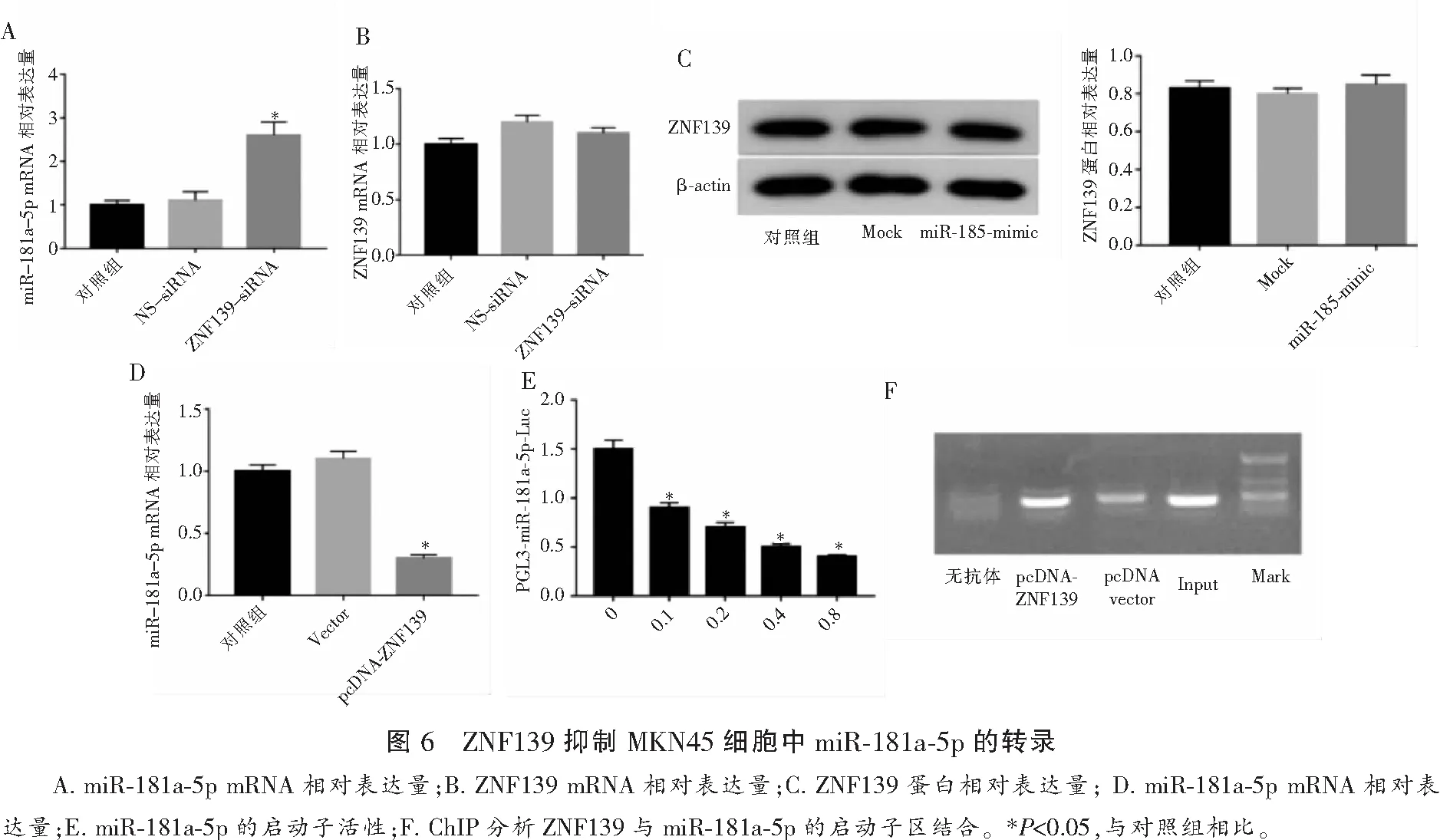
2.7 ZNF139表达对耐药基因水平的影响
抑制ZNF139可降低MKN45/ADR细胞中P-gp、MRP-1、Bcl-2的表达(P<0.05),而GST-π、TS和Bax的表达无明显变化(P>0.05)。见图7。
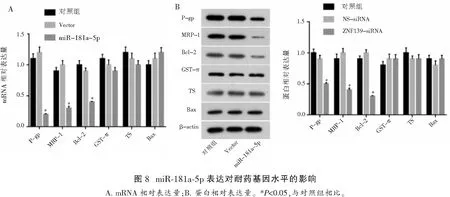
2.8 miR-181a-5p表达对耐药基因水平的影响
miR-181a-5p模拟物转染MKN45/ADR细胞后,P-gp、MRP和Bcl-2的表达降低(P<0.05),而GST-π、TS和Bax的表达未见改变(P>0.05)。见图8。
3 讨论
胃癌发病率居全国消化系统恶性肿瘤之首,且预后极差[11]。而胃癌细胞的耐药性直接导致化疗的失败,是影响患者预后的重要原因。有研究数据[12]表明,ZNF139参与了细胞耐药性的调控,能够逆转GC细胞系MKN28的耐药性。本研究结果显示,在胃癌组织和细胞系中ZNF139 mRNA和蛋白表达升高(P<0.05),miR-181a-5p mRNA表达降低(P<0.05)。转染ZNF139-siRNA后,MKN45/ADR细胞中miR-181a-5p mRNA表达升高(P<0.05),化疗药物ADR、5-FU、L-OHP处理后,MKN45/ADR细胞存活率降低(P<0.05)。MKN45细胞系转染pcDNA-ZNF139后,ZNF139 mRNA和蛋白的表达水平升高(P<0.05),miR-181a-5p mRNA的表达水平下降(P<0.05),同时细胞对ADR、5-FU、L-OHP的耐药性增强(P<0.05)。双荧光素酶活性试验表明,ZNF139抑制了miR-181a-5p启动子的转录活性(P<0.05)。通过抑制ZNF139可降低MKN45/ADR细胞中P-gp、MRP-1、Bcl-2的表达(P<0.05);miR-181a-5p模拟物转染MKN45/ADR细胞后,P-gp、LRP和Bcl-2的表达降低(P<0.05)。因此,推断ZNF139可促进GC细胞的耐药性。
ZNF139由6个C2H2锌指结构组成,包括SCAN和一个KRAB结构域。锌指结构属于DNA结合域,而SCAN和KRAB促进辅助因子之间的蛋白质相互作用[13]。关于ZNF139表达与肿瘤的关系已有少量报道。van Dekken等[6]发现,ZNF139在食管-胃交界处腺癌中表达增加;此外,ZNF139还能促进GC细胞的侵袭和进展[14]。采用RNAi技术抑制ZNF139的表达后,发现胃细胞MKN28对化疗药物更加敏感,且相关耐药基因发生了变化[12],表明ZNF139与GC密切相关。但ZNF139对GC细胞耐药的机制尚未完全明了。因此,本研究通过基因干扰和克隆技术进一步探讨了ZNF139对GC细胞耐药的影响,结果表明,抑制ZNF139的表达抑制了胃癌细胞的耐药性。将过表达ZNF139的合成基因序列转染非耐药GC细胞系后发现,其耐药能力明显增强。可见,ZNF139在调节GC细胞的耐药性中起重要作用。
miRNAs是指一类小而广泛的非编码ssRNAs,大约包含22 nts。最近有研究[15]表明,肿瘤细胞的耐药性与miRNA密切相关。其中miR-181a-5p在癌症的发生发展中的作用已被多项研究证实,但结果仍存在争议。如有研究[16]指出,miR-181a-5p在胰腺癌和乳腺癌中表达上调。然而,也研究[17]表明,miR-181a在胶质瘤和侵袭性慢性淋巴细胞白血病中表达下调。即使在结直肠癌的发展过程中,miR-181a也可同时作为癌基因和肿瘤抑制因子,且与结直肠癌不良预后相关[18]。另外,miR-181a的表达水平在炎症性肠病相关结直肠癌从非肿瘤性到非典型增生的过程中升高,而在非典型增生发展为癌症时降低[19]。miR-181a-5p在细胞增殖和化疗耐药性方面也起到抑癌的作用。本研究表明,在GC组织和细胞系中,miR-181a-5p受到ZNF139的负调控,通过抑制ZNF139的表达可使miR-181a-5p mRNA水平升高(P<0.05);相反,过表达ZNF139会降低miR-181a-5p mRNA的表达(P<0.05),表明ZNF139可调控miR-181a-5p的表达。进一步研究发现,增加miR-181a-5p水平挽救了ZNF139下调细胞的耐药特性。此外,值得注意的是,ZNF139直接结合并促进了miR-181a-5p的转录,表明ZNF139可通过miR-181a-5p调控GC细胞的耐药性。此外,观察干预胃癌细胞前后与耐药性相关基因P-gp、MRP-1、GST-π、Bcl-2、TS和Bax表达情况,以阐明ZNF139-miR-181a-5p通路在胃癌耐药性中的调控机制。结果表明,抑制ZNF139表达减弱了P-gp、MRP-1和Bcl-2的表达(P<0.05),而转染miR-181a-5p mimic后P-gp、MRP和Bcl-2的表达水平升高(P<0.05)。由此可见,ZNF139 -miR-181a-5p通路通过诱导P-gp、MRP-1和Bcl-2的表达水平在GC中引起细胞耐药特性。
综上所述,ZNF139和miR-181a-5p在GC组织和细胞系中呈现异常表达。ZNF139是miR-181a-5p的上游调控因子。ZNF139 -miR-181a-5p通路可能通过诱导胃癌中P-gp、MRP-1和Bcl-2的表达来增加细胞的耐药特性,但其具体机制仍需进一步研究。
