微小RNA-425-5p靶向调控PTEN表达促进宫颈癌海拉细胞增殖、侵袭和迁移的实验研究
2021-12-15高慧王丽王景华
高慧,王丽,王景华
宫颈癌是全球妇女中常见的第四大恶性肿瘤,给女性的身体健康和生活质量造成很大的威胁。认识和了解宫颈癌发生发展的分子机制是实现全面消除宫颈癌的第一步。既往研究显示,在宫颈癌中存在着异常表达的微小RNA(miRNAs/miR),而这些miRNAs 是宫颈癌病理进展过程的重要调节因子。研究发现,miR-425-5p在宫颈癌病人组织和血清中高表达,与病人临床分期、淋巴结转移等紧密联系,但miR-425-5p 在宫颈癌中的详细功能与机制仍未完全阐明。本研究于2018年10月至2019年10月考察miR-425-5p 在宫颈癌海拉细胞增殖、侵袭和迁移中的作用,并探讨其潜在的分子机制,以期为宫颈癌发病机制的深入研究提供新的启示。
1 材料与方法
1.1 海拉细胞培养
海拉细胞(美国ATCC)采用含10% 胎牛血清(美国Gibco BRL 公司)的达尔伯克改良伊格尔培养基(DMEM 培养基)(美国Hyclone 公司)在常规条件为5% 二氧化碳、37 ℃的恒温培养箱(美国Thermo公司)中培养。1.2 海拉细胞转染
在6 孔板中接种5×10个对数生长期的海拉细胞,常规培养至70%~80% 融合度时,参照转染试剂Lipofectamine2000(美国Invitrogen公司)说明书步骤进行瞬时转染。将转染miR-425-5p 模拟物(mimics)/抑制剂(inhibitor)(上海吉玛制药公司)的细胞作为miR-425-5p mimics/inhibitor 组,转染miR-425-5p mimics/inhibitor 阴性对照(上海吉玛制药公司)的细胞作为mimics/inhibitor-NC 组;转染pcDNA3.1-PTEN 过表达载体质粒(上海钦诚生物公司)的细胞作为pcDNA3.1-PTEN 组,转染pcDNA3.1 空载体质粒(上海钦诚生物公司)的细胞作为pcDNA3.1 组;转染PTEN 干扰序列siRNAPTEN(美国Santa Cruz Biotechnology 公司)的细胞作为siRNA-PTEN 组,转染siRNA-PTEN 阴性对照(美国Santa Cruz Biotechnology 公司)的细胞作为siRNANC 组。转染5 h 后,更换新鲜DMEM 培养基并维持48 h。1.3 实时荧光定量PCR检测海拉细胞中miR-425-5p表达
收集转染48 h后的miR-425-5p mimics/inhibitor组、mimics/inhibitor-NC组海拉细胞,加入1 mL Trizol试剂(上海碧云天生物公司)获取总RNA,参照逆转录试剂盒(美国Applied Biosystems公司)随附步骤将RNA进行逆转录;以获得的产物互补DNA(cDNA)作为模板,参照定量PCR试剂盒(美国Applied Biosystems公司)说明书[miR-425-5p 正向引物序列为5’-TGCGGAATGAC-ACGATCACTCCCG-3’,反向引物序列为5’-CCAGTGCAGGGTCCGAGGT-3’;U6正向引物序列为5’-GCTTCGGCAGCACATATACTAAAAT-3’,反向引物序列为5’-CGCTTCACGAATTTGCGTGTCAT-3’(上海吉玛制药公司)]并按照设定的PCR扩增条件(95 ℃2 min 后,进入40个循环阶段:95 ℃10 s、60 ℃20 s、72 ℃20 s;72 ℃5 min)上PCR 仪(德国Roche Diagnostics GmbH 公司)进行扩增。采用2法计算各组海拉细胞中miR-425-5p的相对于U6的表达水平。1.4 MTT 法检测海拉细胞增殖
将转染后5×10个miR-425-5p mimics/inhibitor 组、mimics/inhibitor-NC 组海拉细胞接种至96 孔板,并设置空白调零组:无细胞培养基。常规培养48 h 后,每孔加入20 μL(浓度为5 g/L)噻唑蓝(MTT)溶液(美国Sigma 公司);孵育4 h 后,弃上清液并每孔加入200 μL DMSO(美国Sigma 公司)震荡反应15 min。在酶标仪(美国Bio-Rad 公司)490 nm 波长处检测各组海拉细胞吸光度,并计算出各组细胞存活率[细胞存活率=(实验组吸光度-空白组吸光度)/(对照组吸光度-空白组吸光度)×100%]。实验重复3 次。后续pcDNA3.1 组、pcDNA3.1-PTEN 组、siRNA-NC 组和siRNA-PTEN组细胞增殖活力检测方法同上。1.5 平板克隆形成实验检测海拉细胞克隆形成能力
胰蛋白酶(美国Hyclone 公司)消化收集miR-425-5p mimics/inhibitor 组、mimics/inhibitor-NC 组细胞,在培养皿中分别接种50、100 和200个细胞,每组设置3个平行实验。轻轻摇动使其分散均匀后,常规培养14~21 d。期间观察到培养皿中出现肉眼可见的克隆时,终止培养。以4% 多聚甲醛固定20 min,0.1% 结晶紫染色15 min。冲洗并干燥后,在显微镜(日本Olympas公司)中观察并计数大于15个细胞的克隆数,并根据克隆数/接种细胞数×100% 计算出克隆形成率(%)。后续pcDNA3.1 组、pcDNA3.1-PTEN 组、siRNA-NC 组和siRNA-PTEN 组细胞克隆形成率检测方法同上。1.6 Transwell 小室实验检测海拉细胞侵袭和迁移
(1)侵袭实验:将无血清培养基和Matrigel 基质胶(美国BD 公司)按照6∶1 比例混匀后,取50 μL 平铺至Transwell小室(美国Corning公司)上层中,置于细胞培养箱中孵育5 h 使基质胶充分凝固。收集miR-425-5p mimics/inhibitor 组、mimics/inhibitor-NC组细胞后,以无血清DMEM 将细胞浓度调整为10个/毫升。在Transwell 小室上室中添加200 μL 细胞悬液,并在下室中加入600 μL 含血清DMEM。常规孵育24 h 后,以4% 多聚甲醛和0.1% 结晶紫对滤膜下的细胞进行固定与染色。在显微镜下测量各组穿膜的海拉细胞数,结果取随机选取的3个视野细胞数的平均值。(2)迁移实验:除了不需要以Matrigel基质胶对Transwell 小室基底膜进行包被外,其余步骤与侵袭实验相同。后续pcDNA3.1 组、pcDNA3.1-PTEN 组、siRNA-NC 组和siRNA-PTEN 组细胞侵袭和迁移能力的检测方法同上。1.7 蛋白质印迹法(Western blotting)检测海拉细胞中磷酸酶及张力蛋白同源基因(PTEN)蛋白表达
以RIPA 裂解液(上海碧云天生物公司)获取待测海拉细胞总蛋白。将100 ℃变性后的蛋白样品上样至十二烷基硫酸钠-聚丙烯酰胺凝胶(北京索莱宝生物公司)中行电泳分离后,转至聚偏二氟乙烯膜。以5% 脱脂奶粉封闭2 h后,加入PTEN 一抗(1∶1000,美国Abcam 公司)4 ℃下孵育24 h。再以辣根过氧化物酶标记二抗(1∶2000)室温孵育2 h 后,暗室中滴加ECL(上海碧云天生物公司)显影曝光。在凝胶成像分析系统(美国Bio-Rad 公司)中扫描并分析海拉细胞中PTEN 蛋白相对于内参甘油醛-3-磷酸脱氢酶(GAPDH)的表达水平。实验重复3次。1.8 双荧光素酶报告基因实验检测miR-425-5p 和PTEN 的表达
将PTEN-3’非翻译区(UTR)片段克隆重组至荧光素酶载体上来构建PTEN 野生型(WT)载体质粒,记为PTEN-WT 质粒;另外,将miR-425-5p与PTEN-3’UTR 结合位点定点突变后克隆重组至荧光素酶载体上来构建PTEN 突变型(MUT)载体质粒,记为PTEN-MUT 质粒。在24 孔细胞板接种将10个对数生长期的海拉细胞,常规培养至80%融合度时,参照Lipofectamine2000 说明书,将PTEN-WT、PTEN-MUT 质粒分别与miR-425-5p mimics/inhibitor 及其阴性对照共转染至海拉细胞中,其中每组设置3个复孔。转染48 h后依照荧光素酶活性检测试剂盒(美国Promega 公司)随附指南测量细胞的荧光素酶活性。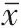
2 结果
2.1 转染后各组海拉细胞中miR-425-5p 的表达水平
实时荧光定量PCR 检测结果表示,mimics-NC组(1.00±0.05)、miR-425-5p mimics 组(4.88±1.23)、inhibitor-NC 组(1.00±0.06)、miR-425-5p inhibitor 组(0.26±0.02)海拉细胞中miR-425-5p 的表达水平比较差异有统计学意义(F
=34.585,P
<0.001)。 与mimics-NC 组比较,miR-425-5p mimics 组明显升高(P
<0.05);与inhibitor-NC组比较,miR-425-5p inhibitor组明显降低(P
<0.05)。2.2 miR-425-5p 对宫颈癌海拉细胞增殖的影响
MTT 法和平板克隆形成实验检测结果显示,转染miR-425-5p mimics 后海拉细胞存活率和克隆形成率均比mimics-NC 组明显升高(P
<0.05);但转染miR-425-5p inhibitor 后海拉细胞存活率和克隆形成率均明显低于inhibitor-NC 组(P
<0.05)。 见表1、图1。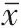
表1 各组细胞存活率和克隆形成率的比较/(%,±s)
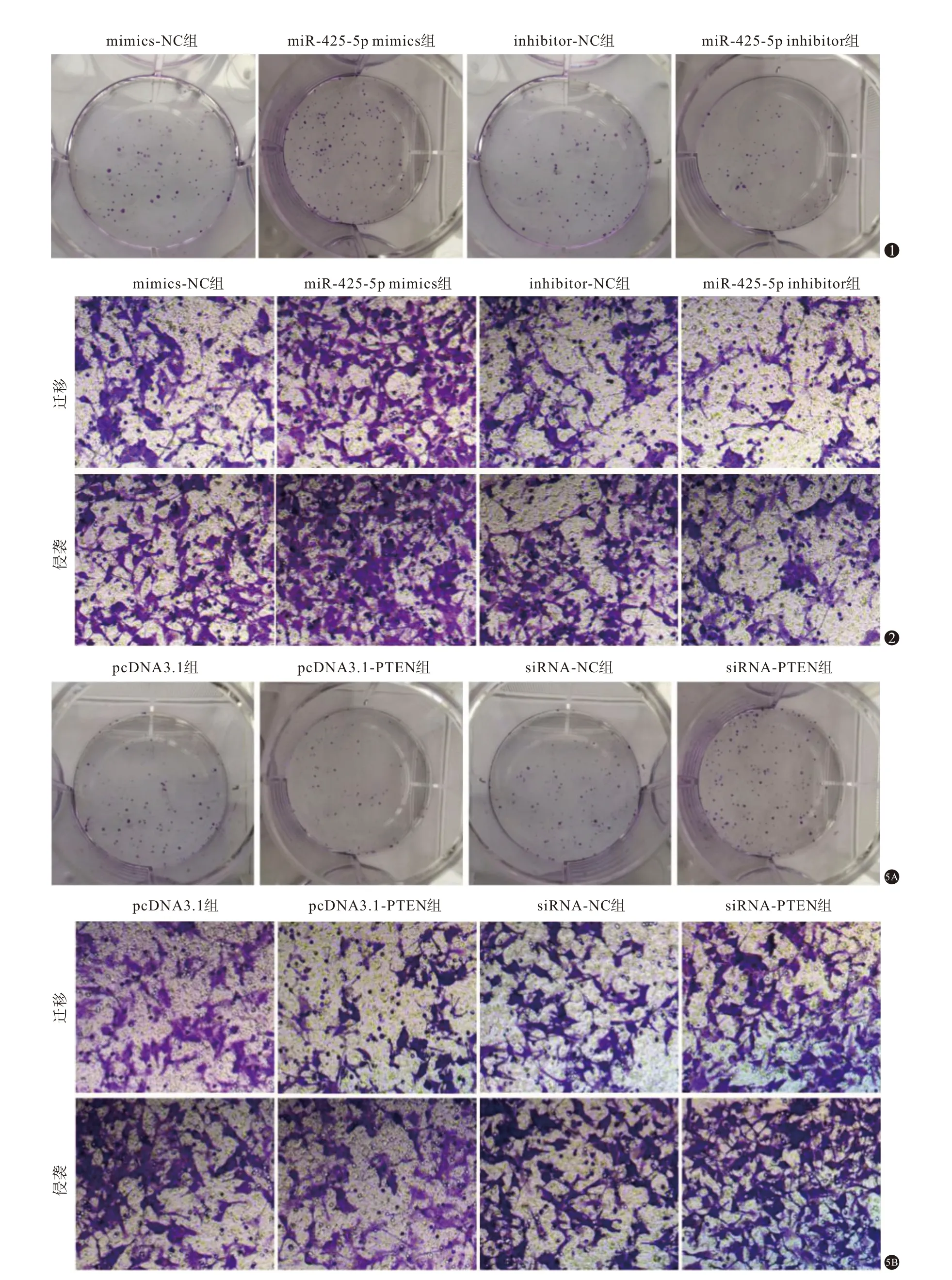
图1 各组宫颈癌海拉细胞克隆形成图片 图2 转染miR-425-5p模拟物(mimics)、抑制剂(inhibitor)的宫颈癌海拉细胞迁移和侵袭细胞(结晶紫染色×200) 图5 磷酸酶及张力蛋白同源基因(PTEN)表达对宫颈癌海拉细胞增殖、侵袭和迁移的影响:5A为各组宫颈癌海拉细胞克隆形成图片;5B为各组宫颈癌海拉细胞迁移和侵袭细胞(结晶紫染色×200)
2.3 miR-425-5p 对宫颈癌海拉细胞侵袭和迁移的影响
Transwell 小室实验检测结果表示,miR-425-5p mimics 组中侵袭和迁移细胞数均明显高于mimics-NC 组,而miR-425-5p inhibitor 组中侵袭和迁移细胞数均比inhibitor-NC 组明显减少(P
<0.05)。见表2、图2。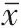
表2 转染miR-425-5p模拟物(mimics)/抑制剂(inhibitor)的细胞侵袭和迁移细胞数的比较/(个,±s)
2.4 miR-425-5p 靶基因预测及其验证
生物信息学软件TargetScan(http://www.targetscan.org)预测结果见图3A,miR-425-5p可靶向结合PTEN 3’UTR;双荧光素酶报告基因实验检测结果见表3,相比于转染mimics-NC,miR-425-5p mimics 可使PTEN-WT 的荧光素酶活性明显降低(P
<0.05);相较于转染inhibitor-NC,miR-425-5p inhibitor 可使PTEN-WT 的荧光素酶活性明显升高(P
<0.05)。同时,蛋白质印迹法检测结果图3B、表3 所示,与各自阴性对照组比较,miR-425-5p mimics 可使海拉细胞中PTEN 蛋白表达水平明显降低,而miR-425-5p 可使海拉细胞中PTEN蛋白表达水平明显升高(P
<0.05)。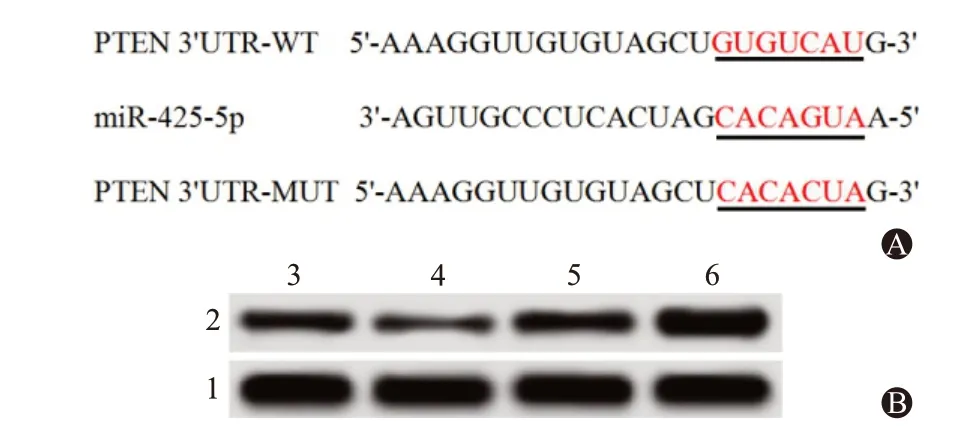
图3 miR-425-5p 和PTEN 靶向关系的验证:A 为miR-425-5p 与PTEN 3’非翻译区(UTR)存在互补的结合位点,B为蛋白质印迹法检测磷酸酶及张力蛋白同源基因(PTEN)蛋白表达电泳图
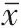
表3 各组细胞荧光素酶活性和磷酸酶及张力蛋白同源基因(PTEN)蛋白表达水平的比较/±s
2.5 PTEN 表达对宫颈癌海拉细胞增殖、侵袭和迁移的影响
将pcDNA3.1-PTEN 过表达质粒和靶向PTEN 的小RNA 干扰序列siRNA-PTEN 转染至海拉细胞后,进一步观察PTEN 表达对宫颈癌海拉细胞增殖和侵袭的影响,结果见图4、图5、表4。pcDNA3.1-PTEN 组细胞中PTEN 蛋白表达水平比pcDNA3.1 组高,而细胞存活率、克隆形成率、侵袭细胞数和迁移细胞数均比pcDNA3.1 组低(P
<0.05);siRNA-PTEN组细胞中PTEN蛋白表达水平低于siRNANC组,而细胞存活率、克隆形成率、侵袭细胞数和迁移细胞数均高于siRNA-NC组(P
<0.05)。
表4 各组中磷酸酶及张力蛋白同源基因(PTEN)蛋白表达水平、细胞存活率、克隆形成率、侵袭细胞数和迁移细胞数的比较/±s
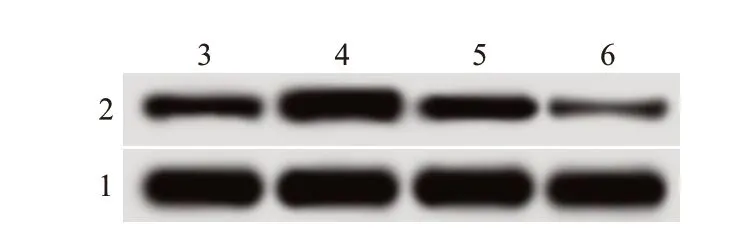
图4 蛋白质印迹法检测各组细胞中磷酸酶及张力蛋白同源基因(PTEN)蛋白表达电泳图
3 讨论
3.1 miR-425-5p促进宫颈癌海拉细胞的增殖、侵袭和迁移
miRNAs 是一类内源性非编码RNA,虽然只占人类基因的1%,但其已被证明与肿瘤发生发展密切相关。miR-425-5p 是miRNAs 家族中的重要成员,在肝癌、胰腺癌、结直肠癌等肿瘤中的水平异常升高,且可通过对肿瘤细胞增殖、转移等过程的调节起促癌作用。例如:Quan 等在肾癌中发挥miR-425-5p 表达水平明显上调,且具有促进癌细胞增殖、侵袭、迁移和抑制细胞凋亡的作用,被认为可能是肾癌发生发展过程中重要的致癌基因。Zhang 等研究发现,miR-425-5p 高表达是导致前列腺癌恶性发展的重要机制,其作为促癌因子加速前列腺细胞增殖和转移等过程。Wu 等报道,miR-425-5p 在肝癌的恶性进展过程中发挥着积极作用,其可通过靶向调控FOXD3表达促进癌细胞的增殖、迁移和侵袭并阻止细胞凋亡。miR-425-5p 在宫颈癌中存在着异常高表达,且其表达水平与病人不良预后密切相关;然而,miR-425-5p 在宫颈癌发生发展中的作用机制并不完全清楚。本研究通过转染miR-425-5p inhibitor 成功下调miR-425-5p 表达后,MTT 法检测发现宫颈癌海拉细胞增殖活力明显降低。该结论与Zhang 等通过MTT 法所得出的miR-425-5p 低表达可抑制宫颈癌海拉细胞增殖的结论相符。此外,本研究通过平板克隆形成实验进一步证实了下调miR-425-5p 表达具有抑制宫颈癌海拉细胞增殖的作用,上调miR-425-5p 表达可增强宫颈癌海拉细胞增殖能力。另外,本研究通过Transwell 小室实验还检测到,miR-425-5p 高表达可促进宫颈癌海拉细胞侵袭和迁移,而miR-425-5p 低表达可抑制宫颈癌海拉细胞侵袭和迁移。以上数据表明,miR-425-5 作为宫颈癌的促癌因子,通过影响宫颈癌的细胞增殖、侵袭和迁移加速宫颈癌的发生发展。
3.2 靶向PTEN 是miR-425-5p 调节宫颈癌海拉细胞增殖、侵袭和迁移的重要机制
PTEN 是一个定位于10q23 染色体上的抑癌基因,可通过脂质磷酸酶活性、蛋白磷酸酶活性和调控细胞内相关信号通路等影响细胞增殖、分化和迁移等过程,并参与宫颈癌等肿瘤的发生发展。Peng 等研究指出,PTEN 在宫颈癌中呈现低表达,且可被miR-301a 靶向调控影响宫颈癌细胞增殖。另外,Zhu 等研究指出,PTEN 是miR-641 下游靶基因,在miR-641 介导的宫颈癌细胞侵袭和迁移过程中发挥着重要的抑制作用。Xiao等在乳腺癌研究中发现miR-425-5p可通过靶向调控PTEN 表达促进癌细胞增殖和迁移。本研究证实,PTEN 是miR-425-5p 的靶基因。本研究转染pcDNA3.1-PTEN 过表达质粒成功上调PTEN 表达后发现,宫颈癌海拉细胞增殖、克隆形成、侵袭和迁移能力明显减弱;转染PTEN-siRNA 成功下调PTEN 表达后发现,宫颈癌海拉细胞增殖、克隆形成、侵袭和迁移能力明显增强。结果表明,PTEN 对宫颈癌海拉细胞的增殖、侵袭和迁移具有肿瘤抑制作用。总之,本研究提供了新的证据,表明miR-425-5p 促进宫颈癌恶性进展的作用机制是通过靶向调控PTEN表达来实现的。这种新发现的miR-425-5p/PTEN 调控网络表明其有潜力成为未来宫颈癌病人的预后标志物和有效靶点。
(本文图1,2,5见插图12-4)
