茶树炭疽菌分离鉴定与遗传转化体系建立
2021-12-14彭成彬陈美霞魏日凤张承康
彭成彬,陈美霞,魏日凤,孙 云,张承康,刘 伟
( 1.福建农林大学园艺学院,福建 福州 350002;2.宁德师范学院生命科学学院,福建 宁德 352100)
【研究意义】茶树[Camelliasinensis(L.) O.Kuntze]原产于中国,为多年生常绿木本植物,多分布于亚热带和热带地区[1]。福建茶叶面积和产量都位居全国前茅,茶产业是福建省的支柱型产业,也是增加农民收入和促进经济发展重要手段[2]。近年来福建茶产业发展规模快速,大面积的种植导致炭疽病日益严重,由于管理不当导致病害频发,使茶叶产量下降,影响茶叶品质,制约茶产业健康发展。【前人研究进展】炭疽菌属(Colletotrichumspp.)是世界上被认为十大重要病原菌之一,能在全球范围内危害众多单双子叶植物[3],由于炭疽菌属的寄主非常广泛,茶树胶孢炭疽菌(C.gloeosporioides) 是造成茶树炭疽病害的主要病原菌之一,该致病菌侵染茶树嫩叶、新梢、茶树花和茶树果实等部位,发病前期叶片表面出现褐色小斑点,后期叶片表面形成枯死斑,使茶叶产量和品质下降,严重导致茶树致死,随着各茶园栽培面积的增加,不恰当的管理,农药的滥用势必导致生态环境恶化,加之夏季空气潮湿,温度高,促使茶树炭疽病害大面积爆发。造成经济损失[4-7]。炭疽菌属种与亚种之间的差异越来越小,仅靠形态学鉴定菌株是不准确的,同时分析菌株基因型和表现型,鉴定快速、结果准确。核糖体DNA是一段重复的序列,由非转录间隔区、转录间隔区和3种RNA(18S RNA、28S RNA、5.8S RNA)基因编码组成。因其具有良好的同质性,在细胞中以一种协同方式进化,可以揭示菌株DNA遗传本质,适合于所有菌株基于了ITS(Internal Transcribed Spacer,ITS)标记,被国内外研究者作为真菌通用DNA条形码[4,6]。绿色荧光蛋白基因(Green fluorescent protein)GFP标记能在具有生命特征的寄主里表达形成生物发光蛋白,不伤害活细胞,荧光信号在激光共聚焦显微镜下,检测到光源单一和稳定[8]。诸多研究者将不同丝状真菌进行GFP标记后,探究其侵染机制,诸如:香蕉枯萎病(Fusariumoxysporum)[9]、芒果畸形病(F.proliferatum)[10]、小麦根腐病(Bipolarissorokiniana)[11]、枣黑斑病(Alternariaalternata)[12]、水稻稻瘟病(Magnaportheoryzae)[13]等。GFP标记基因作为一种报告基因被广泛应用。【本研究切入点】现有研究表明不同地区茶树炭疽病主要病原菌不同,炭疽菌对不同宿主的侵染方式亦存在较大差别,而对于茶树炭疽病菌侵染方式的研究鲜见报道,只有明确了病原菌后,并建立稳定的茶树炭疽病菌的遗传转化体系,可为后续研究茶树炭疽菌的关键致病功能基因奠定理论和技术基础。【拟解决的关键问题】目前对于该致病菌的防治也较为困难,由于茶树遗传背景的复杂性,选育和种植抗病品种周期长。主要通过农艺措施防治和化学农药防治[13]。为明确引起茶树炭疽病的致病菌种类及其构建一套高效、稳定的茶树炭疽病菌的遗传转化体系,有助于进一步深入研究茶树炭疽菌的致病相关功能基因分子机理以及挖掘潜在的可防控药剂分子靶标,以期为分子机制的研究提供新的线索,为茶树炭疽病的防治提供理论依据。
1 材料与方法
1.1 菌株来源
本研究所用致病菌来源分离自福州福建仓山区农林大学南山茶园、宁德蕉城区(洋中)万恒茶园、福安茶科所社口镇茶圃基地和政和县(杨源镇)的茶园采集病叶。pCZ007质粒是由福建农林大学功能基因组学研究中心惠赠。
1.2 试剂
本研究所用培养基配方见表1,PEG3350(聚乙二醇)购买自美国Sigma公司,氨苄青霉素(Ampicilline)、潮霉素B(Hygromycin B)和裂解酶(Lyase)由福州泰京生物有限公司代为购买,其他药品均为国产分析纯试剂。

表1 本试验所用试剂
1.3 方法
1.3.1 茶树致病菌分离 采用单孢分离法进行分离接种至PDA平板(含有50 μg/mL 氨苄青霉素)26 ℃培养,分离纯化后,采用科赫式法则将茶树致病菌用5 mm打孔器打菌饼和空白琼脂平板分别接入进行离体茶叶回接侵染。
1.3.2 致病菌DNA提取和PCR克隆及测序分析 参考植物基因组提取试剂盒(TIANGEN公司)方法进行DNA提取,本研究所用序列委托福州擎科生物公司合成,引物ITS序列见表2,反应扩增程序见表3,使用快捷型琼脂糖凝胶DNA回收试剂盒(BioTeke公司)分别标记回收目的条带,送福州铂尚生物科技有限公司进行双向测序,结果经NCBI的GenBank进行BLAST搜索比对,在用MEGA7.0软件进行ITS序列分析。
1.3.3 质粒的提取 按照大肠杆菌DH5α(TIANGEN公司)的方法转入pCZ007质粒至DH5α感受态细胞(该质粒编码融合有GFP的Histone1 蛋白将定位于细胞核),接入LB平板(含100 μg/mL 氨苄青霉素)过夜培养12~16 h,挑取抗性大肠杆菌接入LB液体培养基培养2~4 h扩繁用,用质粒提取试剂盒(TIANGEN公司)的方法提取质粒备用。
1.3.4 茶树胶胞炭疽菌原生质体制备与转化 炭疽菌菌丝在PD培养液培养3 d后,将菌丝各称取1 g,分装成4份,无菌操作过滤冲洗,研磨成匀浆后分别加入裂解酶(0.1、0.2、0.3和0.4 g)于10 mL 1.2 mol/L无菌 KCl溶液于30 ℃ 90 r/min摇床裂解,2 h计数裂解原生质体,用Mrcloth膜过滤菌丝,原生质体(200 μL/管)中加入浓度为3000 μg/μL待转化的DNA片段或者质粒,轻弹充分混合,冰上静置20 min。分2次加入1.25 mL PTC,轻弹充分混合,冰上静置20 min。加入5 mL TB3液体培养基(含100 μg/mL 氨苄青霉素),28 ℃ 85 r/min轻摇复苏14~18 h。加入40 mL 熔化并冷却至50 ℃左右的TB3固体培养基(含100 μg/mL氨苄青霉素,200 μg/mL HYG(B)[潮霉素B缩写HYG(B),购买自福州泰京生物],上下颠倒混匀,均匀倒入15 cm平板中,吹干30 min。从培养4 d的TB3固体培养基上层板[含100 μg/mL 氨苄青霉素,300 μg/mL HYG(B)]挑取转化子至新的PDA平板[含100 μg/mL HYG(B)]上培养2~3 d。
1.3.5 转化子分子验证 转化子分别用PD培养基26 ℃倒置培养3~4 d,过滤菌丝,用植物基因组试剂盒分别提取基因组,以其上一步提取成功的质粒为阳性对照模板,清水组为阴性对照模板,同时进行特异性扩增。GFP引物序列参见表2,扩增程序见表3,扩增预期片段大小400 bp。
1.3.6 Cg N与转化子CgNT6的抗性验证定 用5 mm打孔器分别将转化子CgNT6和野生型Cg N的菌饼接入CM液体培养基含100 μg/mL HYG(B) 于26 ℃培养4 d,记录并观察结果。
1.3.7 转化子CgNT6的荧光检测 在激光共聚焦显微镜下观察将培养4 d的转化子CgNT6的菌丝进行荧光现象观察。
1.3.8 转化子CgNT6的稳定性检测 将转化子CgNT6和野生型Cg N分别接入含有100 μg/mL HYG(B)-PDA平板,在26 ℃下培养5代后分别检测荧光效果。
1.3.9 转化子 CgNT6的致病性检测 用5 mm打孔器将转化子CgNT6和空白琼脂平板分别接入离体茶叶,在26 ℃培养4 d观察侵染茶叶病斑。
2 结果与分析
2.1 茶树致病菌分离
福州福建农林大学南山茶园、宁德(洋中)万恒茶园、福安茶科所社口镇茶圃基地、政和县(杨源镇)的茶园、周宁归来客茶园基地采集茶树炭疽病叶进行了分离,每个培养皿内放3~4个病叶(2 mm×2 mm),26 ℃恒温培养菌株,反复单孢分离纯化4~5次,得到该病原菌的纯培养物。通过前期分离菌落形态共分离12株致病分离物,对茶叶侵染,炭疽菌引起茶叶病斑大小,发现炭疽菌饼离体回接茶叶致病性最强为菌株N(图1-b),其分离自宁德市万恒茶园,选取该菌株N进行后续试验菌落形态和孢子形态(图2-a和b)初步判断N菌为炭疽菌。
表2 本试验所用引物序列

表3 ITS PCR扩增反应程序
2.2 PCR克隆及测序分析序列分析
提取致病菌株N的基因组DNA进行ITS特异性扩增,1%琼脂糖凝胶电泳检测(120V电压下15~20 min),结果由图2-c可知扩增的条带单一、清晰明亮、分子量500~750 bp与预期大小一致。测序分析结果经NCBI的GenBank进行BLAST搜索比对,结果显示:致病菌株 N的ITS序列与登录号HQ645081为Colletotrichumgloeosporioides在MAGA5构建NJ进化树聚类在一个分支上,支持率为67%(图3),因此结合病原菌的形态特征和分子生物学鉴定结果,确定茶树炭疽病病原菌为胶孢炭疽菌C.gloeosporioides。

a.炭疽病叶;b.致病菌N回接发病的茶叶;c、d、e.福安致病菌回接发病的茶叶;f、g.福州致病菌回接发病的茶叶;h.CK空白对照;i、j、k.政和致病菌回接发病的茶叶;l、m、n.宁德洋中致病菌回接发病的茶叶 a.The natural anthracnose of tea leaf;b.The tea leaf that re-infected by N isolate;c,d,e.Tea leaves infected by pathogenic Fuan’s isolates;f,g.Tea leaves leaves infected by pathogenic Fuzhou’s isolates;h.Blank control;i,j,k.Tea leaves infected by pathogenic FA’s isolates;l,m,n.Tea leaves infected by pathogenic YZ’s isolates图1 不同来源的茶树炭疽病病原菌的致病力测定Fig.1 Pathogenicity of tea anthoracnose pathogens from different origins

a.茶树炭疽菌N菌株菌落形态;b.N菌株分生孢子形态,比例尺为10 μm;c.M为marker 2000,1为ITS条带 a.C.gloeosporioides N isotate colony;b.C.gloeosporioides spores,the scale was 10 μm;c.M was marker 2000,1 is ITS single band图2 茶树炭疽菌N的菌落和分生孢子形态以及ITS片段的PCR检测Fig.2 The colony and conidia morphology of C.gloeosporioides N isolate and the PCR detection of ITS fragment

图3 基于ITS序列分析构建NJ-系统树Fig.3 The NJ-system tree based on ITS sequence analysis
2.3 菌丝裂解
分别采用浓度为10、20、30和40 mg/L的菌丝裂解液10 mL裂解1 g菌株N的菌丝,置于30 ℃ 90 r/min摇床裂解,2 h后观察菌株裂解情况。结果显示菌丝酶解出的原生质体,颗粒饱满,未见塌陷(图4)。统计数据显示,随着裂解酶浓度增加原生质体的浓度随之增大,呈线性分布R2为0.9856(图5)。2 h计数原生质体数量发现1 g菌丝在20 mg/L浓度下原生质体浓度达到4.49×106,从实验成本考虑出发0.2 g/10 mL浓度为最适浓度。

图4 原生质体裂解Fig.4 Protoplasts of C.gloeosporioides N isolate

图5 原生质体与裂解酶浓度线性图Fig.5 Linear graph of the concentration of protoplasts and lyase
2.4 转化子分子验证结果
将含有pCZ007质粒的大肠杆菌进行液体培养16 h,随后进行质粒提取并检测浓度达到300 ng/uL。将质粒转化入茶树炭疽菌N(下文称为Cg N)的原生质体中。从26 ℃培养4 d后的TB3平板上挑取转化子,从中随机选取4株转化子(t6、t19、t25和t44)提取基因组DNA,进行PCR验证,以质粒pCZ007为阳性对照。经过1%琼脂糖凝胶电泳检测(120 V电压下15~20 min),选取1株命名为CgNT6的转化子进行后续实验,由图6可知,扩增的条带单一、清晰明亮、分子量400 bp与预期大小一致,GFP标记基因整合到转子菌株CgNT6里,而阴性对照不含DNA模板,扩不出相应的条带大小。
2.5 Cg N与转化子CgNT6的抗性验证定
由图7可知,将转化子CgNT6和野生型Cg N培养4 d后,由于Cg N不含有对潮霉素抗性,在含有潮霉素B的CM固体培养基中不能生长,而转化子CgNT6能正常生长。
2.6 转化子CgNT6的荧光检测及稳定性检测
在激光共聚焦显微镜下观察转化子CgNT6的菌丝和分生孢子以及培养5代后的菌丝的细胞核均能稳定发出强烈的绿色荧光现象见图8。

M为Marker2000;1~6分别是t6、t19、t25、t44、H2O和质粒pCZ007 M is Marker2000;1-6 is t6,t19,t25,t44,H2O and pCZ007,respectively图6 pCZ007转化子的PCR鉴定Fig.6 PCR verification of pCZ007 transformants
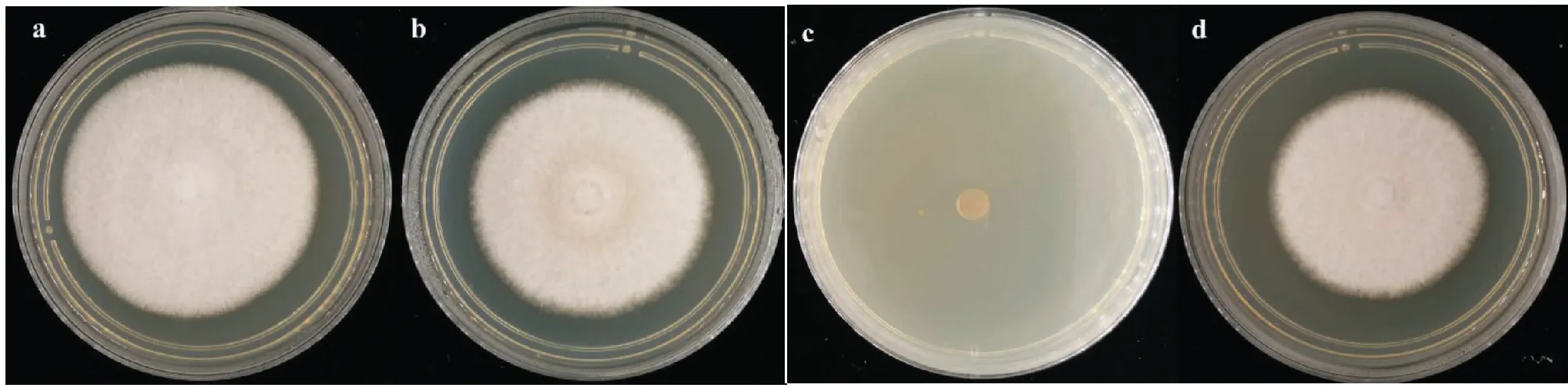
a.Cg N野生型在AMP-CM培养基; b.Cg N野生型在AMP-HYG(B)-CM培养基;c.CgNT6野生型在AMP-CM培养基;d.CgNT6野生型在AMP-HYG(B)-CM培养基 a.Cg N wild type in AMP-CM medium;b.Cg N wild type in AMP-HYG(B)-CM medium;c.Wild type CgNT6 in AMP-CM medium;d.CgNT6 wild type in AMP-HYG(B)-CM medium图7 CgNT6菌株的抗性验证Fig.7 Resistance verification of CgNT6 strain
2.7 转化子 CgNT6的致病性检测
回接4 d后的离体茶叶进行病斑观察发现CK空白琼脂不含菌株对照叶片无变化,接入转化子CgNT6的茶叶产生明显病斑(图9),茶树胶孢炭疽菌转化pCZ007质粒的转化子CgNT6对茶叶的致病性无影响,说明外源转入的筛选标记基因(HYG)以及GFP蛋白对胶孢炭疽菌的致病性没有影响。
3 讨 论
茶树炭疽病分布广泛,在世界各主要茶产区普遍发生,发病较重时,激起茶树自身防卫,分泌激素使叶片提早脱落,进而影响树势的生长,最后减少茶叶产量[14]。要防控茶树炭疽病,应先明确病原菌的种类,本实验根据王玉春等研究提出的方法[15],采集福建各地茶园的病叶进行观察和记录;再单孢分离筛选致病性强的病原菌并提取优势病原菌基因组DNA;利用分子检测手段PCR扩增ITS序列进行序列比对,结合形态特征鉴定得到一株致病性较强的茶树炭疽菌——胶孢炭疽菌Cg N。
针对目前,茶树病害防控技术也多采用简单、传统的广谱药剂,诸如炭特灵、丙环唑、福碇胺、咪鲜胺等进行喷施防治病害[6-7,15],容易造成农药残留,降低茶叶品质。此外,农药的滥用也导致病原菌的耐药性增加,造成增加施药量的恶性循环。因此,更加迫切需要合理精准的绿色防控。对不同地域茶树炭疽病病原菌的分离与鉴定,有助于对不同的病原菌进行针对性的防治。此外,建立稳定的病原菌遗传转化体系将有助于深入解析茶树炭疽菌的致病分子机制,为防治炭疽病挖掘更多药物靶点。本研究除了顺利获得一株致病力较强的茶树炭疽病病原菌Cg N外,还构建了该菌稳定的遗传转化体系。绿色荧光蛋白GFP已经被诸多研究者广泛地应用于丝状植物病原真菌侵染植物过程的研究[8-13]。本论文通过聚乙二醇PEG-CaCl2介导转化法将含有能表达H1-GFP(Histone 1融合GFP)蛋白的质粒成功地转化至茶树炭疽菌Cg N,说明茶树炭疽菌适合采用PEG-CaCl2介导转化法进行基因敲除等遗传分子操作,该结果同韩萌萌等在芒果炭疽菌中的研究一致[16]。稳定性、荧光现象、潮霉素B抗性,以及形态和致病力上,相对于野生型并无明显差异,表明GFP基因标记对于茶树胶胞炭疽菌的影响是中性的。除了聚乙二醇PEG-CaCl2介导转化法外,有很多研究者在菌物研究中应用农杆菌转化法,如李志伟等用农杆菌转化法将含有GFP基因成功转入至茶树炭疽病病原菌中[17],相比较于农杆菌转化法,需要反复构建载体,只能以T-DNA形式插入、农杆菌与受体细胞的共培养时间、以及双元载体等因素的影响,本方法仅需用适量溶壁酶等渗溶液就可获取得到原生质体、在PEG-CaCl2介导下即可转入外源目的片段,就可筛选获得突变体,具有操作简单、对仪器要求不高等优点。后续我们将在本研究的基础之上,利用CgNT6菌株,观察茶树炭疽菌侵染和定殖茶叶的过程,并进一步利用建立的遗传体系,对茶树炭疽菌的相关基因进行功能研究。

a、d.野生型Cg N;b、e.转化子CgNT6;c、f.转化子CgNT6第5代 a and d.Cg N strain;b and e.Transformant CgNT6;c and f.The 5th generation of transformant CgNT6图8 CgNT6菌株的GFP荧光观察Fig.8 Flourescent observation of GFP-marked CgNT6 strains

a.CgNT6菌落;b.转化子CgNT6侵染茶叶图;c.空白对照;d.Cg N侵染茶叶图 a.CgNT6 strain;b.Tea leaf infected by CgNT6;c.The blank control;d.Tea leaf infected by Cg N图9 CgNT6的致病性检测Fig.9 Pathogenicity test of CgNT6 strain
4 结 论
本研究从茶树炭疽病分离鉴定一株主要强致病力的致病菌株Cg N,经形态学结合分子检测,鉴定为胶孢炭疽菌(C.gloeosporioides),并成功建立了能稳定表达目的基因的遗传转化体系,为后续深入研究茶树炭疽菌的相关关键基因的功能,以及观察茶树胶胞炭疽菌对茶树叶片的侵染过程和传播途径提供很好的技术支撑,为研究炭疽病病原菌与宿主互作的机制从而为科学防治茶树炭疽病奠定了坚实的基础。
