呼吸道感染患儿肠道菌群紊乱与Th17/Treg及其分泌炎性细胞因子免疫平衡的相关性研究
2021-12-14孟改利周雪红
康 茹,孟改利,周雪红
(1.西北妇女儿童医院检验科,西安 710061;2.民航西安医院,西安 710082)
呼吸道感染是由致病微生物入侵呼吸道而引发的一系列呼吸道症状,是儿童常见病之一,引起感染的致病菌种类繁多,患者病情严重程度与微生物毒力密切相关[1]。研究报道,儿童呼吸道感染与呼吸道解剖特点及发育不成熟有关,同时机体免疫功能低下也是引起呼吸道感染的主要原因,认为感染过程是病原微生物入侵宿主激活免疫反应消灭入侵病原体的过程,病原微生物感染及机体免疫力下降是呼吸道感染致病的主要病因[2-3]。此外LI 等[4]指出,呼吸道感染会引起机体肠道菌群紊乱,肠道菌群在调节肠道免疫系统中具有重要作用。MCKAY 指出[5],肠道菌群失调是学龄以下儿童呼吸道感染的致病因素之一。肠道作为机体最大的免疫器官,在合成代谢、免疫防御中发挥重要作用,参与机体免疫系统建立,与儿童呼吸系统疾病关系密切[6]。Th17/Treg 失衡及相关细胞因子表达异常在免疫应答系统及炎症反应中起到重要作用,机体炎性因子异常波动引起Th17/Treg 比例失衡,参与多种自身免疫性疾病及炎性疾病,在肠道免疫平衡中发挥主导作用[7]。基于此,本研究拟探究分析呼吸道感染患儿肠道菌群紊乱与Th17/Treg 细胞及其分泌炎性细胞因子免疫平衡的相关性,以期为呼吸道感染患儿的临床防治提供价值参考。
1 材料与方法
1.1 研究对象 前瞻性选取2019年5月~2020年11月西北妇女儿童医院收治的呼吸道感染患儿135例作为研究观察组,排除患有原发性或继发性免疫疾病或功能缺陷者;并发严重肝肾功能障碍或心脑血管疾病;入院前1月内应用肾上腺皮质激素、免疫调节剂者;患有其他器官器质性疾病或先天性心脏病者;呼吸道畸形者;患有哮喘疾病者等。观察组患儿年龄0~6 岁,平均年龄3.4±0.7 岁,男性63 例,女性72 例,根据《肠道菌群粪便图片检查图谱》[8]中肠道菌群紊乱判断标准分为菌群失调组(n=60,B/E <1.01)和非菌群失调组(n=75,B/E ≥1.01)。另选取同期健康体检儿童100 例作为对照,年龄0~6 岁,平均年龄3.2±1.0 岁,男性49 例,女性51 例。观察组与对照组儿童年龄、性别比较差异无统计学意义(P>0.05)。本研究获得我院医学伦理委员会批准通过,家属均知情并签署同意书。
1.2 仪器与试剂 GaspaK 厌氧盒购自北京东方大林科技有限公司;选择性培养基购自广州市乐试生物科技有限公司;流式细胞仪购自美国贝克曼库尔特公司;血清IL-2,IL-6,IL-17,IL-10 检测试剂盒购自武汉默沙克生物科技有限公司;ELISA 酶联免疫吸附仪购自美国BIO-RAD 公司;温育箱购自北京福意联医疗设备公司。
1.3 方法
1.3.1 肠道菌群检测: 留取各组儿童新鲜粪便约5g,装入厌氧袋封闭于30min 内进行送检;采用连续稀释法(10-1~10-10)稀释粪便样本,采用滴注法于选择性培养基上进行接种,其中乳酸杆菌、双歧杆菌应用GaspaK 厌氧盒37℃培养48 h,肠球菌、大肠埃希菌直接放置于37℃温箱培养24h,观察并计数,同时计算双歧杆菌/大肠埃希菌比值(B/E)。
1.3.2 外周血Th17,Treg 细胞百分比检测:取空腹静脉血2ml,采用密度梯度法获取外周静脉血单个核细胞进行孵育培养,加入抗人IL-17A PE 和CD4-FITC 检 测Th17细胞,加入CD25-PE检测Treg 细胞,对照管加入MouseIgG1-PE 作为对照,室温孵育30min,加入PBS 洗涤重悬,采用流式细胞仪分别检测各组外周血Th17,Treg 细胞百分比。
1.3.3 血清炎性细胞因子检测: 取空腹静脉血5ml,采用酶联免疫吸附法检测各组血清IL-2,IL-6,IL-17,IL-10 水平。
1.3.4 观察指标:观察各组肠道菌群数量,Th17/Treg细胞免疫平衡及血清炎性细胞因子水平变化,分析肠道菌群与Th17,Treg 细胞及血清炎性细胞因子表达的相关性。
1.4 统计学分析 采用软件SPSS 20.0 进行数据分析,计量资料采用均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用独立样本t检验;计数资料采用n表示,组间采用χ2检验;Pearson 相关性分析肠道菌群与Th17,Treg细胞及其分泌炎性细胞因子的相关性,P<0.05为差异有统计学意义。
2 结果
2.1 各组肠道菌群数量比较 见表1。三组儿童肠道各菌群数量组间差异均有统计学意义(均P<0.05);菌群失调组乳酸杆菌、双歧杆菌数量及B/E 值较非菌群失调组和对照组明显降低,肠球菌、大肠埃希菌数量明显升高,差异均有统计学意义(均P<0.05);非菌群失调组和对照组各菌群数量差异 无统计学意义(均P>0.05)。
表1 各组肠道菌群数量比较(±s,lg CFU/g)

表1 各组肠道菌群数量比较(±s,lg CFU/g)
项 目 菌群失调组① (n=60)非菌群失调组② (n=75)对照组③(n=100) F P ① vs ③ ① vs ②t P t P 乳酸杆菌 5.73±0.94 7.25±1.43 7.52±1.22 42.449 <0.001 8.914 <0.05 7.137 <0.05双歧杆菌 8.65±1.35 9.87±1.62 10.21±1.41 21.947 <0.001 6.517 <0.05 4.805 <0.05肠球菌 8.52±1.26 7.14±0.98 6.93±1.15 40.184 <0.001 8.625 <0.05 7.058 <0.05大肠埃希菌 10.01±1.43 9.25±0.88 9.11±0.97 13.849 <0.001 5.098 <0.05 4.059 <0.05 B/E 值 0.86±0.18 1.07±0.27 1.12±0.34 16.395 <0.001 5.600 <0.05 4.265 <0.05
2.2 各组Th17,Treg 细胞百分比比较 见表2。三组外周血Th17%,Treg%组间比较差异均有统计学意义(均P<0.05);与对照组相比,菌群失调组和非菌群失调组Th17%明显升高,Treg%明显降低,差异均有统计学意义(均P<0.05);菌群失调组Th17%,Treg%变化更显著(P<0.05)。
表2 各组Th17%,Treg%及Th17/Treg 比值比较(±s)
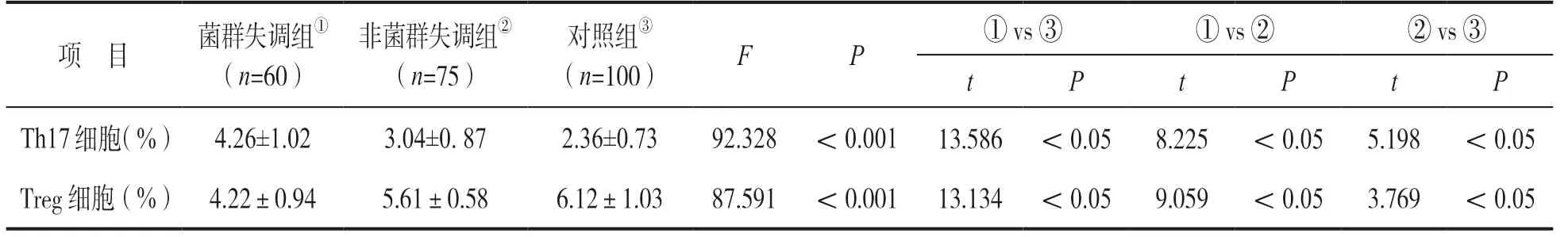
表2 各组Th17%,Treg%及Th17/Treg 比值比较(±s)
项 目 菌群失调组① (n=60)非菌群失调组② (n=75)对照组③ (n=100) F P ① vs ③ ① vs ② ② vs ③t P t P t P Th17细胞(%) 4.26±1.02 3.04±0. 87 2.36±0.73 92.328 <0.001 13.586 <0.05 8.225 <0.05 5.198 <0.05 Treg 细胞(%) 4.22±0.94 5.61±0.58 6.12±1.03 87.591 <0.001 13.134 <0.05 9.059 <0.05 3.769 <0.05
2.3 各组血清炎性细胞因子水平比较 见表3。三组血清炎性细胞因子水平差异均有统计学意义(均P<0.05);与对照组相比,菌群失调组和非菌群失调组IL-2,IL-6,IL-17 水平明显升高,IL-10明显降低,差异均有统计学意义(均P<0.05);菌群失调组IL-2,IL-6,IL-17,IL-10 水平变化更显著(P<0.05)。
表3 各组血清炎性细胞因子水平比较(±s)
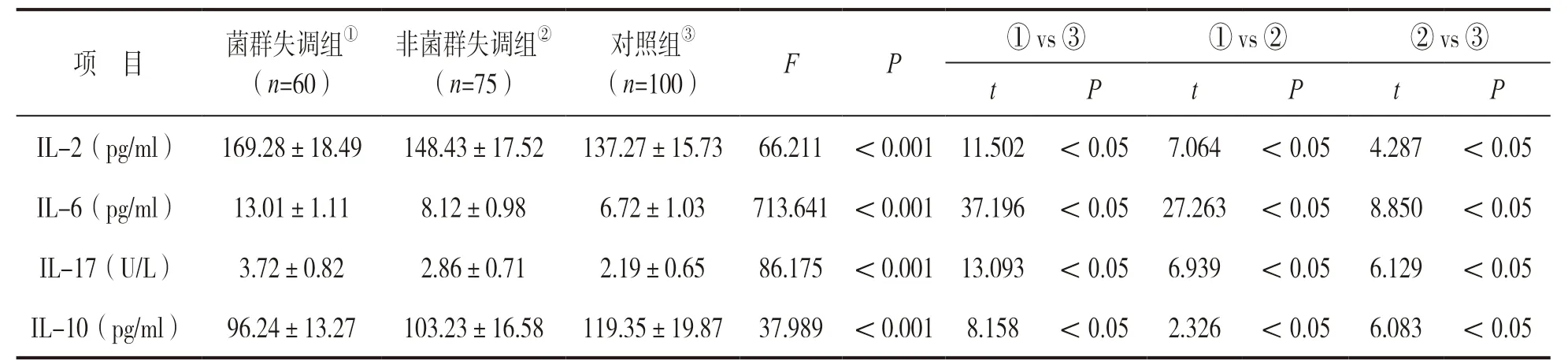
表3 各组血清炎性细胞因子水平比较(±s)
项 目 菌群失调组① (n=60)非菌群失调组② (n=75)对照组③ (n=100) F P ① vs ③ ① vs ② ② vs ③t P t P t P IL-2(pg/ml) 169.28±18.49 148.43±17.52 137.27±15.73 66.211 <0.001 11.502 <0.05 7.064 <0.05 4.287 <0.05 IL-6(pg/ml) 13.01±1.11 8.12±0.98 6.72±1.03 713.641 <0.001 37.196 <0.05 27.263 <0.05 8.850 <0.05 IL-17(U/L) 3.72±0.82 2.86±0.71 2.19±0.65 86.175 <0.001 13.093 <0.05 6.939 <0.05 6.129 <0.05 IL-10(pg/ml) 96.24±13.27 103.23±16.58 119.35±19.87 37.989 <0.001 8.158 <0.05 2.326 <0.05 6.083 <0.05
2.4 肠道菌群与Th17,Treg 细胞及血清炎性细胞因子的相关性 见表4。Pearson 相关性分析显示,呼吸道感染患儿Th17%及IL-2,IL-6,IL-17 水平与乳酸杆菌、双歧杆菌、B/E 值呈负相关,与肠球菌、大肠埃希菌呈正相关(均P<0.05);Treg%及IL-10 水平与乳酸杆菌、双歧杆菌、B/E 值呈正相关,与肠球菌、大肠埃希菌呈负相关(均P<0.05)。
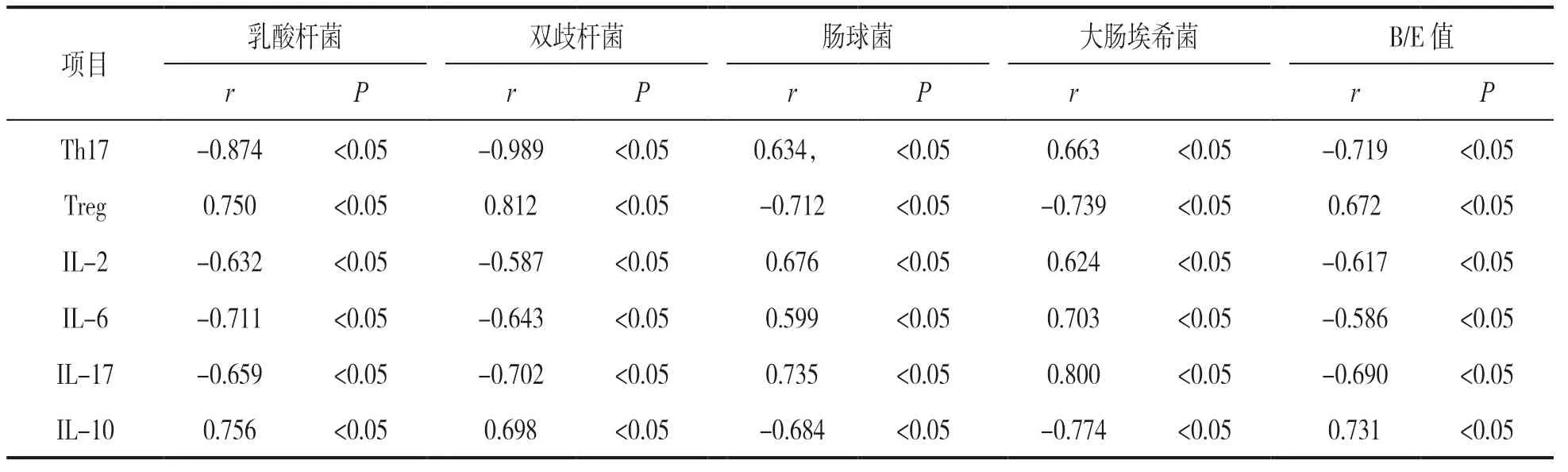
表4 相关性分析
3 讨论
呼吸道感染是临床儿童常见的呼吸系统疾病,以学龄前儿童最为多见,目前对于其发病机制尚未完全明确,但研究认为,微生物入侵、自身免疫缺陷及外界环境变化是诱发呼吸道感染的主要病因[9]。既往对于呼吸道感染免疫机制认为与机体体液免疫相关,然而近年研究发现,由呼吸道病原微生物感染引起T 淋巴细胞数量、比例失衡,导致机体免疫调节失衡也是引发呼吸道感染的病机之一[10]。另研究发现,呼吸道感染会引发机体肠道微生物代谢紊乱,影响机体肠道功能屏障,并指出肠道菌群作为人体最大且最复杂的微生态系统,在维持机体免疫稳定、驱动免疫成熟及抗感染方面发挥重要生理功能[11]。据相关报道,呼吸道微生物组成与宿主的天然免疫激活有关,呼吸道感染与肠道菌群表现为双向交互影响,呼吸道感染引起肠道菌群及肠功能改变,而肠道菌群紊乱亦会加重呼吸道疾病[12]。肠道有益菌群中大多数的专性厌氧性细菌一方面能够限制数量较少的潜在致病菌的过度生长,维持肠道菌群平衡;另一方面正常的肠道菌群可对抗外源性致病菌的入侵、定植,形成肠道菌群的生物拮抗作用,维持正常肠道菌群稳定及保护诉主免于感染[6,11]。并发现,肠道菌群数量或空间位置异常会引起机体免疫功能受损,增加易感性[13]。肠道菌群通过调节肠道宿主免疫,介导肠道外T 淋巴细胞群扩、分化,影响机体全身免疫应答[10]。肠道菌群平衡与否是肠道免疫系统的刺激因子,其一旦失衡使致病菌数量增加通过攻击肠道优势菌群引起肠道屏障功能损伤,诱发宿主炎性反应,引起免疫功能异常[13]。目前研究已证实,肠道菌群及其代谢产物与人体免疫系统发育成熟关系密切,介导参与多种呼吸系统疾病的免疫反应过程[14]。因此,积极探究呼吸道感染患者肠道菌群变化及与免疫炎症失衡的关系,对临床诊治具有积极意义。
据报道,肠道菌群在免疫系统及抑制病原菌等方面影响宿主肠道功能,正常生理条件下,肠道内乳酸杆菌、双歧杆菌等有益菌可形成生物屏障保护肠道正常生理功能,一旦发生菌群紊乱则会引起有益菌转变为致病菌,造成肠道黏膜屏障及肠功能障碍[15]。乳酸杆菌、双歧杆菌通过争夺营养代谢合成酸性产物,不仅能够降低肠道pH 值,还能杀灭或抑制大肠埃希菌等条件致病菌,维持肠道菌群平衡,其中双歧杆菌通过作用于机体免疫系统,能够刺激诱发肠道免疫功能[7]。研究显示,呼吸道合胞病毒感染导致小鼠肠道微生物群显著性多样改变,表现为乳酸杆菌属丰度降低,拟杆菌门数量增加,肠道炎症相关指标水平升高[16]。予以抗生素诱导的肠道菌群失调小鼠拟杆菌门数量减少,炎性因子IL-6,IL-8,TNF-α 等水平及肠屏障相关基因Occludin,ZO-1 表达降低,表明菌群失调会引起免疫失调[17]。还发现较健康体检儿童相比,反复呼吸道感染患儿乳酸杆菌、双歧杆菌数量降低,肠球菌、大肠埃希菌数量升高[18]。本研究检测发现菌群失调组患儿新鲜粪便中各菌群数量及B/E 值明显异常波动,差异于非菌群失调组和对照组,与文献[18]报道结果相一致;而非菌群失调组较对照组变化不显著,提示肠道菌群异常变化与呼吸道感染的发生及病情进展密切相关,肠道菌群失衡可能是引发患儿呼吸道感染的危险因素。
研究认为,肠道菌群对免疫系统的作用体现在驱动黏膜免疫系统发育成熟、诱导维持黏膜免疫应答稳态及维持增强肠道黏膜屏障[19]。T 细胞是重要的细胞免疫效应细胞和免疫调节细胞,宿主免疫系统发育成熟中肠道正常菌群定植起着关键作用,其通过调节性T细胞(Treg)维持机体免疫平衡及耐受,保持肠道内环境稳定[20]。肠道菌群紊乱是免疫-炎症反应系统改变的重要因素[21]。Treg 细胞是抑制炎性反应的T 细胞亚群,肠道菌群失衡时Treg 细胞数量下降,调节抗炎性细胞因子IL-10,TGF-β减少;而Th17 通过调节IL-2,IL-6 和IL-17 等促炎性细胞因子分泌,诱导炎症反应,两者共同参与调节机体免疫应答[22];并显示肠道菌群能够间接调控CD3+CD8-IL-17+细胞影响机体免疫反应,加剧炎性反应[20]。以上种种提示肠道菌群与机体免疫存在某种联系。本研究发现,呼吸道感染患儿外周血Th17%和Treg%较正常对照儿童明显升高或降低,相对应的细胞分泌炎性因子水平也明显同趋势变化,菌群失调组变化更显著,说明Th17 /Treg 免疫失衡及炎症反应参与了儿童呼吸道感染的发病进展。Pearson 相关性分析显示,呼吸道感染患儿外周血Th17%,Treg%及相应细胞分泌炎性因子与各菌群数量及B/E 值显著相关,由此推断肠道菌群紊乱引起机体Th17 /Treg 免疫失衡,通过调控炎症反应,促进儿童呼吸道感染的发生。然而本研究病例样本有限,还需进一步继续扩大样本量行多中心探究分析以期进行验证,为临床提供更准确可靠的参考价值。
近年,在对肠道菌群与呼吸系统疾病的研究中得出,肠道菌群构成平衡与否是肠道免疫系统的刺激因子,是人体重要的免疫屏障[7]。肠道菌群对免疫系统的作用体现在:一是肠道菌群与免疫系统间的“交互对话”机制,二是两者之间的作用存在“窗口期”,认为肠道黏膜上菌群定植在婴幼儿免疫系统的发育中具有“工具性”作用[7,11,14]。迄今,肠道菌群与呼吸系统疾病间的交互作用研究受到广泛关注,基于肠道菌群调节剂的辅助治疗反复呼吸道感染及免疫功能中的作用也逐渐得到证实[23-24],提示通过外界优化或干扰肠道菌群可作为防治儿童呼吸道系统疾病的有效措施。故可将探究呼吸道感染儿童肠道菌群生物学特征、肠道菌群变化与呼吸系统疾病间的关系及微生物制剂在呼吸道保护中的作用等作为进一步研究的目标方向,以期为儿童呼吸系统疾病的防治提供更多治疗途径。
综上所述,呼吸道感染患儿肠道菌群紊乱表现为肠道有益菌数量减少,致病菌数量增多;肠道菌群紊乱可能通过诱导机体Th17 /Treg 免疫失衡,调控炎性介质分泌,进而参与儿童呼吸道感染的发生发展。
