肝癌组织中lncRNA-PRR34-AS1的表达特性及其对肝癌细胞增殖、迁移的影响和潜在分子机制
2021-12-14王小林
魏 英,王小林
(榆林市第二医院a.肿瘤放疗科;b.普外科,陕西榆林 719000)
据《2020年全球癌症统计》,全球新增约905 677例新诊断肝癌病例和830 180 例肝癌死亡病例,肝癌所致死亡人数位居世界第三[1-2]。尽管在中国观察到肝癌的发病率和死亡率呈显著下降趋势,但庞大的人口基础和快速的人口增长仍然导致大量新的肝癌病例出现并呈上升趋势[3]。因此,有必要更好地了解肝癌发生和发展的分子机制,研发出有效的靶向治疗方法[4]。近年研究发现,原癌基因和抑癌基因的失调导致了肝癌的发生和发展,其中大多数集中在蛋白质编码基因上[5-6]。长链非编码RNA(long non-coding RNAs ,lncRNAs)被定义为长度大于200 nt 的非编码RNA,其通过表观遗传调控机制发挥其基因转录调控功能[7]。越来越多证据表明,lncRNAs 与多种病理、生理过程有关,在癌症中经常观察到lncRNA 的异常表达[8-10]。发现lncRNAs能够调节癌细胞增殖、凋亡、迁移、侵袭等恶性行为及上皮-间质转化和细胞耐药性[11-13]。PRR34-AS1 是最新发现的一种lncRNA,目前国内外对其报道有限,但最新研究在肝癌中发现其高表达,通过调节mRNA 介导参与了肝癌细胞的各种生物学行为过程,与肝癌发展关系密切,证明了PRR34-AS1 的原癌基因属性,为肝癌研究提供了新的生物靶标[14-15]。然而PRR34-AS1 在肝癌发生发展中的作用机制尚未完全明确且有关报道鲜少。因此,本研究拟进一步探究肝癌组织中PRR34-AS1 的表达特性及其对肝癌细胞的作用机制,以期为临床肝癌的研究攻克提供新的分子机制基础。
1 材料与方法
1.1 研究对象 人肝癌HepG2 细胞购于中国科学院上海细胞库,10ml/dl 胎牛血清RPMI-1640 培养液中加入青霉素100 IU/ml 和链霉素100 µg/ml,37 ℃,5ml/dl CO2孵育箱培养。收集2020年6月~12月于榆林市第二医院行手术治疗的30 例肝癌患者癌组织及其对应癌旁正常组织标本,所有入选病例术前未行放化疗治疗,组织均由手术获取,离体后快速行冰冻病理确认为肝细胞癌,后置于低温液氮中保存备用。
1.2 试剂及仪器 胎牛血清、链霉素、青霉素及RPMI-1640 培养液购自美国HyClone 公司;MTS反应液购自美国Corning 公司;酶标仪购自美国赛默飞公司;lipo2000 购自美国Invitrogen 公司;实时荧光定量PCR 试剂盒、PCR 仪、逆转录试剂盒、Trizol 试剂购自美国Promega 公司;酶标仪购自美国Bio Rad 公司;转染细胞所用的阴性对照siCTL无义序列及2 条干扰siRNA 序列及JAK1 3' UTRwt 野生型和JAK1 3' UTR-mut 突变型荧光质粒均由南京科佰生物科技有限公司设计合成;荧光素酶测定系统购自北京Promega 公司。
1.3 方法
1.3.1 细胞转染及分组: 取待测细胞培养至生长密度达80%~85%左右时参照Lipo 2000 试剂盒说明书操作进行细胞转染,置于37℃,5ml/dl CO2条件下常规培养48 h。细胞分组:转染阴性对照siCTL 无义序列的细胞设为siCTL 对照组;转染2条PRR34-AS1 干扰siRNA 序列细胞设为siRNAPRR34-AS1#1 组和siRNA-PRR34-AS1#2 组;转染2 条JAK1 干扰siRNA 细胞设为siRNA- JAK1#1组和siRNA- JAK1#2 组;共转染siRNA-PRR34-AS1+JAK1 细胞设为共转染组。
1.3.2 实时荧光定量PCR 实验(RT-qPCR): 使用primer 3 软 件(http://frodo.wi.mit.edu/primer3/) 设计特异性qPCR 引物;采用Trizol 试剂盒提取细胞总RNA,逆转录为cDNA,以此为模板配置PCR 反应体系,行RT-qPCR 反应。引物序列:PRR34-AS1上游:5’-AGAACGGAGCCGATGTTTCG-3’,下游:5’-TAACGCAGGCGGACGAATCT-3’;JAK1 上 游:5’-AATCTTCTGTATCAGCTCATGCTGACT-3’,下游:5’-CAGTTTTTACGGCTTCAGTTTACTT-3’;内参GAPDH 上游:5’-GAACGCGAAGCTTGTCATC AA-3’,下游:5’CTAAGCAGTTGCTCGTGCAG-3’。反应条件:95 ℃ 30 s,95 ℃ 10 s,72 ℃ 15 s,循环40 次。反应完成后,拷贝数据,采用2-△△Ct法计算各目的基因相对表达。
1.3.3 MTT 细胞增殖实验:取转染培养后对数生长期待测细胞以1×106/孔接种于96 孔板,每组设3 个生物复孔,37 ℃,5ml/dl CO2条件下孵育4 h,每孔加入100 μl MTS 反应溶液,常规继续培养2,24,48,72 h,在490 nm 处测量各孔吸光度(A值)。
1.3.4 划痕迁移实验 : 取培养贴壁后各组进行转染,到细胞生长至密度达90%时用枪头垂直于孔板背面在盘中央划痕,PBS 清洗细胞3 次,去除划下细胞,加入无血清培基液,37 ℃,5ml/dl CO2培养24 h 后拍照观察,实验重复3 次取平均值。
1.3.5 PRR34-AS1 靶基因预测:通过生物信息学数据库网站预测lncRNA PRR34-AS1 与JAK1 结合的基因位点,双荧光素酶报告基因实验验证两者靶向关系。
1.3.6 双荧光素酶报告基因实验:将细胞接种到6孔板,通过构建包含PRR34-AS1 基因位点在内的含有海肾荧光素酶报道质粒的JAK1 3’ UTR-wt 野生型和JAK1 3’UTR-mut 突变型荧光质粒,将其转染至肝癌细胞中,使用荧光素酶测定系统测量各组细胞荧光素酶活性,实验重复3 次取平均值。
1.3.7 细胞回补实验:取消化培养后各组细胞铺于96 孔板或6 孔板,37 ℃,5ml/dl CO2孵育贴壁后进行转染,将siCTL,siRNA-PRR34-AS1,siRNAJAK1,siRNA-PRR34-AS1+ JAK1 及siRNA-JAK1 + PRR34-AS1 分别转染至细胞中,每孔设3 个复孔;后按照细胞增殖实验、细胞划痕迁移实验步骤检测各组细胞增殖、迁移情况进行实验验证。
1.4 统计学分析 采用SPSS 25.0 进行数据分析,数据采用均数±标准差(±s)表示,两组间比较采用t检验;多组间比较采用one-way ANOVA 分析,组间比较采用LSD 检验;癌组织及对应癌旁组织中差异比较采用配对t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 肝癌组织中lncRNA PRR34-AS1 表达特征 30组临床肝癌组织中PRR34-AS1 表达显著高于临近正常组织(5.714±0.612 vs 2.981±0.572),差异有统计学意义(t=17.870,P=0.000);同时检索GEPIA数据库发现,相比于临近正常组织,肝癌组织中PRR34-AS1 显著高表达,具有表达水平越高预后越差的临床特征,见图1。提示PRR34-AS1 扮演原癌基因角色,可能参与肝癌的发生发展。
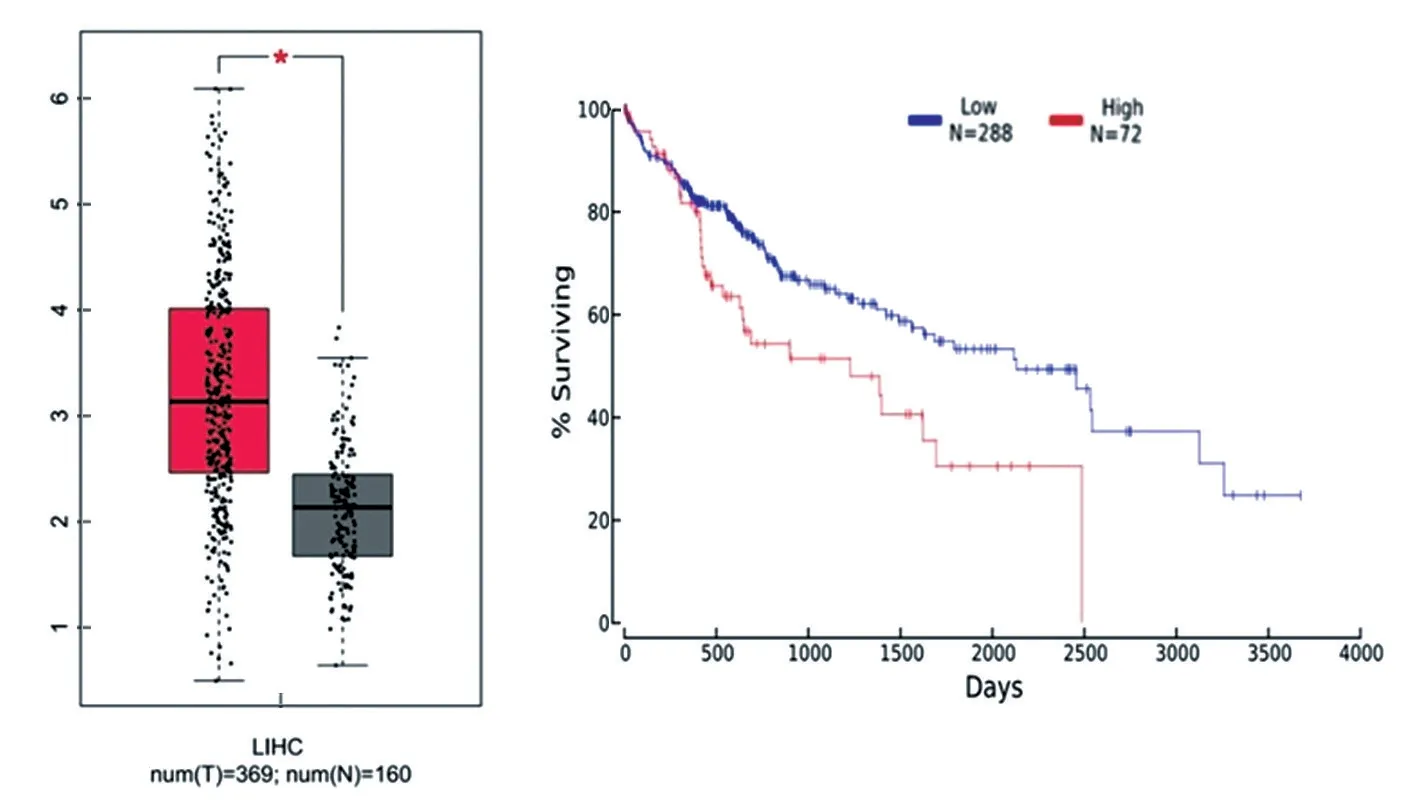
图1 GEPIA 数据库中分析PRR34-AS1 在肝癌中的表达特征
2.2 敲降PRR34-AS1 表达转染效率验证 检测发现siRNA-PRR34-AS1#1 组(0.289±0.046) 和siRNAPRR34-AS1#2 组(0.302±0.031)细胞中PRR34-AS1表达明显低于阴性对照siCTL 组(1.001±0.030),差异有统计学意义(F=375.552,P<0.001),提示敲降PRR34-AS1 表达转染效率验证成功。
2.3 PRR34-AS1 促进肝癌细胞的增殖和迁移 细胞增殖实验显示,随着转染时间延长,siRNA-PRR34-AS1#1 组和siRNA-PRR34-AS1#2 组细胞增殖率较对照组明显降低,差异有统计学意义(P<0.05),不同时间点各组细胞A值见表1。划痕迁移实验显示,siRNA-PRR34-AS1#1 组(38.451±4.263)和siRNAPRR34-AS1#2 组(42.106±3.512)细胞愈合迁移速率较对照组(83.247±6.205)显著减慢,差异有统计学意义(F=83.357,P<0.001),表明PRR34-AS1高表达促进了肝癌细胞的增殖和迁移,发挥致癌基因作用。
表1 敲低PRR34-AS1 表达对肝癌细胞A 值的影响(±s)

表1 敲低PRR34-AS1 表达对肝癌细胞A 值的影响(±s)
时间(h) siCTL 组① siRNA-PRR34-AS1#1 组② siRNA-PRR34-AS1#2 组③ F P ① vs ② ① vs ③t1 P1 t2 P2 0 0.189±0.012 0.196±0.009 0.193±0.011 0.321 0.737 0.808 >0.05 0.426 >0.05 24 0. 386±0.021 0.209±0.016 0.221±0.017 89.297 <0.001 11.958 <0.001 11.147 <0.001 48 0.537±0.027 0.334±0.019 0.347±0.015 88.378 <0.001 11.875 <0.001 11.115 <0.001 72 0.649±0.032 0.398±0.022 0.420±0.024 83.440 <0.001 11.664 <0.001 10.641 <0.001
2.4 PRR34-AS1 靶向正调控JAK1 表达,JAK1 促进肝癌细胞增殖 通过查阅文献发现,PRR34-AS1可通过调控JAK1 表达参与癌症的发展进程[16]。研究经检索生物信息学数据库发现JAK1 3’ UTR区含有潜在的PRR34-AS1 结合位点(见图2),推测JAK1 可能是PRR34-AS1 的靶基因。后将JAK1 3’ UTR质粒及siRNA-PRR34-AS1共转染至肝癌细胞中,双荧光素酶报告基因实验验证发现,转染siRNA-PRR34-AS1 显著抑制了JAK1 3’ UTR-wt 质粒荧光素酶活性(P<0.001),而对JAK1 3’ UTRmut 质粒荧光素酶活性无明显影响(P>0.05),见表2,证实JAK1 是PRR34-AS1 的靶基因。进一步探究发现,与对照组相比(1.002±0.003),siRNAPRR34-AS1#1 组(0.453±0.019)和siRNA-PRR34-AS1#2 组(0.476±0.022)细胞中JAK1 相对表达明显降低,差异有统计学意义(F=716.287,P<0.001),表明PRR34-AS1 靶向正调控JAK1 表达。同时经转染2 条siRNA 敲低肝癌细胞中JAK1 表达,发现较对照组相比,敲低JAK1 表达明显减缓了肝癌细胞的增殖速率(P<0.05),见表3,证明肝癌发生发展过程中JAK1 同样发挥促癌基因作用。
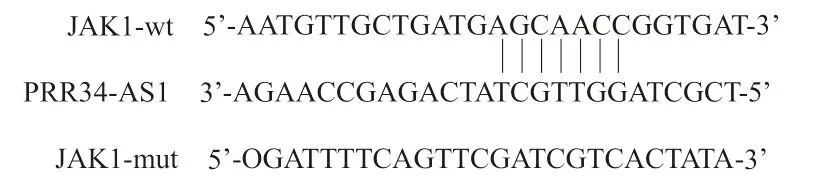
图2 生物信息网站预测PRR34-AS1 与JAK1 的结合位点
表2 PRR34-AS1 与JAK1 结合关系验证(±s)

表2 PRR34-AS1 与JAK1 结合关系验证(±s)
类别 siCTL 组 siRNA-PRR34-AS1 组 t P WT 1.002±0.005 0.437±0.021 45.333 <0.001 MUT 1.001±0.003 0.977±0.016 1.490 0.211
表3 敲低JAK1 表达对肝癌细胞A 值的影响(±s)
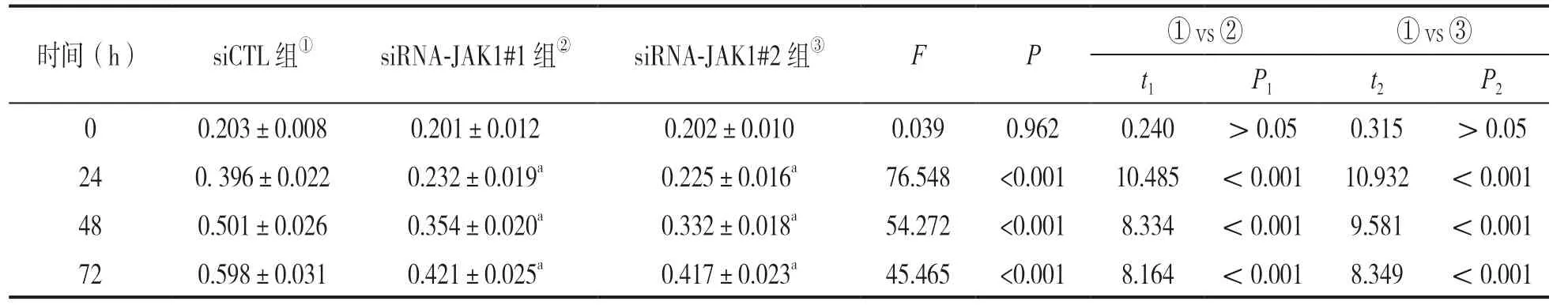
表3 敲低JAK1 表达对肝癌细胞A 值的影响(±s)
时间(h) siCTL 组① siRNA-JAK1#1 组② siRNA-JAK1#2 组③ F P ① vs ② ① vs ③t1 P1 t2 P2 0 0.203±0.008 0.201±0.012 0.202±0.010 0.039 0.962 0.240 >0.05 0.315 >0.05 24 0. 396±0.022 0.232±0.019a 0.225±0.016a 76.548 <0.001 10.485 <0.001 10.932 <0.001 48 0.501±0.026 0.354±0.020a 0.332±0.018a 54.272 <0.001 8.334 <0.001 9.581 <0.001 72 0.598±0.031 0.421±0.025a 0.417±0.023a 45.465 <0.001 8.164 <0.001 8.349 <0.001
2.5 JAK1 在肝癌组织中的表达及与PRR34-AS1 的相关性分析 30 组临床肝癌组织中JAK1 表达显著高于癌旁正常组织(5.963±1.214 vs 4.052±0.876),差异有统计学意义(t=6.992,P=0.000),肝癌组织中PRR34-AS1 与JAK1 表达呈显著正相关(r=0.907,P<0.05)。
2.6 PRR34-AS1 正向调控JAK1 促进肝癌细胞增殖和迁移 见表4。细胞回补试验验证发现,在敲低PRR34-AS1 表达的肝癌细胞中回补JAK1 后,肝癌细胞增殖、迁移速率又回归到正常水平。证实PRR34-AS1 可通过调控JAK1 来促进肝癌细胞的增殖和迁移。
表4 PRR34-AS1 调控JAK1 对肝癌细胞增殖、迁移的影响(±s)

表4 PRR34-AS1 调控JAK1 对肝癌细胞增殖、迁移的影响(±s)
注:t1 为① vs ②,t2 为① vs ③,t3 为① vs ④;细胞增殖A 值的t1=10.122,t2=9.252,t3=1.739,均P<0.001;细胞迁移率(%)的t1=8.100,t2=8.545,t3=0.683,均P<0.001。
类别 siCTL 组① siRNA-PRR34-AS1 组② siRNA-JAK1 组③ siRNA-PRR34-AS1+ JAK1 组④ F 值 P 值细胞增殖A 值 0.586±0.019 0.423±0.015a 0.437±0.023a 0.614±0.021 90.701 <0.001细胞迁移率(%) 82.154±5.896 48.213±3.988 a 46.347±4.305a 85.014±6.013 50.224 <0.001
3 讨论
肝癌作为临床常见的恶性肿瘤,早期症状不明显,临床诊断多为中晚期,手术治疗后5年生存率较低[1]。临床常采用肿瘤分化程度和淋巴结转移等传统病理特征来评估患者生存期,但其效果并不理想[3]。近年研究表明,lncRNAs 的异常表达与癌症的发生发展有关,发现其可以通过影响mRNA 的稳定性及翻译、蛋白质修饰过程,作为竞争性内源RNA 或mRNA 前体发挥功能,也可招募相关因子改变染色质结构影响基因表达,广泛参与疾病生理、病理过程[17-18]。如既往研究报道,PTENP1 可竞争性吸附miR-20a,miR-19b,减少其与3'UTR 结合,从而抑制肿瘤的发展[19];lncRNA CASC15 在肝癌中通过SOX4 /Wnt/β-catenin 信号通路促进肿瘤进展[20]。提示lncRNAs 与肝癌的发生发展密切相关,故积极探究更多特异性lncRNAs 对肝癌临床研究具有重要意义。
本研究前期通过检索GEPIA 数据库发现,除既往研究报道的lncRNAs 外,PRR34-AS1 在肝癌组织中也异常高表达。最新研究也表明,PRR34-AS1 通过吸附microRNA-498 可上调FOXO3 表达,加速肝细胞癌的发展进程[14]。PRR34-AS1 使miR-498 海绵化促进了TOMM20 和ITGA6 介导的肝癌进展[15],更加证实了其在肝癌发生发展中扮演重要角色。基于目前国内外关于PRR34-AS1 的研究报道有限,其调控肝癌发生发展的作用机制尚未探明且相关报道鲜少,故研究拟探究PRR34-AS1在肝癌中的表达,以及对肝癌细胞生物学行为的影响及潜在分子作用机制。首先,研究发现,肝癌组织中PRR34-AS1 显著高表达,同时检索GEPIA 数据库证实肝癌组织中PRR34-AS1 高表达且具有高表达预后差的临床特征,提示其可能扮演原癌基因角色发挥作用。通过转染siRNA 介导敲低PRR34-AS1 表达,经细胞实验探究发现,敲低PRR34-AS1 表达显著抑制了肝癌细胞的增殖、迁移速率,确定了其致癌基因属性,与既往研究相符。
近年研究表明,肿瘤的发生发展是一个多基因参与调控的极其复杂的过程,除癌基因的激活和抑癌基因的失活外,信号通路也参与其中[7]。JAK / STAT 信号通路是细胞因子信号传导的下游通路,研究发现其能调控细胞的分化、增殖及凋亡等过程,在肿瘤的发生发展、转移及耐药机制形成中起着重要作用[21]。Janus 激酶(JAK)属于非受体酪氨酸激酶家族,由JAK1,JAK2,JAK3 和TYK2 组成,可响应各种细胞因子和生长因子激活信号转导子和转录激活子(STAT)蛋白[22-23]。STAT 在包括肝细胞癌(HCC)、头颈癌、乳腺癌和肺癌等不同类型的人类癌症中异常激活,而JAK 是调控激活STAT酪氨酸激酶功能的主要因素,提示被激活的JAK1/STAT3 信号传导与肿瘤发生和癌症进展有关[24-26]。正常情况下,机体可通过JAK 和STAT 反馈调节模式来维持动态平衡状态;当机体发生病变时,JAK蛋白被激活后发生磷酸化,其信号传导途径被打开,导致STAT 蛋白中的酪氨酸残基被磷酸化形成同源二聚体,其与细胞核中的靶基因结合,从而进行调控表达[24,26]。另据相关报道,JAK/STAT 信号通路在正常细胞中受到严格调节,且由于癌细胞中JAK 家族激酶或其他酪氨酸激酶的异常激活而被持续激活[27]。而在JAK/STAT 家族成员中,JAK1/STAT3 在许多生物学过程(例如细胞生长、凋亡、迁移和侵袭)中起着至关重要的作用[28]。JAK1 刺激STAT3 磷酸化可促进细胞增殖、迁移、侵袭和血管生成[29-30]。相关研究也表明[31],JAK/STAT 信号通路在肝癌的发生发展中扮演着重要角色,抑制该通路则显著抑制了体内HCC 细胞的生长。本研究经查阅文献发现,PRR34-AS1 能够调控JAK1 基因表达,PRR34-AS1 过表达通过阻断JAK1 依赖的JAK/STAT 信号通路能够促进丙泊酚预处理对全膝关节置换术后小鼠缺血/再灌注损伤的保护[17],提示PRR34-AS1 发挥作用与JAK/STAT 通路间的紧密性。研究经荧光霉素实验证实PRR34-AS1 与JAK1 确实存在相互结合位点,JAK1 是PRR34-AS1 的靶基因,且探究发现,肝癌组织中JAK1 也显著高表达,与PRR34-AS1 呈显著正相关;同时JAK1 表达受PRR34-AS1 调控,敲低JAK1 表达明显抑制了肝癌细胞增殖速率;细胞回补实验证实,在敲低PRR34-AS1 表达的肝癌细胞中回补JAK1后肝癌细胞增殖、迁移速率恢复到正常水平,由此初步证明了PRR34-AS1 促进肝癌细胞增殖和迁移是通过正调控JAK1 表达来实现。然而癌基因参与调控肿瘤发生的机制及信号通路复杂,研究对PRR34-AS1 调控JAK/STAT 信号通路发挥作用参与肝癌发生发展的机制较表浅,因此后期还需通过体内体外试验进一步深入探讨两者间的调控作用关系,以期得出更精确结论用于临床指导。
综上所述,肝癌中PRR34-AS1 显著高表达,敲低PRR34-AS1 则显著抑制了肝癌细胞的增殖和迁移,其可能通过正向调控JAK1 表达影响JAK/STAT信号通路,进而发挥作用参与肝癌的恶性进展。
