UPLC-MS/MS 法用于大鼠血浆中20(S)-原人参二醇药动学研究
2021-12-13付信珍丁振李志谢则平张淑敏寇立娟
付信珍,丁振,李志,谢则平,张淑敏,寇立娟
滨州医学院药学院,山东 烟台 264003
人参皂苷是一种四环三萜类化合物,被视为是人参中的药理活性成分[1];按其结构可分为原人参二醇型、原人参三醇型和齐墩果酸型,其中,20(S)-原人参二醇[20(S)-PPD]是二醇型人参皂苷在动物体内经胃肠道微生物菌群代谢产生的活性最强的有效药物成分[2]。近年来,由于其在抗肿瘤、抗炎、抗氧化、保护神经系统与激活免疫系统方面发挥重要的药理作用,得到了研究学者的广泛关注[3-4]。创新药物研究发现,人参皂苷类药物的口服生物利用度低,在血浆中浓度较低,因此建立高灵敏度、高准确度的检测方法非常关键[5-6]。
目前,血浆中20(S)-PPD 提取处理常采用液液萃取法或固相萃取法[7-8]。这两种方法虽然能净化样品基质,但实验需要的有机溶剂用量大,且过程中涉及旋蒸和氮吹步骤,操作烦琐,容易造成目标物质的损失,往往需要大量的方法学验证实验。蛋白沉淀法可最大程度保留代谢物质,操作简单快速,对环境友好,已经广泛应用于药物代谢研究[9-10],如吴悦等[9]采用乙腈蛋白沉淀法提取血浆中阿帕替尼,结合液相色谱-串联质谱法(UPLC-MS/MS)实现了其药动学研究。然而,将蛋白沉淀法应用于血浆样品中20(S)-PPD 的分析鲜见有报道。
20(S)-PPD 的分析方法主要包括液相色谱法和液相色谱-串联质谱法[6,8]。与高效液相色谱法相比,液相色谱-串联质谱法由于分析速度快、选择性与专属性强、灵敏度高等优势,广泛应用于复杂样品基质中人参皂苷类化合物的分析。本研究采用蛋白沉淀法处理血浆样品,UPLC-MS/MS 法测定大鼠血浆中20(S)-PPD,并将此方法应用于大鼠灌胃20(S)-PPD 的药动学研究,为其创新药物研究提供技术支持。
1 材料
1.1 主要仪器
ACQUITY 超高效液相色谱仪(美国Waters公司);QTRAP 6500+三重四极杆质谱仪(美国SCIEX 公司);CHORUS 1 COMPLETE 型超纯水仪(英国ELGA 公司);MS105DU 型电子天平(瑞士Mettler Toledo 公司);SH8200H 型超声波清洗器(上海科导超声仪器有限公司);FRESCO 21 型高速冷冻离心机(美国Thermo 公司);TARGIN VX-Ⅱ型涡旋振荡器(北京踏锦科技有限公司)。
1.2 药物及主要试剂
原人参二醇(纯度≥96%,中国食品药品检定研究院);齐墩果酸(分析对照品,麦克林试剂公司);甲醇和乙腈(色谱纯,德国Merk 公司)。
1.3 实验动物
SPF 级SD 大鼠6 只,雄性,体质量范围180 g~220 g,购于济南朋悦实验动物繁育有限公司,生产许可证号SCXK(鲁)20190003。饲养环境室温20~26 ℃,日温差≤4 ℃,相对湿度40%~70%,明暗交替时间为12/12 h。
2 方法
2.1 标准溶液的配制
准确称取20(S)-PPD 和齐墩果酸标准物质,分别用色谱纯甲醇溶解并定容至10 mL,配制成浓度为1 mg/mL 的标准储备液。使用时以甲醇逐级稀释成系列浓度的标准工作溶液,现用现配。
2.2 血浆样品处理方法
取灌胃给药后大鼠血浆45 μL 于1.5 mL 尖底聚丙烯离心管内,然后加入浓度为2 μg/mL 内标物质齐墩果酸5 μL,准确加入0.05%甲酸/乙腈150 μL,涡旋震荡3 min,以4 ℃、10 000 r/min 离心10 min 后,取上清液供UPLC-MS/MS 分析。
2.3 UPLC-MS/MS 检测条件
色谱条件:色谱柱ACQUITY UPLC BEH C18(50 mm×2.1 mm,1.7 μm);流速:0.40 mL/min;流动相:水-乙腈(2∶8);柱温:35 ℃;进样量:10 μL。
质谱条件:电喷雾离子源,负离子扫描;离子源温度:500 ℃;喷雾电压:-4 500 V;气帘气流速:20 psi;雾化气流速:50 psi;脱溶剂气流速:50 psi;多反应监测(MRM)扫描;20(S)-PPD 及内标物质齐墩果酸多反应监测色谱-质谱分析参数见表1。
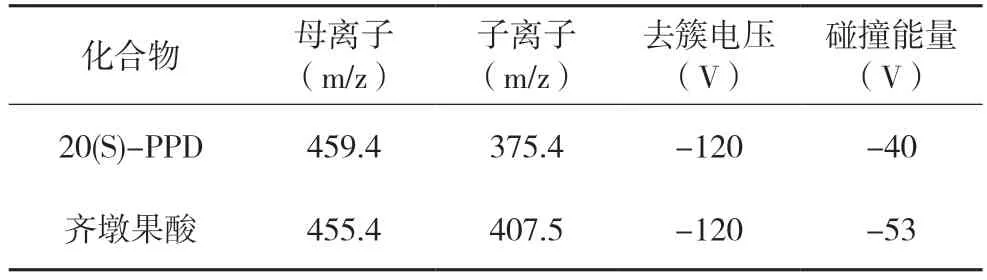
表1 20(S)-PPD及内标物质齐墩果酸的质谱分析参数
2.4 方法学验证
本实验参照《中国药典》2020 版第四部生物样品定量分析方法验证指导原则进行了方法学验证内容。
2.5 药动学研究
SPF 级SD 大鼠适应性喂养3 d~5 d。给药前夜禁食不禁水,给药后持续禁食。配制浓度为5.0 mg/mL 20(S)-PPD 水溶液(含0.3%乙醇),将上述溶液按35 mg/kg 的给药剂量灌胃至大鼠体内,于给药前和给药后5 min、15 min、30 min、45 min、1 h、2 h、4 h、8 h、12 h、24 h 于眼眶采血,采用肝素钠抗凝管收集血液约0.5 mL,采用3 000 r/min 离心10 min,收集血浆于-80 ℃保存待用。
上述大鼠血浆样品采用“2.2”方法进行处理,采用“2.3”方法检测20(S)-PPD 的含量,测定结果使用Phoenix WinNonlin(版本8.1)进行药代参数分析。
3 结果与讨论
3.1 样品前处理方法的优化
采用乙腈作为蛋白沉淀剂在血浆样品药物含量测定应用非常广泛,当乙腈-血浆(3∶1),可将血液中蛋白质去除完全。本实验中,当采用乙腈作为蛋白沉淀剂时,内标物质齐墩果酸峰形状差,无法实现准确定量分析;考察了含0.05%和0.1%甲酸/乙腈作为蛋白沉淀剂对20(S)-PPD 和内标物齐墩果酸的影响,结果见图1。结果表明,当含0.1%甲酸/乙腈溶液作蛋白沉淀剂时,虽然内标物质齐墩果酸峰形尖锐,质谱响应信号增大,但20(S)-PPD的质谱响应信号明显降低,仅为含0.05%甲酸/乙腈作蛋白沉淀剂时质谱信号的20%左右。综合考虑,选择含0.05%甲酸/乙腈作为蛋白沉淀剂和样品提取剂。
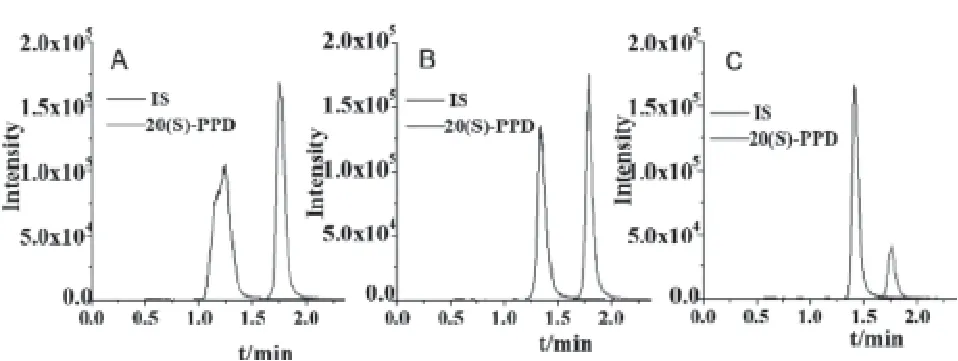
图1 提取溶剂对20(S)-PPD和内标物质的质谱响应影响:A.乙腈;B.0.05%甲酸/乙腈;C.0.1%甲酸/乙腈
3.2 色谱分离条件的选择
考察了水/乙腈、甲酸/乙腈和乙酸铵/乙腈作为流动相对20(S)-PPD 和齐墩果酸的色谱分离及质谱响应影响,结果见图2。由图可知,当采用0.1%甲酸-乙腈(20∶80)和1 mmol/L 乙酸铵-乙腈(20∶80)作为流动相时,20(S)-PPD 和齐墩果酸的质谱响应信号明显降低,考虑到方法灵敏度,选择水/乙腈体系作为流动相体系。
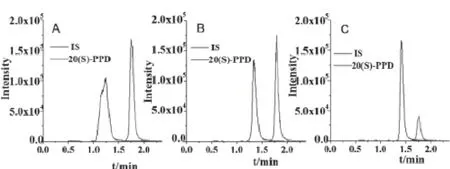
图2 流动相对20(S)-PPD和内标物质的质谱响应影响:A.水/乙腈;B.0.1%甲酸/乙腈;C.1 mmol/L乙酸铵/乙腈
3.3 方法学考察
3.3.1 专属性取6 批次空白大鼠血浆50 μL 除不加内标物质外,其余按“2.2”方法进行处理;另取空白大鼠血浆45 μL,加入20(S)-PPD 和内标物质浓度同为2 μg/mL 的标准溶液5 μL,另取大鼠给药后的血浆样品50 μL,按“2.2”方法进行处理;处理后血浆按“2.3”方法进行分析。大鼠给药后血浆样品中20(S)-PPD 和内标物质分离良好,出峰情况和加标样品一致,且空白大鼠血浆样品中内源性物质不干扰代谢物质测定,方法选择性和专属性好。
3.3.2 线性范围及定量下限分别精密量取空白大鼠血浆45 μL,加入5 μL 20(S)-PPD 和齐墩果酸的混合溶液,配制20(S)-PPD 浓度为1、2.5、5、10、25、50、100、250、500、1 000 和2 500 ng/mL的血浆样品,内标物浓度均为200 ng/mL。结果表明,20(S)-PPD 在1~2 500 ng/mL 的浓度范围内呈现良好线性(r≥0.998),按信噪比S/N=10 计算,血浆中最低定量下限为0.5 ng/mL,方法灵敏度高、线性范围宽,可以满足20(S)-PPD 药物研发、临床检测等需要。
3.3.3 准确度及精密度本研究配制高浓度质控样品(HQC)、中浓度质控样品(MQC)、低浓度质控样品(LQC)及定量下限(LLOQ)4 个浓度的血浆样品,进行准确度和精密度实验(n=5)。批间精密度实验时,2 天内进行上述实验3 批次,计算n=15 的精密度。分析结果见表2,血浆中20(S)-PPD 的批内批间准确度在±12.2%以内,批内与批间精密度≤15%,方法准确度高、精密度好,符合分析方法的要求。
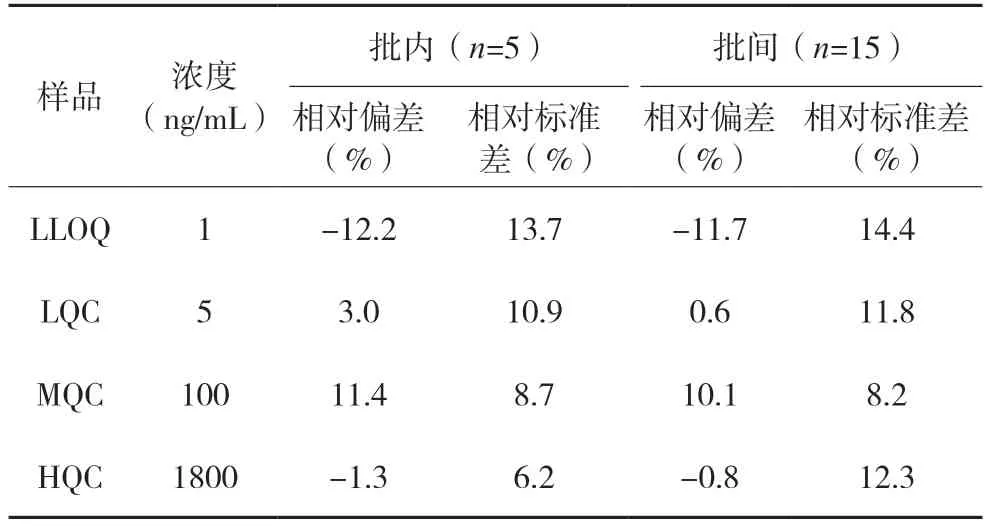
表2 大鼠血浆样品中20(S)-PPD分析方法的准确度和精密度
3.3.4 基质效应和提取回收率将大鼠空白血浆样品按“2.2”方法(不加内标)进行提取处理后得到基质空白,然后取上述基质空白45 μL,加入5 μL 20(S)-PPD 及内标物质溶液,配制高、中、低浓度质控样品,再加150 μL 基质空白,涡旋后离心,进样分析,记录峰面积为A;甲醇溶液配制相同高、中、低浓度对照样品,再加150 μL 乙腈,涡旋进样分析,记录峰面积为B;通过二者峰面积比观察是否有基质效应,结果见表3。大鼠血浆基质中20(S)-PPD经样品前处理后,基质效应在87.3%~104.8%内,内标归一化的基质因子的变异系数CV 小于3.6%,可以满足分析需求。
取大鼠空白血浆45 μL,加入5 μL 20(S)-PPD和齐墩果酸的混合溶液,配制高、中、低浓度质控样品,然后按照“2.2”方法进行处理,进样分析,记录峰面积为C。通过C/A 计算方法提取回收率。表3 结果可知,提取回收率在84.8%~94.1%,精密度均小于10.4%,满足分析方法需求。
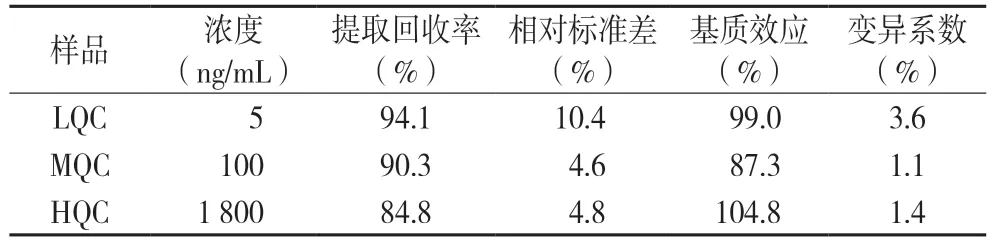
表3 大鼠血浆样品中20(S)-PPD的回收率与基质效应
3.3.5 样品稳定性取大鼠空白血浆45 μL,加入5 μL 20(S)-PPD 和齐墩果酸的混合溶液,配制高、低浓度质控样品,考察了血浆样品室温放置4 h 后提取处理,10 ℃自动进样器放置24 h 及两周内三次冻融循环后20(S)-PPD 的稳定性。从表4 可以看出,经上述条件存放后,20(S)-PPD 和内标物质的稳定性在±14.3%以内,精密度在8.7%以内,可以满足分析需要。

表4 大鼠血浆样品中20(S)-PPD稳定性结果
3.3.6 稀释效应样品测定时有的样品浓度会超出方法的线性范围,需对样品进行稀释再测定。本方法配制了5 000 ng/mL 和10 000 ng/mL 的血浆样品,考察了血浆样品稀释后的稳定性结果表明,高浓度样品稀释5 倍和10 倍后,样品稳定性良好,准确度在97.4%~99.1%之间,符合方法学要求。
3.4 药动学研究
20(S)-PPD 血药浓度随时间变化曲线如图3所示,药代动力学参数采用非房室模型进行计算。大鼠灌胃给药后,血浆中20(S)-PPD 的Cmax、tmax、t1/2和AUC0-∞分别为3 520 ng/mL、2 h、10.65 h和21 760 ng·mL-1·h-1。
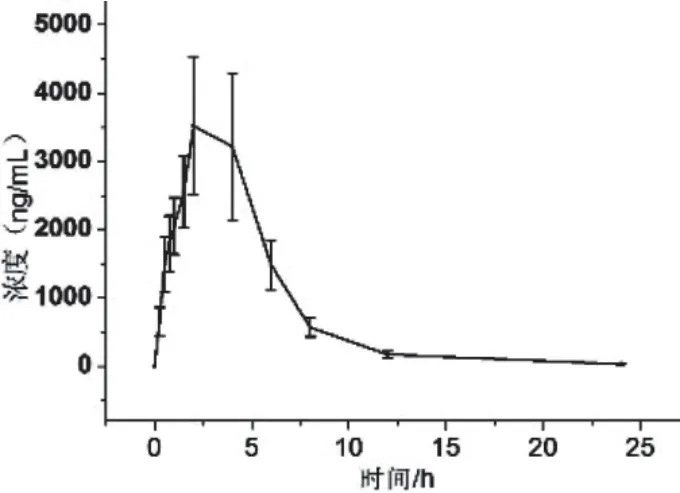
图3 灌胃20(S)-PPD后大鼠血浆中20(S)-PPD的血药浓度-时间曲线
4 结论
本研究系统考察了血浆样品中20(S)-PPD 前处理方法与检测条件,结果表明本方法操作简单、线性范围宽、定量限低,准确度及精密度好,提取回收率高,基质效应较小,满足血浆样品基质中20(S)-PPD 的定性定量分析需求;利用建立的分析方法成功应用于20(S)-原人参二醇在大鼠体内的代谢动力学评价研究,结果表明20(S)-PPD在大鼠体内的吸收、消除较快,从而为20(S)-原人参二醇药物研发及临床用药研究提供理论基础与技术支持。
