参芎葡萄糖注射液抗H9c2细胞凋亡的机制*
2021-12-13吴忠秀陆定艳杨畅何彬李勇军王永林刘亭
吴忠秀,陆定艳,杨畅,何彬,李勇军,王永林,刘亭**
(1.贵州医科大学 贵州省药物制剂重点实验室 &省部共建药用植物功效与利用国家重点实验室,贵州 贵阳 550004;2.贵州医科大学 药学院,贵州 贵阳 550004;3.贵州医科大学 民族药与中药开发应用教育部工程研究中心 &省部共建药用植物功效与利用国家重点实验室,贵州 贵阳 550004)
随着人们生活水平的改变以及不均衡膳食营养的摄入,心血管系统疾病如高血压、高血脂、冠心病、心绞痛及动脉粥样硬化等发病率逐年上升,严重影响人们的健康以及生活质量,同时这也是导致中老年人死亡的原因之一[1-2]。因此,心血管系统疾病的预防、治疗和诊断至关重要。有研究表明,氧化应激会导致动脉粥样硬化、心绞痛、急性心肌梗死等一系列心血管疾病[3],而心肌细胞凋亡是心肌细胞氧化损伤的重要表现形式之一,所以预防或治疗心血管疾病的关键是抗细胞凋亡[4-5]。参芎葡萄糖注射液(shenxiong glucose injection,SGI)是由丹参提取物和盐酸川芎嗪组成的注射液,收载于卫生部药品标准[6],其具有较强的抗氧化应激和抗凋亡作用[7-8],主要含有丹参素、原儿茶醛、咖啡酸、盐酸川芎嗪、丹酚酸D、迷迭香酸、丹酚酸A、丹酚酸B、丹酚酸I/H、紫草酸、丹酚酸C以及Genipin 12种已知成分,及一种未知成分[9],在临床上,SGI对冠心病、心绞痛、脑梗死等闭塞性脑血管病及其它缺血性心血管疾病的防治具有确切疗效,且无明显毒副作用[9-10]。但迄今为止,SGI抗细胞凋亡的作用机制仍不清楚。本文拟采用网络药理学技术预测SGI抗细胞凋亡的作用靶点,并构建过氧化氢(hydrogen peroxide,H2O2)诱导H9c2细胞凋亡模型验证SGI拮抗H2O2诱导H9c2细胞凋亡的相关机制,为SGI的进一步深入开发提供实验基础。
1 材料与方法
1.1 材料
1.1.1细胞与实验试剂 H9c2大鼠心肌细胞株由中科院上海细胞库提供。参芎葡萄糖注射液(批号H52020703,500 mL/瓶)购自贵州景峰注射剂有限公司,H2O2(批号20140803,GR,国药集团化学试剂有限公司),DMEM高糖培养基(批号8128032)、胎牛血清(FBS,批号1237698)、胰蛋白酶(批号J130089)均购自Gibco公司,青霉素-链霉素(批号15140-122)、RIPA细胞裂解液(含PMSF蛋白酶抑制剂,批号20141219)、磷酸盐缓冲液(PBS粉末,自配)、BCA蛋白浓度测定试剂盒(批号20140722)均购自Solarbio公司,JC-1线粒体膜电位检测试剂盒(批号20150314)购自美国Sigma公司,兔抗Cyt-c多抗(批号AC63325)、辣根过氧化物酶标记山羊抗兔IgG (批号AB01151)购自巴傲得生物科技有限公司。
1.1.2实验仪器 CO2细胞培养箱(Thermo scientific公司),TS100倒置显微镜(Nikon公司)、Allegra 64R冷冻高速离心机(美国Beckman),Model 680酶标仪、BD FACSCanto II流式细胞仪(美国BD公司),ChemiDoc XRS+凝胶成像仪(美国Bio-Rad公司)。
1.2 实验方法
1.2.1SGI作用靶点信息获取 利用中药系统药理学平台(traditional Chinese medicine systems pharmacology platform,TCMSP),选择CAS搜索框,输入SGI的丹参素、原儿茶醛、咖啡酸、丹酚酸D、迷迭香酸、丹酚酸A、丹酚酸C、Genipin的CAS号检索相关靶点;在SwissTarget Prediction数据库的检索框中输入盐酸川芎嗪、丹酚酸B、紫草酸和丹酚酸I/H的SMILES格式检索靶点。见表1。
1.2.2京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集和基因本体(gene ontology,GO)功能注释 运用DAVID数据库(database for annotation,visualizationand integrated discovery,DAVID)平台进行GO功能注释和KEGG的通路富集分析,再通过Hiplot科研数据可视化平台进行数据柱状图可视化。见表1。

表1 数据分析数据库(软件)及对应的网址Tab.1 Data analysis database/software and corresponding websites
1.2.3SGI预处理对H2O2诱导的H9c2细胞线粒体膜电位(mitochondrial membrane potential,MMP)的影响 取对数生长期的H9c2细胞,用含完全培养基将细胞密度调整为10×104个/mL于100 mm培养皿中,每皿10 mL,在37 ℃、5% CO2培养箱中培养40 h。将细胞分为Con组、H2O2组以及SGI(低、中、高)浓度组(以主要成分盐酸川芎嗪为浓度计量,浓度分别为100、200、400 μmol/L),先用PBS 4 mL洗两次,Con组和H2O2组加入完全培养基,SGI低、中、高浓度组分别加入含有100、200、400 μmol/L SGI的完全培养基,各组于37 ℃、5% CO2培养箱中培养6 h后,吸出药液,用DMEM无血清培养基4 mL洗涤细胞2次。Con组加入10 mL无血清DMEM培养基,SGI组和H2O2组和中每孔加入H2O2浓度为300 μmol/L的无血清培养基,孵育0.5 h,PBS 4 mL 洗2次,胰蛋白酶消化液1 mL消化1 min,再加入完全培养基5 mL重悬细胞,收集细胞待用;按照线粒体膜电位检测试剂盒说明书标记细胞,处理后待机上样,利用流式细胞术检测细胞内MMP的变化。
1.2.4SGI预处理对H2O2诱导的H9c2细胞内细胞色素C(cytochrome C,Cyt-c)的含量影响 取对数生长期的H9c2细胞,用含完全培养基将细胞密度调整为10×104个/mL于100 mm培养皿中,每皿10 mL,在37 ℃、5%CO2培养箱中培养40 h。依据“1.2.3”给药方法处理细胞,吸出液体,取PBS 4 mL 缓冲液润洗2遍,加入RIPA细胞裂解液200 μL(含1%PMSF),冰上裂解至黏稠状,转移至1.5 mL离心管中,涡混30 s,冰上静止5 min,重复该步骤1~2次,将裂解液在4 ℃离心机离心10 min,转速为12 000 r/min得到总蛋白,取少量用于测定蛋白质浓度,剩余的加入6×Buffer煮沸变性,Western blot实验检测Cyt-c表达情况。
1.3 统计学处理
采用SPSS 13.0软件进行数据的分析处理,组间差异比较采用单因素方差分析(One-WayANOVA),两组间比较用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 SGI作用靶点信息获取
以SGI的12个成分为关键词进行检索得到相关靶点142个,其中丹参素20个、原儿茶醛9个、咖啡酸9个、丹酚酸D 2个、丹酚酸A 34个、丹酚酸C 1个、Genipin 9个、盐酸川芎嗪13个、丹酚酸B 15个、紫草酸15个和丹酚酸I/H 15个,主要包含丝裂原活化蛋白激酶(mitogen-activated protein kinase 1,MAPK1)、胱氨酸的天冬氨酸蛋白水解酶3(cysteinyl aspartate specific proteinase 3,Caspase-3)、蛋白激酶1 (protein kinase 1,Akt1)等。
2.2 KEGG通路富集
运用DAVID平台进行KEGG通路富集分析结果显示,KEGG通路富集到90条信号通路,其中MAPK信号通路、PI3K-AKT信号通路和p53信号通路与Cyt-c的释放密切相关。
2.3 GO功能注释
运用DAVID平台进行GO功能注释结果显示,富集到生物过程(biological process,BP)409条、细胞组分(cellular component,CC)59条以及分子功能(molecular function,MF)67条,其中主要富集的线粒体、线粒体外膜以及细胞外信号调节蛋白激酶(extracellular signal regulated protein kinase1/2,ERK1/2)信号通路的激活等,均与MMP调节和Cyt-c释放紧密相关。
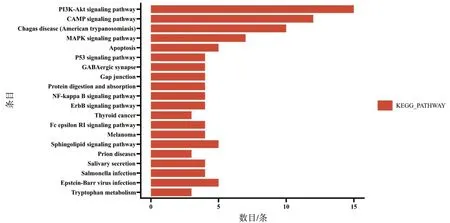
图1 SGI相关靶点KEGG通路富集Fig.1 Enrichment of KEGG pathway related targets of SGI
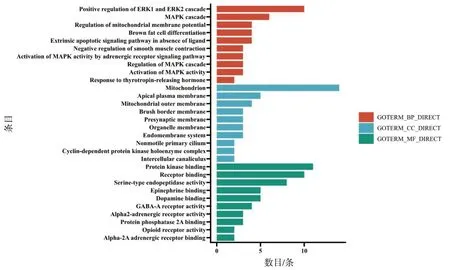
图2 SGI相关靶点GO功能分析Fig.2 GO function analysis of related targets of SGI
2.4 SGI预处理对H2O2诱导H9c2 MMP的影响
与Con组MMP荧光强度(21 059±1 237)比较,H2O2组H9c2细胞内MMP荧光强度为(5 298±457),明显降低(P<0.001);与H2O2组比较,SGI组低、中、高浓度组H9c2细胞MMP的荧光强度明显升高(P<0.001),荧光强度分别为10 087±957、14 962±1 420、18 680±1 045。由此可见,H2O2损伤H9c2细胞MMP荧光强度显著降低,而SGI低、中、高组均能够明显抑制H2O2诱导的H9c2细胞MMP的降低。见图3。
2.5 SGI预处理对H2O2诱导的H9c2细胞中Cyt-c的影响
与Con组比较,H2O2组H9c2细胞中Cyt-c蛋白表达明显升高(P<0.001);与H2O2组比较,SGI低、中、高浓度组Cyt-c蛋白表达明显降低(P<0.001)。见图4。
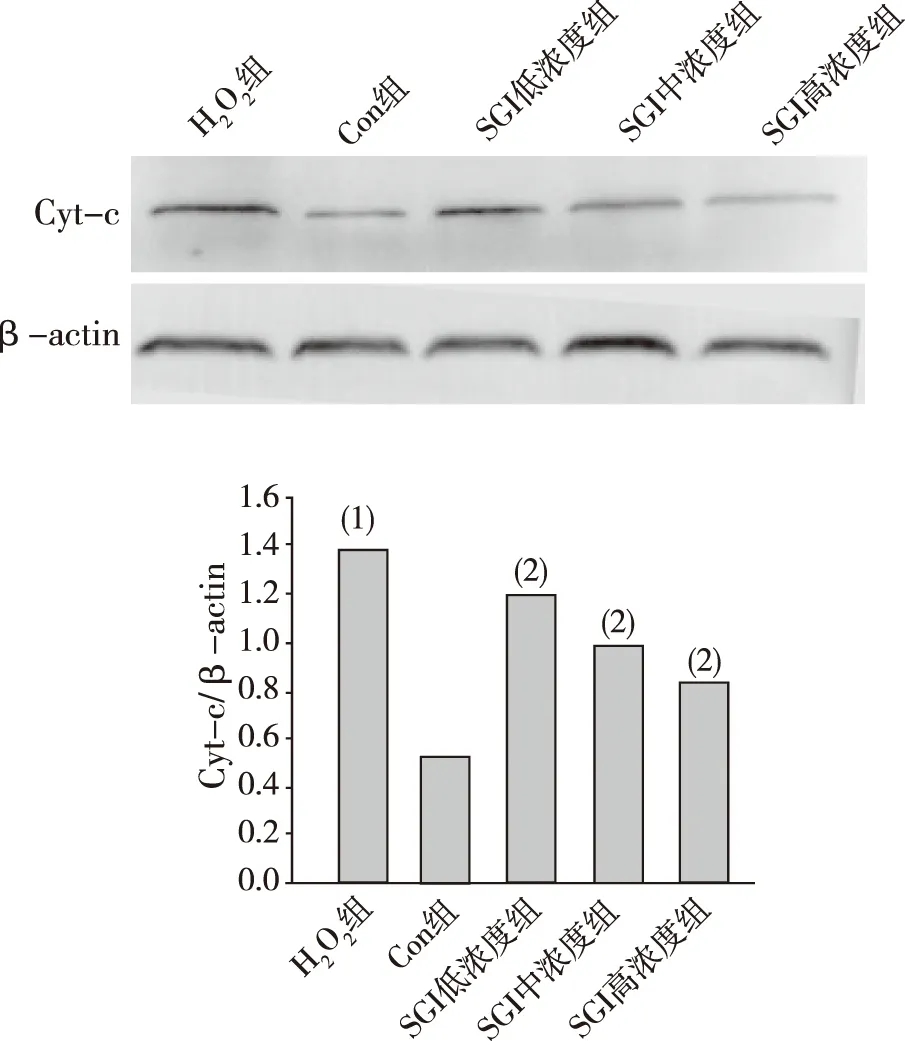
注:(1)与Con组比较,P<0.001;(2)与H2O2组比较,P<0.001。图4 SGI对H2O2诱导H9c2细胞Cyt-c蛋白表达的影响Fig.4 Effect of SGI on Cyt-c protein expression in H9c2 cells induced by H2O2
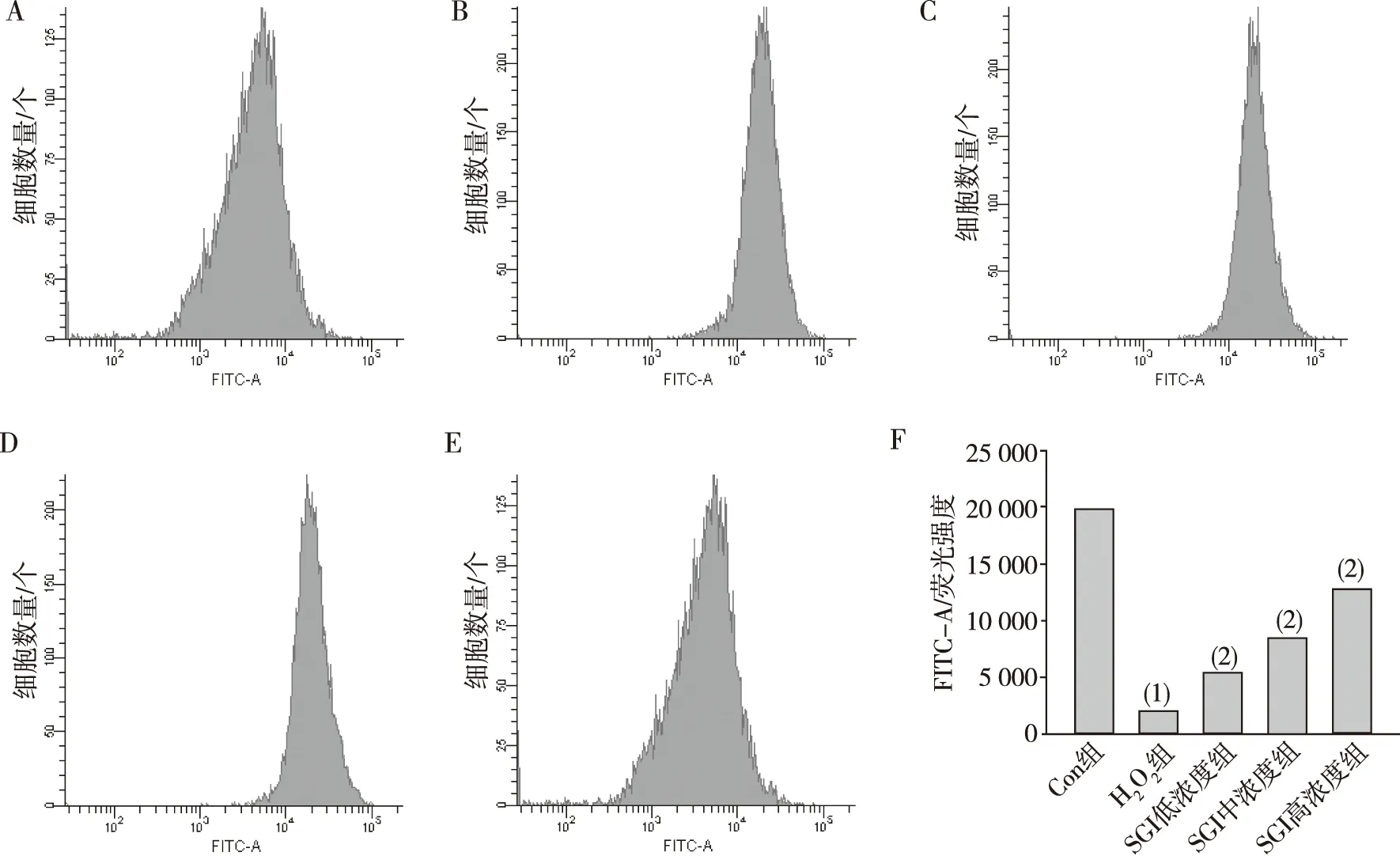
注:A为Con组,B为H2O2组,C为SGI低浓度组,D为SGI中浓度组,E为SGI高浓度组,F为结果统计;(1)与Con组比较,P<0.001;(2)与H2O2组比较,P<0.001。图3 SGI对H2O2诱导H9c2细胞MMP的影响Fig.3 The effect of SGI on MMP in H9c2 cells induced by H2O2
3 讨论
细胞凋亡是一种细胞自主的程序性死亡,受基因的调控,在细胞和机体的生长、繁殖和发育中起着关键作用,同时也与人类的重大疾病相关[5]。有研究表明心肌梗死、缺血性心脏病、再灌注损伤等各种心血管系统疾病与细胞凋亡密切相关[11],其中氧化应激在心肌细胞凋亡中起重要作用。当氧化与抗氧化平衡倾向氧化作用时,会产生大量活性氧自由基(reactive oxygen species,ROS),如H2O2会刺激线粒体释放Cyt-c,从而导致心肌细胞凋亡[12-13]。因此抗心肌细胞凋亡是治疗心血管系统疾病主要途径之一。
心肌细胞凋亡途径主要包括死亡受体途径、线粒体途径[5,14]和内质网途径[15]。有研究发现在病理状态下,线粒体通透性转换孔(mitochondrial permeability transition pore,MPTP)大量开放,而MPTP与MMP的稳定、凋亡蛋白的释放等密切相关[16-17],它的非特异性开放会导致线粒体受损以及Cyt-c释放,从而激活含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)级联反应,导致细胞凋亡和促凋亡因子的释放,进而导致细胞凋亡或坏死[18-19]。MAPK信号通路主要由3条并行信号通路组成,分别是线粒体外膜以及细胞外信号调节蛋白激酶(extracellular signal regulated protein kinase,ERK)通路、c-Jun N-末端激酶(c-Jun N-terminal protein kinase,JNK)通路和p38通路[20]。JNK和p38在各种细胞应激因子的刺激下被磷酸化激活,在诱导促凋亡蛋白Bax表达的同时抑制抗凋亡蛋白Bcl-2表达,从而导致Bax介导的线粒体凋亡途径;而ERK1/2的激活不但可以上调Bcl-2等抗凋亡蛋白的表达[21],还能减少Cyt-c从线粒体释放到胞质从而抑制心肌细胞凋亡的发生[22-24]。PI3K-AKT信号通路在细胞的增殖和凋亡中起着重要作用,AKT磷酸化后可调控Bcl-2、Bax以及Cyt-c等的表达,从而发挥抗细胞凋亡的作用[25-26]。本研究对SGI的12个成分进行KEGG通路富集后,发现SGI与MAPK信号通路、PI3K-AKT信号通路密切相关;GO功能注释结果显示,SGI主要富集在线粒体、线粒体膜电位调节等,与MMP调节和Cyt-c的释放密切相关[3,11],同时SGI的靶点MAPK1、Caspase-3、Akt1等也与线粒体有关[27-29]。本实验研究发现,与模型组比较,SGI低、中、高浓度组均能显著升高H9c2细胞的MMP和明显下调Cyt-c的表达,这与网络药理学的分析一致,提示SGI可能是通过线粒体途径抑制心肌细胞凋亡从而发挥治疗疾病的作用。
综上所述,SGI可通过上调MMP和降低Cyt-c的释放调控线粒体途径,从而产生抗心肌细胞凋亡的作用,但其具体机制还有待进一步研究。
