生物絮团系统中温度突变对日本囊对虾肠道和水体微生物多样性的影响
2021-12-09秦海鹏廖栩峥胡世康孙成波
秦海鹏,王 博,廖栩峥,胡世康,孙成波
(广东海洋大学水产学院,广东湛江 524088)
0 引言
日本囊对虾(Marsupenaeus Japonicus)是中国重要的虾类养殖品种[1-2]。目前日本囊对虾的养殖主要以池塘养殖为主,养殖密度偏低,同时,又受底质选择[3]、病害频发[4]、同类相残[5]等因素的影响,养殖难度加大。生物絮凝技术(Bio-flocs technology,BFT)是一项有效降低饲料系数、提高养殖成活率并减少养殖尾水排放,解决当前水产养殖业饲料成本高昂和环境污染严重等问题的有效替代技术[6]。随着生物絮团技术成为了中国水产养殖技术研究的热点,生物絮团相关的研究逐渐广泛开展。环境微生物群落对水生动物肠道菌群结构的形成有重要的影响[7-8]。环境微生物对虾肠道内存在演替规律[9-10]。目前的研究表明,长毛对虾(Fenneropenaeus penicillatus)、凡 纳 滨 对 虾(Litopenaeus vannamei)肠道菌群的结构受到水环境微生物群落的影响[11-13]。外界环境影响了生物絮团菌群的分类学特征及其功能[14],水生环境可以影响微生物群落的组成和丰度[15],温度是影响活性污泥系统脱氮除磷效果的关键因素之一,环境温度对于氮磷的去除效果有重要影响[16-17]。硝化、反硝化细菌对环境的适宜温度存在差异[18-19]。微生物有其最适宜的生长温度,当温度高于或低于该温度均会影响其活性,从而影响脱氮除磷效果及其稳定性。本实验针对温度突变条件下水质和微生物多样性的变化情况,探索生物絮团协同面临温度突变胁迫时的生物絮团系统的功能和结构的变化,以期为日本囊对虾的生物絮团系统养殖提供一定的数据参考。
1 材料与方法
1.1 实验材料
实验在水体体积250 L的蓝色塑料桶中进行,生物絮团用15 μm的筛绢网从盐度(28.0±0.7)‰水体的养殖池中捞取。日本囊对虾取自广东海洋大学水产学院东海岛海洋生物研究基地,为同一批虾苗培养而成,虾体色正常,表观健康无病,体长为9.20±0.04 cm、体质量为9.53±0.71 g,实验前暂养1周。
1.2 实验设计
实验将日本囊对虾随机分为2个处理组,每组3个平行,实验对虾密度为250尾/m3,对照组为经过消毒的洁净海水,日换水量20%(半封闭养殖系统),实验组为初始量20 mL/L的生物絮团海水(生物絮团系统),实验周期35天。在第30天(实验组与对照组水质保持1周的稳定后)实验组与对照组进行温度突变胁迫,温度骤升10℃。实验过程中24 h连续充气。本实验选取实验第26天至35天之间的情况进行分析(设定为第1天至第10天)。投喂人工配合饲料(粤海牌对虾饲料3#料),每天定时投喂(4餐/天),日投喂量为体质量的5%~7%。
1.3 水样收集
在实验期间,每天测定氨氮,亚硝酸氮和硝酸氮等水体指标,水质分析的水样利用真空压力通过0.45 μm GF/C滤纸过滤得到。
1.4 微生物样品采集
在实验温度突变点(第5天)和突变后(第10天)喂食后,从3个平行组分别随机选择5只虾。在解剖之前,用无菌水和75%乙醇洗涤虾的体表,将肠分离并置于干冰上的1.5 mL离心管中,并在DNA提取前立即储存在-80℃冰箱中。通过0.45 μm膜滤器收集生物絮团样品,并立即储存在-80℃冰箱中,然后进行分析,水体微生物样品分别编号为Qa(突变前对照组)、Qb(突变前实验组)、Ha(突变后对照组)和Hb(突变后实验组)肠道样本分别编号为a(突变前对照组)、b(突变前实验组)、A(突变后对照组)和B(突变后实验组)。
总基因组DNA从取得的微生物样品中提取。通过使用特异性引物扩增16S rRNA基因的V4区:515F(5′-GTGCCAGCMGCCGCGGTAA-3′) 和 806R(5′-GGACTACH VGGGTWTCTAAT-3′)。 将 320~350 bp的PCR产物进行再循环以构建扩增子文库,然后在Illumina Miseq平台测序。
1.5 序列数据分析
根据Barcode序列和PCR扩增序列从得到的数据中进行分析,对样品的reads进行拼接和过滤操作,得到高质量的Clean Tags。基于Clean Tags进行操作分类 单 元 (Operational Taxonomic Units,OTUs)聚 类[20]。由OTUs的聚类结果,对每个OTU的特征序列进行物种注释,从而得到相应的物种注释信息和丰度情况。同时,对OTUs进行丰度、Alpha多样性分析等,用来获取样品的物种丰富度和均匀度信息、不同的样品、分组之间的相同和独有的OTUs信息等[21-22]。
1.6 水质测定方法与数据分析
氨氮,亚硝酸氮和硝酸氮的质量浓度由《养殖水环境化学实验》中的方法测定[23]。实验数据使用Graphpad Prism 8.0软件进行作图和分析,SPSS 19.0进行显著性差异分析。
2 结果与分析
2.1 生物絮团系统养殖过程中的氮转化
氨氮、亚硝酸氮和硝酸氮在温度突变前后的转化过程如图所示。实验第1天至第5天温度为20.80±0.53℃,第6天至第10天温度为30.02±0.71℃。温度突变对水体中氮转化通路无显著影响。对照组与实验组的氨氮浓度在温度突变前后均维持在极低水平,突变前后氨氮水平无差异,亚硝酸氮浓度在实验组和对照组突变前后无差异,在实验组保持极低水平。实验组的硝酸氮在温度突变后有上升的趋势,温度突变实验第5天(突变前)为19.65 mg/L到实验第10天(突变后)升高到31.54 mg/L,实验组的累计速率大于对照组。
2.2 水体菌群丰度和多样性
利用16S rRNA基因V3+V4区域进行Illumina测序,在水体微生物中获得了4219个OTU,肠道微生物中获得了3698个OTU,突变前水体和肠道微生物中得到4431个OTU,其中从水体微生物中获得2953个OTU,突变后水体和肠道微生物中得到4406个OTU,其中从水体微生物中获得3273个OTU。实验采用Ace指数、Chao1指数和Observed OTUs计算了基于OTU的菌群丰度指数信息,并采用Shannon指数和Simpson指数来评估菌群多样性指数,实验组的Ace指数、Chao1指数、Observed OTUs、Shannon指数和Simpson指数的丰度与多样性均大于对照组,温度突变前水体和肠道的Ace指数、Chao1指数、Observed OTUs、Shannon指数和Simpson指数的丰度与多样性大于突变后。
2.3 温度突变前后的水体菌群组成差异
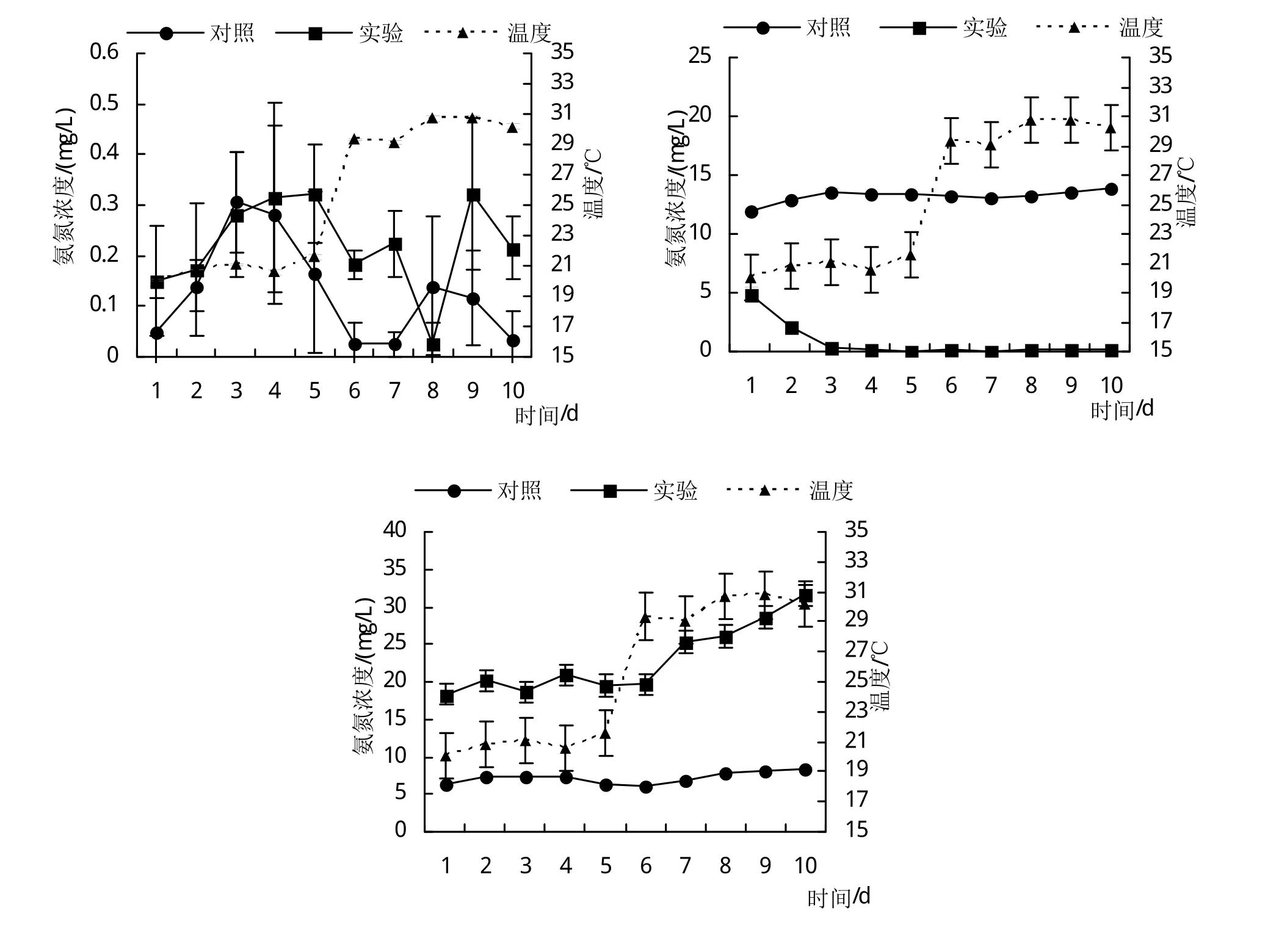
图1 生物絮团系统中氨氮、亚硝酸氮和硝酸氮的变化
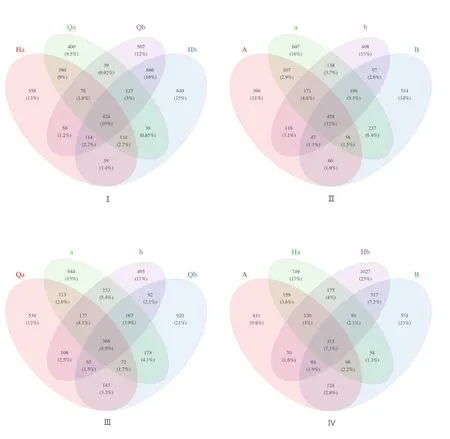
图2 温度突变前的水体(Ⅰ)和肠道(Ⅱ)菌群与突变后水体(Ⅲ)和肠道(Ⅳ)菌群韦恩图
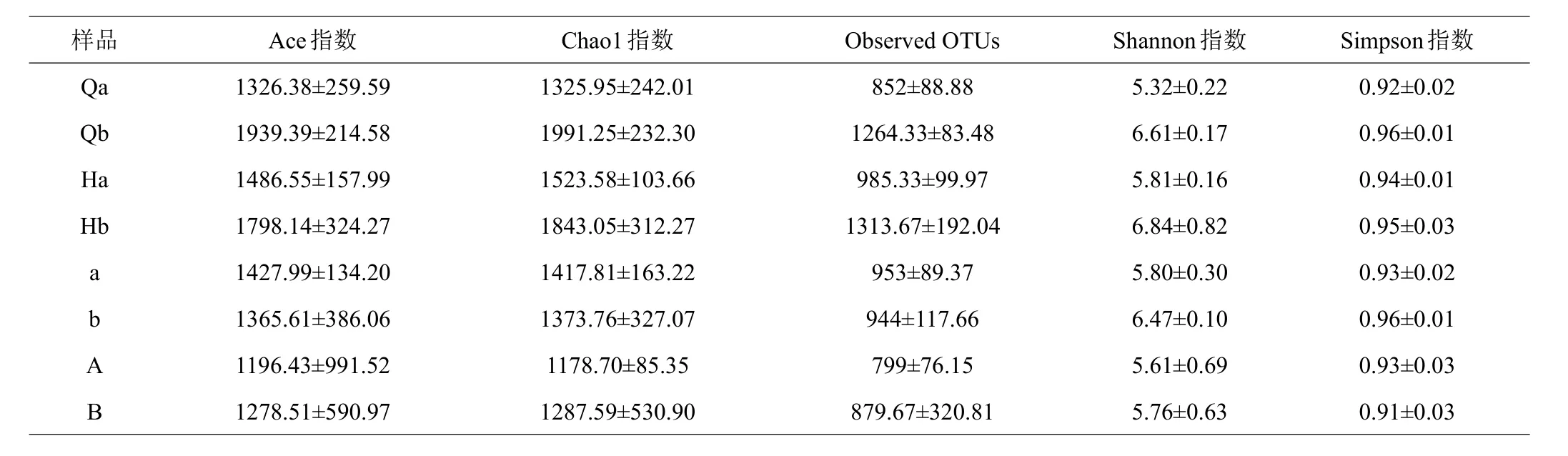
表1 温度突变前后的肠道和水体菌群多样性指数
共鉴定出相对丰度在1%以上的6个门11个属,在门水平上,变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)和TM7门是主要的细菌,在实验周期中实验组温度突变前后水体微生物Qb与Hb的菌群结构无差异,对照组Qa的菌群结构中 Proteobacteria(57.36%)与Bacteroidetes(36.45%)分别增加或减少到Ha的Proteobacteria(79.66%)与Bacteroidetes(13.53%),肠道微生物对照组a的菌群结构中 Proteobacteria(84.42%)与 Bacteroidetes(5.66%)分别增加或减少到A的Proteobacteria(82.10%)与Bacteroidetes(15.20%),实验组b的菌群结构中Proteobacteria(82.50%)与Bacteroidetes(10.02%)分别减少到B的Proteobacteria(78.17%)与Bacteroidetes(7.77%)。在属水平上,极杆菌属(Polaribacter)、小红卵菌属(Roseivivax)和海命菌属(Marivita)在对照组的水体微生物Qa与Ha中显著,在实验组中丰度极低,三价铁和硝酸盐还原细菌(Ardenscatena)、冷蛇菌属(Psychroserpens)在实验组丰度高于对照组。实验组与对照组的肠道微生物发光杆菌属(Photobacterium)、Vibrio与Marivita在温度突变后均有所减少,实验组比对照组的丰度波动相对稳定。
2.4 温度突变前后菌群种类和丰度差异及距离矩阵PCoA
根据加权和未加权UniFrac距离矩阵PCoA图分析,可以得到同组的样本之间图中物种可以很好的聚在一起,不同组之间可以明确的区分开。实验组Qb与Hb的距离比对照组Qa与Ha的距离近,实验组b与B的距离比对照组a与A的距离近,通过LDA值分布柱状图的结果分析,得到了不同组间微生物分类相对丰富的差异。LEfSe的LDA值结果表明具有显著差异的微生物群落在温度突变前的水体菌群Qa与Qb中最多。根据LDA值分布柱状图的结果,突变前的水体菌群在多样性更为丰富,实验组比对照组细菌群落温度突变前后变化差异小。
3 讨论
3.1 温度突变过程中的氮转化
在温度突变实验前的30天,待水体理化因子变化稳定后,对照组水体菌群不能有效转化水体中产生的的残饵粪便,无机氮的浓度和总量逐渐增加累积[24-25]。实验组水体中的氨氮、亚硝酸氮和硝酸氮的产生和去除速率均快于对照组,表明生物絮团能促进水体中的氮转化进程[26]。在温度突变实验过程中,温度突变对水体中氮转化通路无显著影响,实验组的硝酸氮在温度突变后有上升的趋势。这与毕冬[27]、吴鹏等[28]的研究结果不尽相同,分析原因是温度对水质影响的相关研究都是通过长周期的调控不同温度来进行的,而在水体理化因子稳定后进行温度突变实验尚属首次。本实验的结果也证明在水质稳定的条件下,温度突变并不会对生物絮团系统和半封闭养殖系统的水体氮转化产生明显的影响。
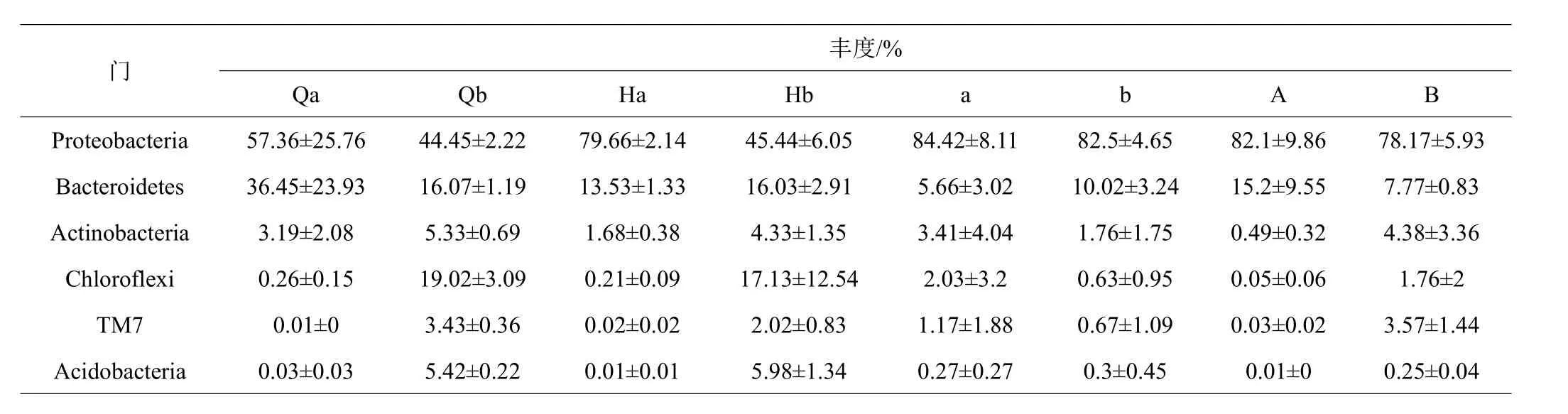
表2 在门水平的菌群相对丰度
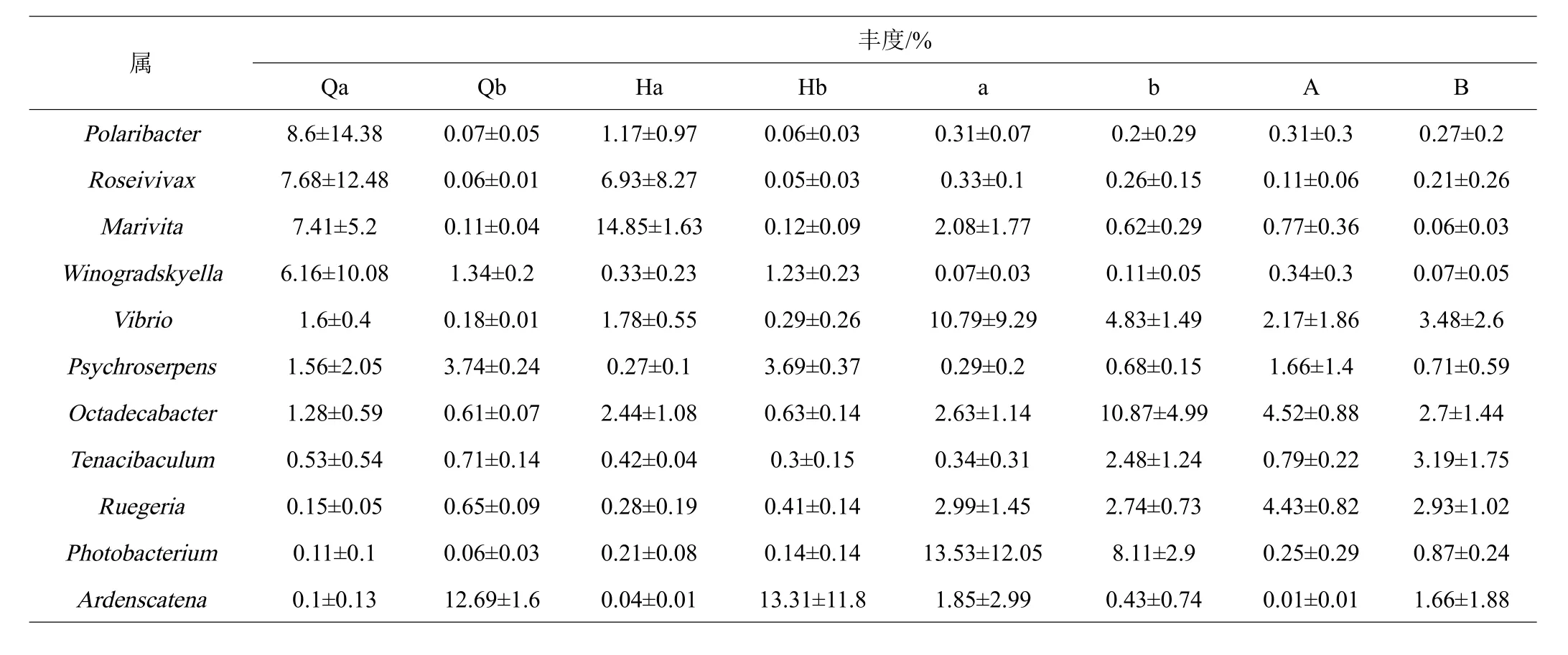
表3 在属水平的菌群相对丰度
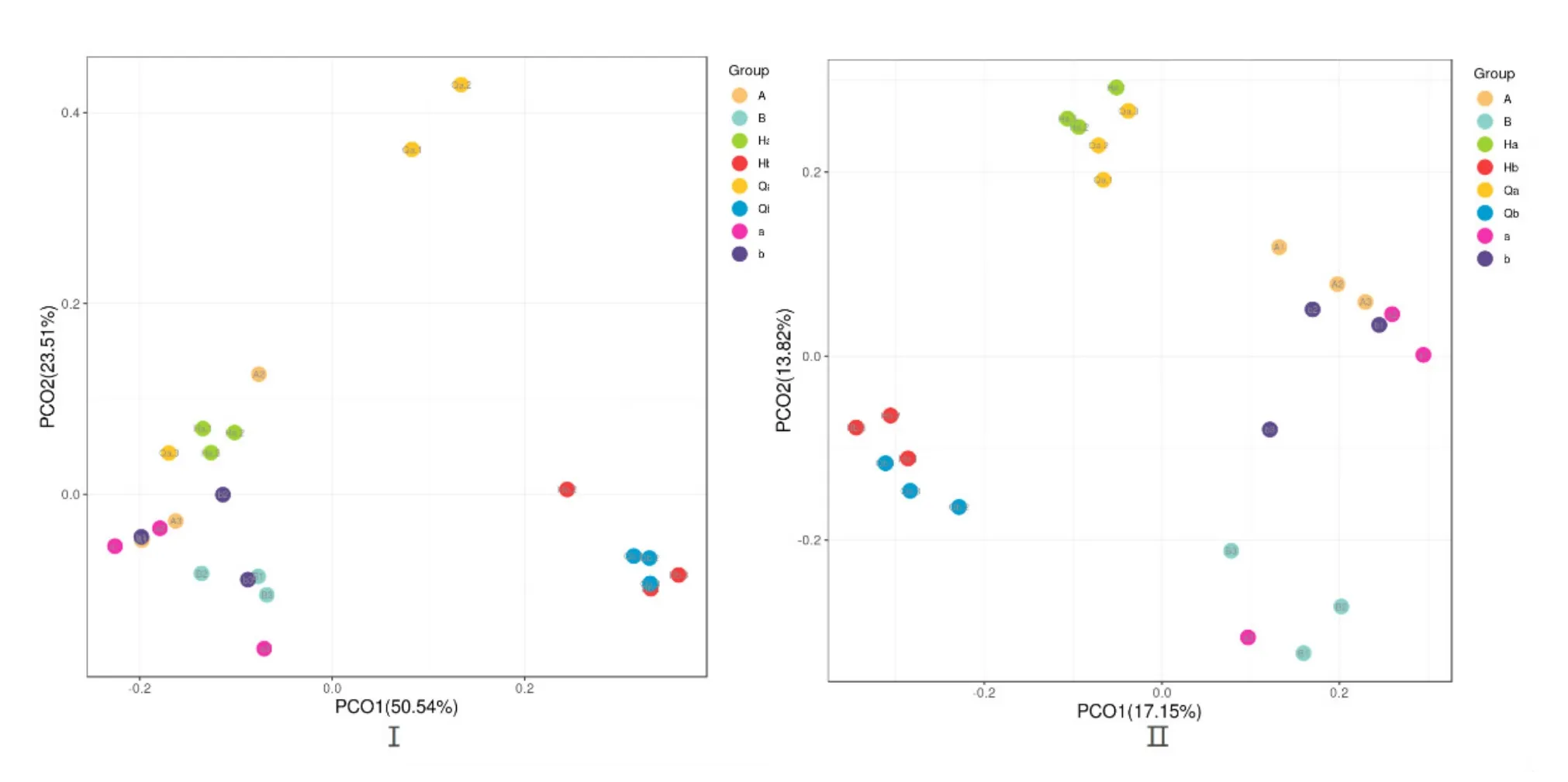
图3 温度突变前后菌群的加权(Ⅰ)与非加权(Ⅱ)UniFrac距离矩阵PCoA图
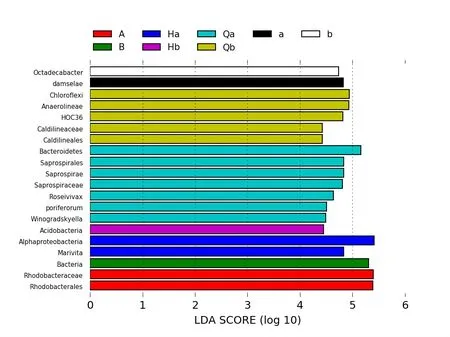
图4 温度突变前后菌群的LDA值分布柱状图
3.2 温度突变过程中的微生物丰度和多样性
本研究利用使用高通量测序分析生物絮团系统中的微生物多样性变化情况。温度突变前水体和肠道的丰度与多样性大于突变后,LEfSe的LDA值计算结果显示显示具有显著差异的细菌群落在温度突变前的水体菌群Qa与Qb中最多。温度突变对水体和肠道的微生物群落一定的影响,温度突变后的水体和肠道的微生物群落在丰度与多样性均低于突变前[29]。Alpha多样性的结果表明实验组的丰度与多样性大于对照组,实验组比对照组细菌群落温度突变前后变化差异小,表明生物絮团的微生物丰度和多样性具有更高的稳定性[28,30]。
3.3 温度突变过程中的微生物菌群结构差异
在门水平上Proteobacteria和Bacteroidetes是主要的细菌,在所有水体和肠道样本中中占很大比例,这与相关的研究结果相类似[31-33]。实验组温度突变前后水体微生物的菌群结构无差异,对照组菌群结构中Proteobacteria比例增加,Bacteroidetes减少。水体中大多数的Proteobacteria是养殖系统中的共生细菌[34],在生物絮团系统的尾水处理中,Proteobacteria用于去除水体中的有机物质[35-36]。Proteobacteria在生物絮团的微生物群落组成中有重要的作用[37-38]。因此,在利用生物絮团的养殖模式下,Proteobacteria可以有效地调节养殖水体的水质。Actinobacteria是一种较为常见的益生菌,在特定的环境下可以产生有益的物质[39]。Actinobacteria在实验组的水体和肠道细菌群落中比例菌高于对照组,且在温度突变中的波动小于对照组。在属水平上,Photobacterium与Vibrio在实验组水体和肠道微生物样本中比例均低于对照组,且在温度突变后实验组与对照组中的含量均有所减少,表明生物絮团可以控制弧菌的数量[40-41]。结果表明生物絮团系统能够抑制有害细菌的繁殖。对照组高氨氮的环境会破坏对虾机体免疫系统,导致病原体增加,在肠道中的表现证实了这一结果[42]。
4 结论
经过长期培养后氮转化通路稳定的生物絮团系统和半封闭养殖系统,温度突变并不会对水体氮转化产生明显的影响。温度突变对水体和肠道的微生物群落一定的影响,温度突变后的水体和肠道的微生物群落在丰度与多样性均低于突变前。生物絮团系统在应对温度突变中的表现要优于半封闭养殖系统,在微生物群落的丰度与多样性上均具有更高的稳定性。
