2种生物诱抗剂对葡萄霜霉病的诱导抗病作用
2021-12-09王晓琳吴琴燕彭燕琼黄洁雪毛妮妮吉沐祥
王晓琳,吴琴燕,彭燕琼,邬 劼,黄洁雪,毛妮妮,吉沐祥
(1江苏丘陵地区镇江农业科学研究所,江苏句容 212400;2江苏农林职业技术学院,江苏句容 212499)
0 引言
葡萄霜霉病是由葡萄生单轴霉[Plasmopara viticola(Berk.et Curtis)Berl.et de Toni]引起的一种世界性病害,也是中国葡萄产区主要病害之一[1-2]。葡萄霜霉病通常发生在温和潮湿的葡萄种植区域,是气候主导的流行性病害,一般危害时造成葡萄损失达20%~30%,严重时可达70%~80%,甚至导致葡萄园颗粒无收,造成毁灭性的损失[3]。目前生产上防治葡萄霜霉病还是以化学防治为主,如今的大多数化学杀菌剂都是单一作用位点,以一种方式作用于植物病原体,重复利用这些农药势必会带来抗性。在中国农药信息网上登记防治葡萄霜霉病的化学农药主要有:吡唑醚菌酯、烯酰吗啉、波尔多液、百菌清、克菌丹、啶氧菌酯、代森联、氰霜唑、双炔酰菌胺和嘧菌酯等,而登记的生物农药只有植物源杀菌剂丁子香酚和苦参碱,微生物农药哈茨木霉菌。寡糖又被称为低聚糖,通常是由3~10个单糖单元通过糖苷键连接构成的。按照构成寡糖的单糖种类划分,寡糖可分为葡萄糖寡糖、木糖寡糖、果糖寡糖、半乳糖寡糖等。按照功能性划分,寡糖可分为普通寡糖和功能性寡糖。普通寡糖容易被肠道消化吸收,一般作为甜味剂应用,如蔗糖和乳糖。功能性寡糖通常不容易被机体消化和吸收,但是具有一定的活性[4]。
目前发现壳寡糖、β-葡寡糖和褐藻胶寡糖等能诱导植物产生免疫反应[5-7]。β-1,3-葡寡糖可以作为一种激发子,诱导植物自身免疫系统分泌抗生素,对致病菌产生抗性,从而抵抗病原体的侵入,β-1,3-葡寡糖能够抑制多种病原性真菌的生长,如烟草软腐病[8]。氨基寡糖素能诱导植物产生抗性,寡糖植物免疫诱抗剂作用对象广谱,目前在西瓜[9]、苹果[10]、马铃薯[11]和番茄[12]等植物中均有报道。史茹研究发现5%氨基寡糖素AS用量1500 g/hm2时,对西瓜枯萎病防效为88.2%[9]。0.5%氨基寡糖素AS对苹果离体枝条有较强的保护作用,对腐烂病的防治效果为89.0%[10]。50倍3%氨基寡糖素喷种+500倍3%香菇多糖喷施叶片可诱导马铃薯对疮痂病产生抗性,防治效果为68.9%[11]。张胡焕[12]发现5%氨基寡糖素AS对番茄叶霉病有一定的防效,与48%苯甲·嘧菌酯SC混用能抗病增效,减少杀菌剂的使用量。氨基寡糖素除具有公认的诱导抗病能力外,还可以增强植物的抗逆能力,如提高植物抗寒性[13]、抗旱性[14]和抗涝性[15]。陆红霞等[13]研究发现100 ppm氨基寡糖素浸种番茄种子可提高番茄苗的抗寒性。此外,氨基寡糖素还具有促进植物生长、改善作物品质和提高次生代谢物产量等功能[16]。本试验选用2种诱抗剂β-1,3-葡寡糖和氨基寡糖素对葡萄进行霜霉病试验,明确2种诱抗剂对葡萄霜霉病抗性生理指标的影响及对霜霉病的防效,旨在为葡萄霜霉病的防治提供理论指导。
1 材料与方法
1.1 供试材料
葡萄:‘夏黑’,树龄6年。
供试药剂:β-1,3-葡寡糖由南京理工大学提供;2%氨基寡糖素AS由山东国润生物农药有限责任公司生产;50%氟醚菌酰胺WDG由山东省联合农药工业有限公司生产。
仪器:Multiskan FC型酶标仪:赛默飞世尔(上海)仪器有限公司;Haier医用低温保存箱DW-86L626:青岛海尔特种电器有限公司;高通量组织研磨仪TL-48P:上海万柏生物科技有限公司;移液枪:德国Eppendorf公司。
1.2 试验时间、地点和试验设计
本试验于2017年在句容市华阳街道弘景路1号镇江市农业科学院葡萄园完成。
试验设计5个处理。处理1为β-1,3-葡寡糖10倍;处理2为β-1,3-葡寡糖100倍;处理3为2%氨基寡糖素AS 750倍;处理4为50%氟醚菌酰胺WDG 3750倍;处理5为清水。各处理于6月17日开始第一次喷雾,喷药采用雾星3JWB-16A背负式电动静电喷雾器(工作压力为0.15~0.4 MPa;流量12 L/h;雾滴中径≤120 μm)喷雾,对照区喷施清水。7天一次,共3次,3次药后7天调查新梢叶片数和发病叶片数,并按分级标准进行调查,统计分析。
1.3 测定项目及方法
1.3.1 葡萄叶片几丁质酶(CHI)活性测定 使用几丁质ELISA试剂盒(购自上海羽朵生物科技有限公司)对CHI的活性进行测定,试验具体操作如下:3次药后3天和7天分别取新梢发生的完全展开新叶,每处理10片,取保鲜叶片1 g,加入0.5g pvpp和7 mL pH 6.0的磷酸缓冲溶液,碾磨后,静置提取30 min,离心取上清液,用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中CHI活性浓度。CHI活定义为在37℃下,1 mL酶液1 min生成1 μg N-乙酰氨基葡萄糖时所需酶量为1 U。
1.3.2 苯丙氨酸解氨酶(PAL)活性测定 应用ELISA试剂盒双抗体夹心法测定各处理葡萄叶片PAL水平。PAL酶液的制备:分别取各处理材料按照质量体积比(g/mL)1:9的比例加入5.4 mL 0.1 mol/L的硼酸缓冲液(pH 8.8,含5 mmol/L巯基乙醇、1 mmol/L EDTA),研磨,4℃条件下8000 r/min离心20 min,取上清液待测。用酶标仪在450 nm波长下测定光密度(OD450nm),通过标准曲线计算样品中PAL活性。以每分钟光密度变化0.01所需酶量为1 U。
1.3.3 超氧化物歧化酶(SOD)活性测定 SOD酶液的制备:分别取各处理材料按照质量体积比(g/mL)1:9的比例加入5.4 mL 0.1 mol/L的磷酸缓冲液(PBS)(pH 7.0),研磨,4℃条件下8000 r/min离心20 min,取上清液即为待测酶液。SOD以25℃时抑制邻苯三酚自氧化速率50%时所需的SOD量为1 U。
1.3.4 过氧化物酶(POD)活性测定 POD酶液的制备:分别取各处理材料按照质量体积比(g/mL)1:9的比例加入5.4 mL 0.1 mol/L的磷酸缓冲液(PBS)(pH 7.0),研磨,4℃条件下8000 r/min离心20 min,取上清液即为待测酶液。POD酶活定义为每分钟内A470变化0.01为1 U。
2 结果与分析
2.1 喷施生物诱抗剂对葡萄叶片PAL活性的影响
由图1可知:3次药后3天,β-1,3-葡寡糖100倍、β-1,3-葡寡糖10倍和2%氨基寡糖素AS 750倍相比对照能显著提高PAL的活性;3次药后7天,β-1,3-葡寡糖10倍和2%氨基寡糖素AS 750倍相比对照能显著提高PAL的活性,β-1,3-葡寡糖100倍可能是由于浓度过低使得它在处理7天后未能显著提高PAL的活性。

图1 喷施生物诱抗剂对葡萄叶片PAL活性的影响
2.2 喷施生物诱抗剂对葡萄叶片CHI活性的影响
由图2可知:3次药后3天和7天,β-1,3-葡寡糖10倍和2%氨基寡糖素AS 750倍相比对照能显著提高CHI的活性,其中β-1,3-葡寡糖10倍对CHI活性的提高程度高于2%氨基寡糖素AS 750倍。β-1,3-葡寡糖100倍可能是由于浓度过低使得它在处理后未能显著提高CHI的活性。
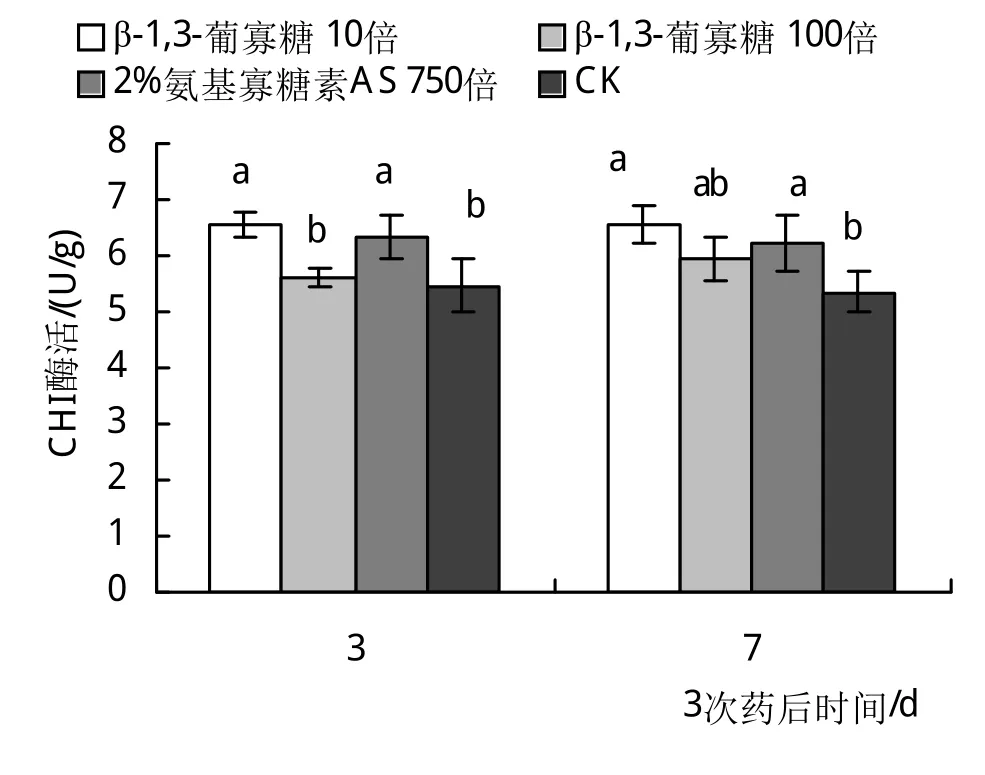
图2 喷施生物诱抗剂对葡萄叶片CHI活性的影响
2.3 生物诱抗剂对葡萄叶片POD活性的影响
由图3可知:3次药后3天和7天,β-1,3-葡寡糖10倍和2%氨基寡糖素AS 750倍相比对照能显著提高POD的活性,其中2%氨基寡糖素AS 750倍对POD活性的提高程度高于β-1,3-葡寡糖10倍。β-1,3-葡寡糖100倍可能是由于浓度过低使得它在处理后未能显著提高POD的活性。

图3 喷施生物诱抗剂对葡萄叶片POD活性的影响
2.4 喷施生物诱抗剂对葡萄叶片SOD活性的影响
由图4可知,3次药后3天,β-1,3-葡寡糖10倍、β-1,3-葡寡糖100倍和2%氨基寡糖素AS 750倍SOD的活性相比对照差异不显著;3次药后7天,β-1,3-葡寡糖10倍和β-1,3-葡寡糖100倍相比对照能显著提高葡萄叶片SOD的活性,2%氨基寡糖素AS 750倍SOD的活性相比对照差异不显著。

图4 喷施生物诱抗剂对葡萄叶片SOD活性的影响
2.5 2种生物诱抗产品对葡萄霜霉病的抗病试验
田间试验表明,β-1,3-葡寡糖10倍,抗病效果最高,病叶防效为62.59%,病指防效为65.44%,与化学药剂50%氟醚菌酰胺WDG 3750倍病叶防效(45.54%)和病指防效(64.11%)无显著差异。2%氨基寡糖素AS 750倍也有一定的抗病效果,病叶防效为25.83%,病指防效为46.41%,但明显低于β-1,3-葡寡糖10倍和化学药剂50%氟醚菌酰胺WDG 3750倍的抗病作用。而β-1,3-葡寡糖100倍,与清水对照无显著差异(表1)。

表1 β-1,3-葡寡糖等对葡萄霜霉病抗病效果
3 结论与讨论
有研究结果表明,植物诱导抗性的产生常常是通过酶催化调节而实现的。植物受到病原菌侵染或被诱导处理后,与抗病反应密切相关的防御酶活性升高是诱导抗性产生的重要机制之一[17]。本研究以β-1,3-葡寡糖和氨基寡糖素为诱导剂,研究其对葡萄霜霉病的诱导抗性,并通过测定β-1,3-葡寡糖和氨基寡糖素诱导后,葡萄叶片防御酶系活性的变化,揭示β-1,3-葡寡糖和氨基寡糖素诱导葡萄产生系统诱导抗病性的可能机制。研究结果表明,3次药后3天,β-1,3-葡寡糖100倍、β-1,3-葡寡糖10倍和2%氨基寡糖素AS 750倍相比对照能显著提高PAL的活性;3次药后7天,β-1,3-葡寡糖10倍和2%氨基寡糖素AS 750倍相比对照能显著提高PAL的活性。商文静[17]研究结果表明,壳寡糖诱导后烟叶体内和抗病性相关的各种防御酶活性均有不同程度的变化,PAL活性在接种后有大幅度升高,这与本研究结果类似。PAL通过催化L-苯丙氨酸形成反式肉桂酸这一不可逆过程,从而进入苯丙烷代谢途径,进一步介导类黄酮、木质素、花青素、植物抗毒素和植物激素等的生物合成,进而合成多种具有抗菌作用的产物,是植物次生代谢的关键酶和限速酶,酶活性的高低与植物的抗病性密切相关。喷施生物诱抗剂后,β-1,3-葡寡糖10倍和2%氨基寡糖素AS 750倍相比对照能显著提高POD的活性,其中2%氨基寡糖素AS 750倍对POD活性的提高程度高于β-1,3-葡寡糖10倍。POD参与木质素、木栓质和醌类物质的合成,促进侵染点愈合并抑制病原菌果胶分解酶、纤维素分解酶等酶的活性,提高植物抗性。喷施生物诱抗剂后,3次药后3天和7天,β-1,3-葡寡糖10倍和2%氨基寡糖素AS 750倍相比对照能显著提高CHI的活性,植物的CHI是一种病程相关蛋白,直接催化真菌细胞壁的主要成分β-1,4-联结的N-乙酰-D-葡萄胺水解,具有直接杀伤或抵抗病原的活性与作用,而且受到水杨酸等其他抗病相关分子的调控,在植物防御过程中发挥着重要作用。喷施生物诱抗剂后,β-1,3-葡寡糖100倍、β-1,3-葡寡糖10倍和2%氨基寡糖素AS 750倍SOD的活性相比对照差异不显著;3次药后7天,β-1,3-葡寡糖10倍和β-1,3-葡寡糖100倍相比对照能显著提高葡萄叶片SOD的活性,2%氨基寡糖素AS 750倍SOD的活性相比对照差异不显著。SOD是活性氧清除反应过程中第一个发挥作用的抗氧化酶,能将O2-快速歧化为H2O2和分子氧,是抗逆性相关的酶。
檀志全等[18]研究发现5%氨基寡糖素AS对葡萄霜霉病的预防效果为78.29%,对葡萄炭疽病的预防效果为60.00%。李育林[19]试验发现3次喷施3%氨基寡糖素AS 250倍液对葡萄霜霉病的防效达74.73%,与化学药剂40%烯酰吗啉2000倍液无显著性差异。本研究结果发现2%氨基寡糖素AS 750倍对葡萄霜霉病的病指防效为46.41%。孙辉[20]研究发现寡聚糖具有体外抑菌活性,能诱导植物的抗病性,表现为降低发病程度,组织病理学及超微结构特征明显变化,但抗病性诱导需要较高的浓度。本试验结果发现β-1,3-葡寡糖10倍对葡萄霜霉病的病指防效达60%以上,β-1,3-葡寡糖10倍和2%氨基寡糖素AS 750倍相比对照能显著提高CHI,PAL和POD的活性,其中2%氨基寡糖素AS 750倍对PAL活性的提高程度显著高于β-1,3-葡寡糖10倍。β-1,3-葡寡糖100倍可能是由于浓度过低使得它仅在处理3天后能显著提高PAL的活性,其他时间这3种酶活均与对照无显著差异,且田间防效也极差。β-1,3-葡寡糖处理7天后能显著提高SOD酶活,提高程度与浓度正相关,能够显著提高葡萄霜霉病抗性的β-1,3-葡寡糖10倍和2%氨基寡糖素AS 750倍处理均能显著提高葡萄CHI、PAL和POD酶活,表明足够浓度的诱抗剂能够通过诱导植物体内防御酶和抗病相关蛋白活性升高提高植物抗病性。本研究中,防御酶和抗病相关蛋白活性变化是β-1,3-葡寡糖诱导葡萄抗葡萄霜霉病侵染的原因之一。
