打破菜豆种子硬实条件优化的研究
2021-12-09张光辉刘大军杨晓旭闫志山冯国军
张光辉,刘大军,杨晓旭,刘 畅,闫志山,冯国军
(黑龙江大学现代农业与生态环境,哈尔滨 150080)
0 引言
菜豆(Phaseolus vulgaris L.)俗称芸豆、四季豆、饭豆等,是一年生豆科菜豆属蔓生或矮生草本植物[1]。原产于美洲,在中国南北均有种植,菜豆种子同其他豆科种子一样也具有硬实性。硬实种子具有种皮不透水而不能吸胀发芽并保持原来大小状态,这种自我保护机制对物种的延续和传播极为有利,但生产上,利用同一批未经处理的种子播种后,由于种子硬实性,经常会出现出苗不齐或缺苗的现象[2]。多数研究表明,种子硬实主要是种皮致密且缺乏透性[2-4]。在干燥的环境中会加速种皮细胞壁或细胞内含物脱水进而发生胶体变化形成硬实[5-6]。因而,可以通过改变种皮透性打破种子硬实性。大量研究表明,热水浸种、激素处理、机械损伤、酸碱腐蚀等可以打破种子硬实[7-9]。然而不同植物种子或同一品种的不同批次种子硬实程度往往不同,因而破除硬实的条件需要进一步优化。本研究选用硬实率较高的盛冠菜豆品种,经浸水法筛选出的硬实种子为试验材料,以简单易行的温水浸泡、热水浸泡和低温贮藏方式处理硬实种子,进而确定栽培中破除种子硬实性的适宜方法,为今后生产时破除菜豆种子硬实提供依据。
1 材料与方法
1.1 试验材料
本次研究在前期品种筛选的基础上,以“盛冠”菜豆种子作为实验材料。试验开始之前剔除杂质以及干瘪和虫蛀的种子,挑选籽粒饱满,富有光泽的优良种子进行试验。
1.2 试验方法
1.2.1 种子基本性状
(1)种子百粒重的测定:将筛选过后的菜豆种子随机选取100粒,用精度为万分之一的电子天平称重,每组6次重复,计算平均值。
(2)种子大小的测定:随机选取净种子50粒,利用游标卡尺测定种子的长度和宽度。
(3)种子吸水率的测定:随机选取常规盛冠种子20粒,称重并记录m0后放入盛有50 mL蒸馏水的三角瓶浸泡并置于人工气候箱,于2、4、6、8、10、12、24、36、48、60、72 h分别取出种子,在滤纸上吸干种子表面水分,称重并记录m1,每组3次重复。
吸水率(R)的计算见公式(1)。

式中:m0为浸种前种子的质量;m1为浸种后种子的质量。
(4)种子硬实率测定:将筛选过后的菜豆种子随机选取100粒,置于装有100 mL蒸馏水的三角瓶中,然后放置在人工气候箱(光,25℃,12 h/暗,20℃,12 h)浸泡24h,统计完全未吸胀的种子粒数,计算种子硬实率,见公式(2),3次重复,计算平均值[2]。
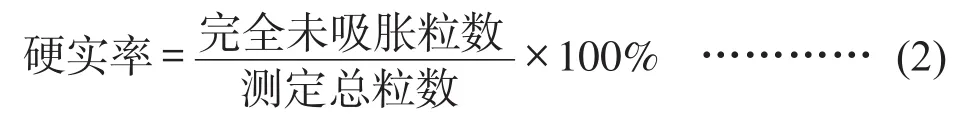
(5)种子吸水情况的测定:选取经硬实率测定后完全吸胀的非硬实种子,自然风干7天。随机挑选无破损、饱满的非硬实种子20粒,称重并记为m0,然后采用凡士林密封法[10]测定种子不同部位的吸水情况。用凡士林分别对种子作5个处理(标记为Ⅰ,Ⅱ,Ⅲ,Ⅳ,CK):处理Ⅰ,只有种脐未用凡士林密封;Ⅱ,只有种孔部位未密封;Ⅲ,只有内脐部位未密封;Ⅳ,用凡士林密封整粒种子;CK则不用凡士林密封种子。每个处理20粒,3次重复,按上面的方法密封种子后分别置于盛有蒸馏水的烧杯中,浸种24 h后取出种子,用吸水纸擦除种子表面的凡士林及其水分后称量,记为m1。
吸水量(X)的计算见公式(3)。
式中:m0为浸种前种子的质量;m1为浸种后擦除种子表面凡士林及水分后种子的质量。
(6)种子含水量的测定:随机选取种子20粒,于研磨机磨碎,先称装样锡箔纸的质量m1,后称取样品4.8~5.0 g,记为 m2,于 130℃烘箱烘 1 h(烘箱需提前20 min预热),取出样品称总重m3;每个样品3次重复。
含水量(W)的计算见公式(4)。

式中:m1为装样锡箔纸的质量;m2为烘干前样品的质量;m3为烘干后样品和锡箔纸的总质量。
(7)种子硬度的测定:随机选取25粒菜豆种子,用硬度计测定种子承受的最大力。
(8)种子生活力的测定[11]:随机取出100粒菜豆种子,先用解剖刀划破非生长点处的种皮,然后放入装有100 mL蒸馏水的三角瓶中,置于人工气候箱浸泡12 h,吸胀后转至培养皿进行萌发2天,然后,用0.1%的TTC溶液染色,置于35℃烘箱避光培养4h,统计胚根染成红色的种子粒数(即有生活力的种子),每组3次重复,计算平均值。
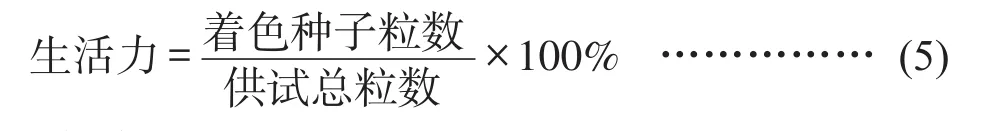
1.2.2 解除硬实处理 试验选用硬实率较高的盛冠菜豆种子,经24 h浸泡后筛选出完全未吸胀的菜豆硬实种子,晾干后做解除硬实试验。
(1)温水处理。
恒温浸种:采用50℃、60℃、70℃三个温度梯度的温水分别浸泡15、30、45、60 min,方案如表1。
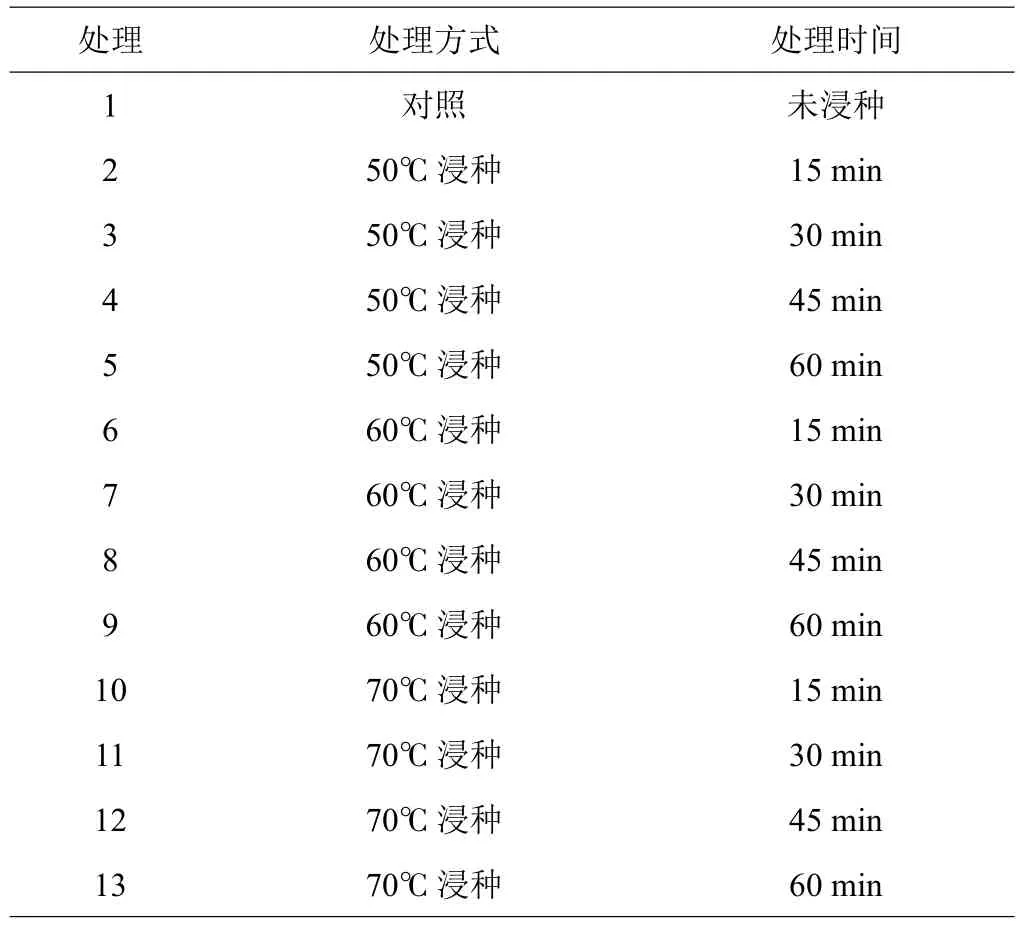
表1 恒温温水浸种破除种子硬实试验设计方案
随机选取20粒硬实种子,置于10 cm×10 cm的2层纱布并用棉绳捆绑,共12个处理,每个处理3次重复。3个独立恒温水浴锅加蒸馏水后分别设定50℃、60℃、70℃三个温度,提前30 min预热,将捆绑好的菜豆种子浸泡,计时开始,每隔15、30、45、60 min取出一个处理的菜豆种子,并均匀放置在垫有两层滤纸的玻璃培养皿中,做好标记,待处理完后做萌发试验。
变温浸种:采用50℃、60℃、70℃三个温度梯度的温水分别浸泡15、30、45、60 min,然后室温冷却1 h(即恒温处理后,室温自然冷却1h)。
(2)热水处理。
恒温浸种:采用80℃、90℃两个温度梯度的温水分别浸泡2 min、5 min、10 min,方案见表2。

表2 恒温热水浸种破除种子硬实试验设计方案
随机选取20粒硬实种子,置于10 cm×10 cm的2层纱布并用棉绳捆绑,共7个处理,每个处理3次重复。独立恒温水浴锅加蒸馏水后分别设定80℃、90℃两个温度,提前30 min预热,将捆绑好的菜豆种子浸泡,计时开始,每隔2、5、10 min取出一个处理的菜豆种子,并均匀放置在垫有两层滤纸的玻璃培养皿中,做好标记,待处理完后做萌发试验。
变温浸种:采用80℃、90℃两个温度梯度的温水分别浸泡2 min、5 min、10 min,然后室温冷却1 h(即恒温处理后,室温自然冷却1h)。
(3)低温处理。
随机选取20粒硬实种子放入自封袋密封,在4℃和-20℃条件下分别放置1天、3天、7天后做萌发试验,3次重复,方案如表3。

表3 低温贮藏破除种子硬实试验设计方案
1.3 萌发试验
试验采用常规的培养皿发芽法[11-12],种子解除硬实处理后,均匀的排列在垫有两层滤纸的玻璃培养皿中,每个处理3次重复,每个重复20粒种子。处理完毕的种子放置于25/20℃(白昼12/12 h)的人工气候箱培养7天。发芽期间每天定时补充蒸馏水使滤纸保持湿润,每2天换一次滤纸,观察种子萌发情况并记录发芽数,第7天测定幼苗下胚轴长、鲜重,计算发芽率、发芽势、发芽指数、活力指数。

式中:Gt为第t天的发芽种子数,Dt为相应发芽天数
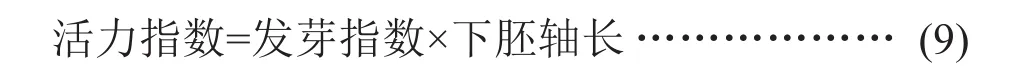
1.4 数据处理
用Excel 2010进行数据整理和制图,SPSS 22.0统计分析软件对各测定指标进行数据方差分析和Duncan法显著性检验(P<0.05)。
2 结果与分析
2.1 种子的基本性状
种子的基本性状可以初步反映种子品质。由表4可以看出,盛冠菜豆种子的百粒重是45.16 g,经硬实鉴定后的非硬实种子比硬实种子百粒重高出10 g左右;在种子外观大小上,非硬实种子的粒长、宽、厚的数值均是最大,分别为12.6、9.63、7.63 mm,同时显著(P<0.05)高于常规种子和硬实种子;此外,三者种子含水量存在显著差异(P<0.05),其中,常规种子含水量最高,为14.28%,而硬实种子含水量最低,为11.04%;盛冠常规种子和非硬实种子的生活力均低于90%,而硬实种子的生活力为96.46%,显著(P<0.05)高于前两者种子;硬实种子的硬度为146.46 N,比常规种子硬度显著(P<0.05)高出32.28 N;盛冠菜豆种子在含水量为14.28%时,硬实率为38%。
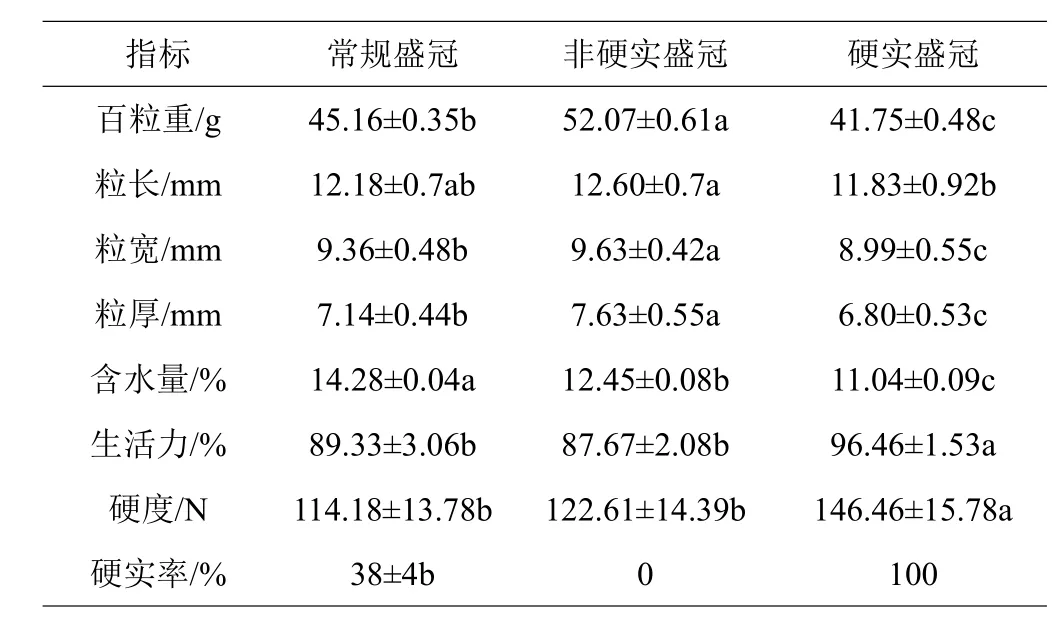
表4 盛冠菜豆种子的基本性状
2.2 种子的吸水率及吸水情况
种子浸泡后,因种子种皮具有透水性,随浸泡时间的延长,种子会逐渐吸水,且不同吸水部位的吸水量存在差异。由图1(a)可看出,盛冠种子吸水率随吸水时间的延长呈S形缓慢增加的变化趋势,其中,种子快速吸水时间段是0~24 h,而后进入缓慢吸水状态。因而,鉴定种子硬实与非硬实的时间点是浸泡24 h。由图1(b)可以看出,未封口的非硬实种子吸水量最大,吸水量为3.9 g,而种子种脐、种孔、内脐的吸水情况相当,种子吸水24 h的吸水量约0.45 g,无显著性变化(P>0.05)。
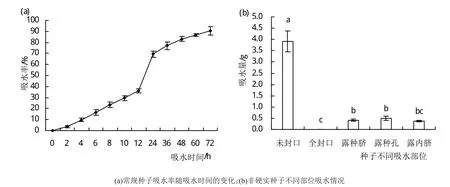
图1 盛冠种子的吸水情况
2.3 温水浸种对硬实种子发芽率、发芽势及活力指数的影响
2.3.1 恒温温水浸种对硬实种子萌发的影响 种子硬实的解除可以通过对比处理后的硬实种子发芽率、发芽势和活力指数等萌发指标和未处理(CK)的种子萌发指标来衡量。由图2(a)可以看出,与对照相比,除70℃浸种60 min会显著降低(P<0.05)种子发芽率外,3个温度的恒温温水浸种均能显著提高(P<0.05)种子发芽率,其中,50℃、60℃恒温浸种15 min、30 min后硬实种子的发芽率最高,均在90%左右,较对照提高了2.5倍。图2(b)是温水恒温浸种后硬实种子发芽势的变化情况,可见其结果与发芽率相似,浸种很大程度上可以提高硬实种子的发芽势,其中,在60℃恒温温水浸种中,随浸种时间的延长,硬实种子的发芽势呈现出先上升后下降的变化趋势,在浸种30 min时,种子的发芽势最高为85%,而此时对照组种子的发芽势为23.2%。由图2(c)可以看出,50℃浸种时随浸种时间的增加,硬实种子的活力指数是逐渐上升的变化趋势,而70℃浸种后,活力指数呈现出相反的变化趋势;在60℃恒温温水浸种30 min的条件下,硬实种子的活力指数最大,为143.14,比对照(活力指数为23.17)提高了5倍左右。由图2可知,50℃、60℃温水浸种15~60 min和70℃温水浸种15~45 min后硬实种子吸胀,同时显著(P<0.05)促进了种子萌发;而在70℃温水浸种60min时并未促进硬实种子萌发。
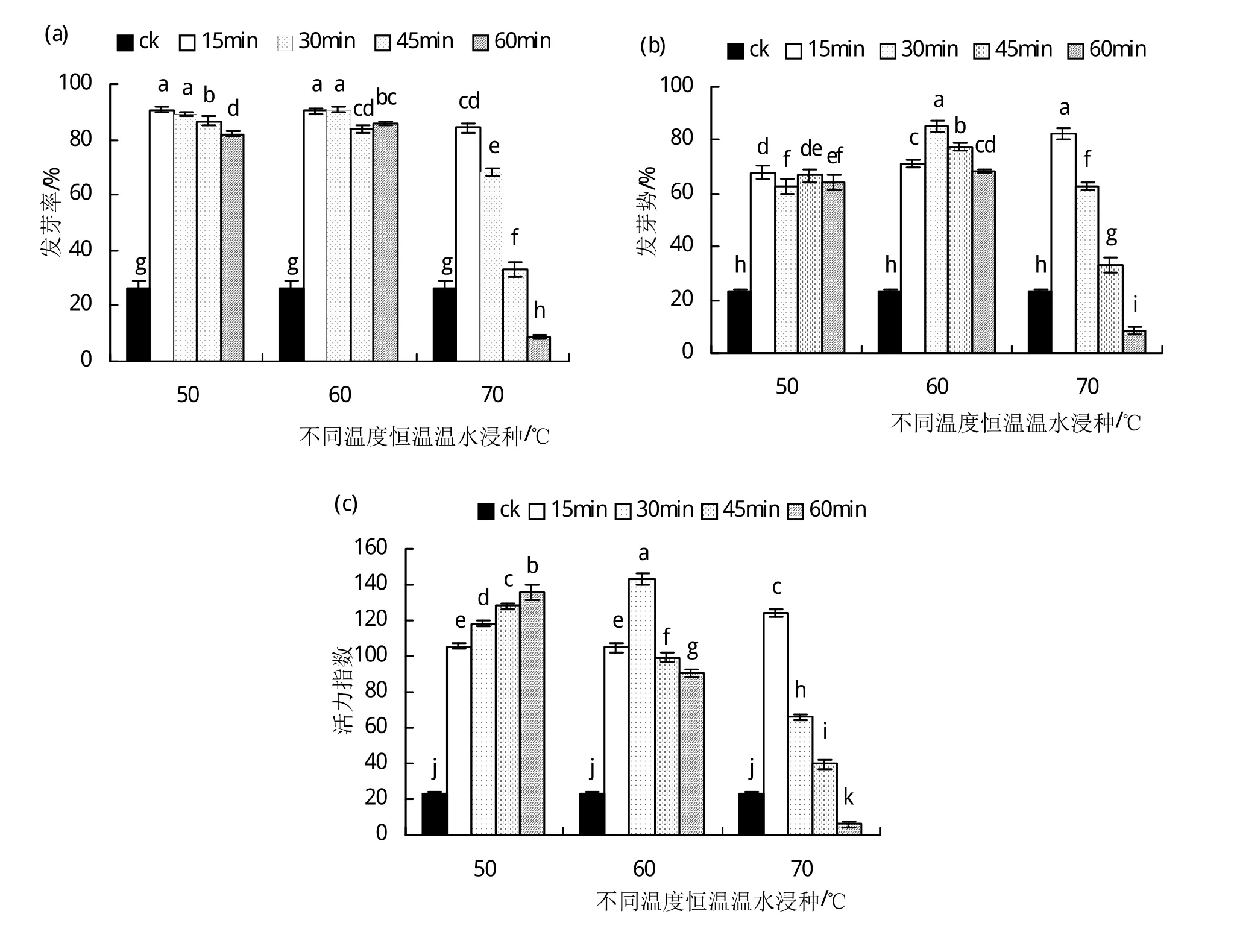
图2 恒温温水浸种对硬实种子萌发的影响
2.3.2 变温温水浸种对硬实种子萌发的影响 由图3(a)可以看出,50℃、60℃变温浸种15~60 min以及70℃浸种15 min后盛冠硬实种子的发芽率均显著提高(P<0.05),其中,50℃变温浸种60 min后种子的发芽率最高(为93.6%),较对照(发芽率为26.5%)提高了2.5倍;相反,与对照相比,70℃变温浸种30~60 min后硬实种子的发芽率明显降低。图3(b)统计的是变温温水浸种后对种子发芽势的影响,可以看出,发芽势与发芽率的变化趋势相近,但种子发芽势在60℃变温浸种30 min处达到最大值,为89.7%;硬实种子经70℃变温浸种,除浸种15 min处理能显著提高(P<0.05)种子发芽势以外,后3个时间段的处理均降低了种子的发芽势。由图3(c)可知,在60℃变温浸种30 min处种子的活力指数达到最大值,为171.2,较对照提高了6.4倍;同样,变温处理对种子活力指数与发芽率、发芽势的影响一致,在70℃变温处理中,浸种时间大于30 min种子活力指数会急剧下降,其中,在浸种60 min处达到最低值(活力指数为3.0),与活力指数最高值相比相差了56倍。因此,变温浸种能有效解除种子硬实,其中,在60℃恒温浸种30 min后置于室温自然冷却1 h的条件下,对促进硬实种子的萌发效果最明显。
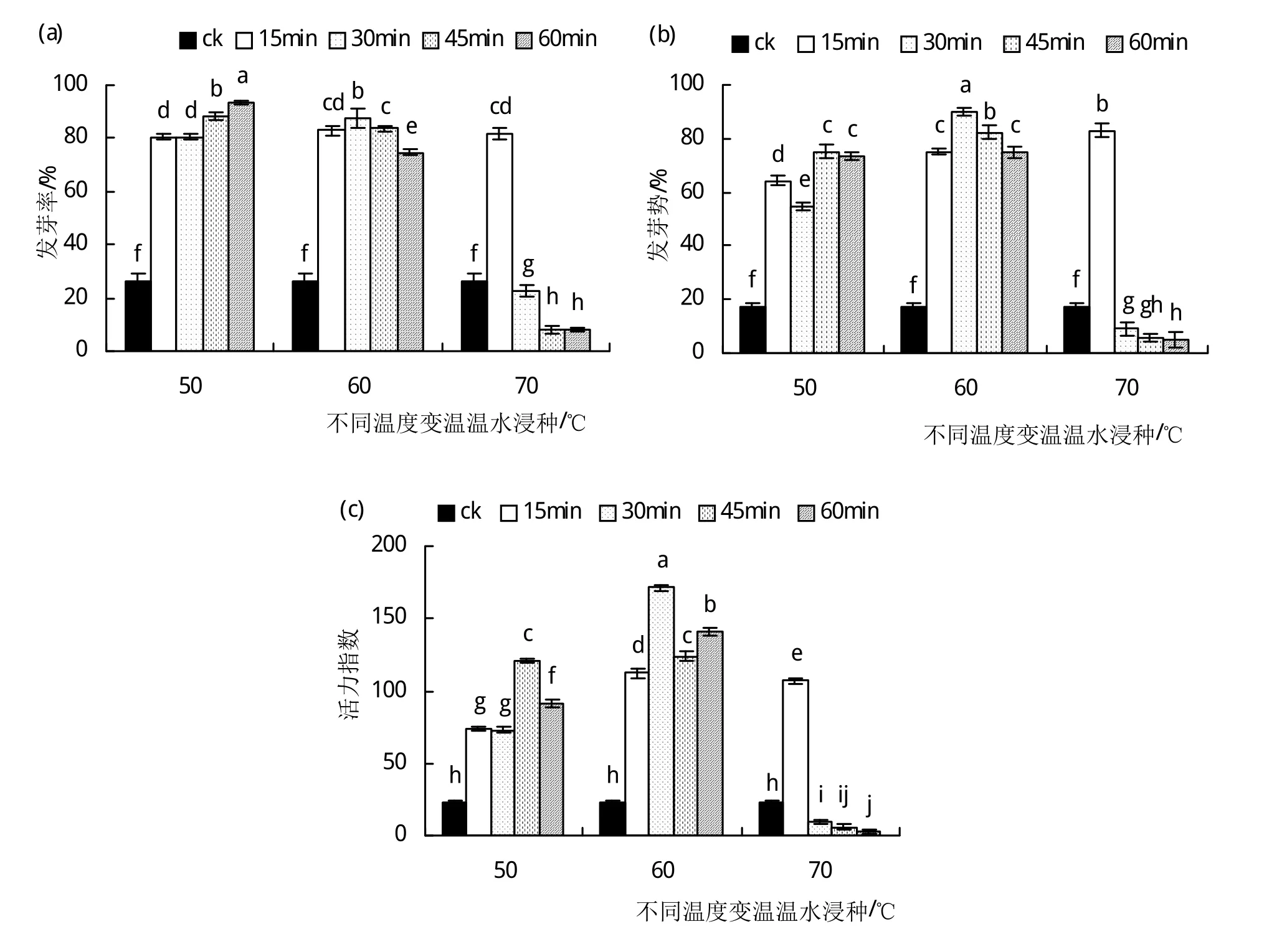
图3 变温温水浸种对硬实种子萌发的影响.
2.4 热水浸种对硬实种子发芽率、发芽势及活力指数的影响
2.4.1 恒温热水浸种对硬实种子萌发的影响 恒温热水浸种试验试验结果表明,当温度为90℃时,硬实种子几乎不发芽,因而图4是80℃恒温热水浸种对硬实种子萌发的影响。由图4(a)可以看出,80℃恒温热水浸种时,随浸种时间的延长,种子发芽率呈现出下降的变化趋势,其中,浸种2 min时种子的发芽率最高,为74.7%,较对照(发芽率为26.5%)提高了1.8倍,而浸种10 min后种子的发芽率与对照组无显著性差异(P>0.05)。同样,由图4(b)和(c)可以看出,硬实种子经80℃恒温热水浸种后发芽势和活力指数与发芽率的变化趋势一致,均在80℃恒温浸种2 min处达到最大值,与对照相比(发芽势为17%,活力指数为23.2),其发芽势和活力指数提高了近3倍。由此可见,恒温热水处理破除种子硬实的最佳条件是80℃恒温浸种2 min。
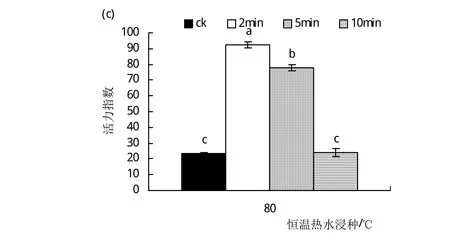
图4 80℃恒温热水浸种对硬实种子萌发的影响.
2.4.2 变温热水浸种对硬实种子萌发的影响 试验选择80℃、90℃两个热水温度浸种以破除种子硬实。由图5(a)可以看出,两个温度浸种时随时间的延长,硬实种子的发芽率均呈下降的变化趋势,其中,仅80℃热水变温浸种处理2 min和5 min可以显著提高(P<0.05)硬实种子发芽率;与对照(CK)的发芽率(26.5%)相比,经80℃热水恒温浸种2 min后于室温环境中自然冷却1 h的硬实解除处理(发芽率为78.7%)后,硬实种子发芽率提高了2倍。变温热水浸种后硬实种子的发芽势如图5(b)所示,在80℃浸种2 min且室温冷却1 h处种子的发芽势最高,为68.3%;而经90℃浸种10 min且室温冷却1 h处理后种子发芽势为0(即处理后的硬实种子不发芽)。种子活力指数与种子每天的发芽率以及最后的生长量有关,其硬实处理后的变化(图5(c))情况与发芽率、发芽势相似,也在80℃处理2 min时达到最大值为86.2,较对照提高了2.7倍。未浸种(CK)的硬实种子发芽率为26.5%、发芽势为17%、活力指数为23.2,由图5可以看出,在变温热水处理中80℃浸种2 min时对解除种子硬实效果最佳。
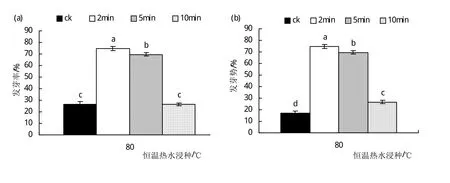
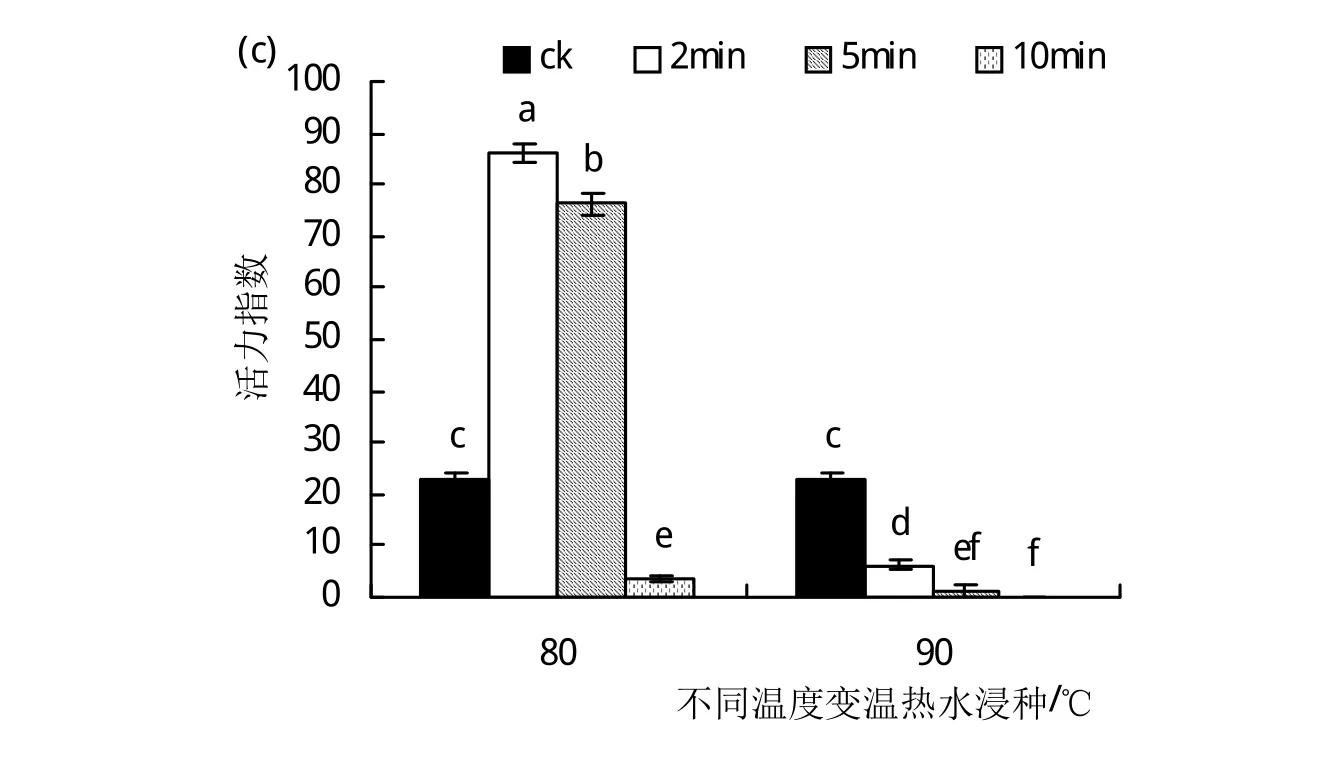
图5 变温热水浸种对硬实种子萌发的影响.
2.5 低温贮藏对硬实种子发芽率、发芽势及活力指数的影响
低温干燥的环境适合贮藏种子,同时该环境下也能一定程度上解除种子硬实。由图6(a)可以看出,在低温4℃和-20℃的条件下贮藏硬实种子,能显著提高(P<0.05)其发芽率,其中,4℃贮藏1~7天,硬实种子的发芽率无明显变化(P>0.05);而-20℃贮藏1~7天,硬实种子发芽率呈现出缓慢的上升趋势,在贮藏7天时,硬实种子的发芽率高达77.7%,较对照(发芽率为31.7%)提高了1.5倍。图6(b)是不同低温贮藏不同时间后硬实种子的发芽势,可见,对照的硬实种子发芽势为15.7%,经低温贮藏6个处理后,硬实种子的发芽势均有所提高,其中,经-20℃低温贮藏7天后硬实种子的发芽率(57%)最高,比对照提高了2.6倍。由图6(c)可以看出,低温贮藏1~7天的时间段,随贮藏时间的增加,种子活力指数均呈现上升的变化趋势。但是,4℃贮藏3天和7天以及-20℃贮藏1天和3天时,种子活力指数无显著性差异(P>0.05);与对照(活力指数为53.8)相比,-20℃贮藏7天后对硬实种子的活力指数提高最明显,其值为101.6,是对照硬实种子活力指数的2倍左右。由图6可见,在低温贮藏的6个处理中,-20℃贮藏7天时硬实种子的发芽率、发芽势和活力指数均达到最高值,因而,该条件是本试验低温贮藏处理中解除种子硬实效果最佳的条件。
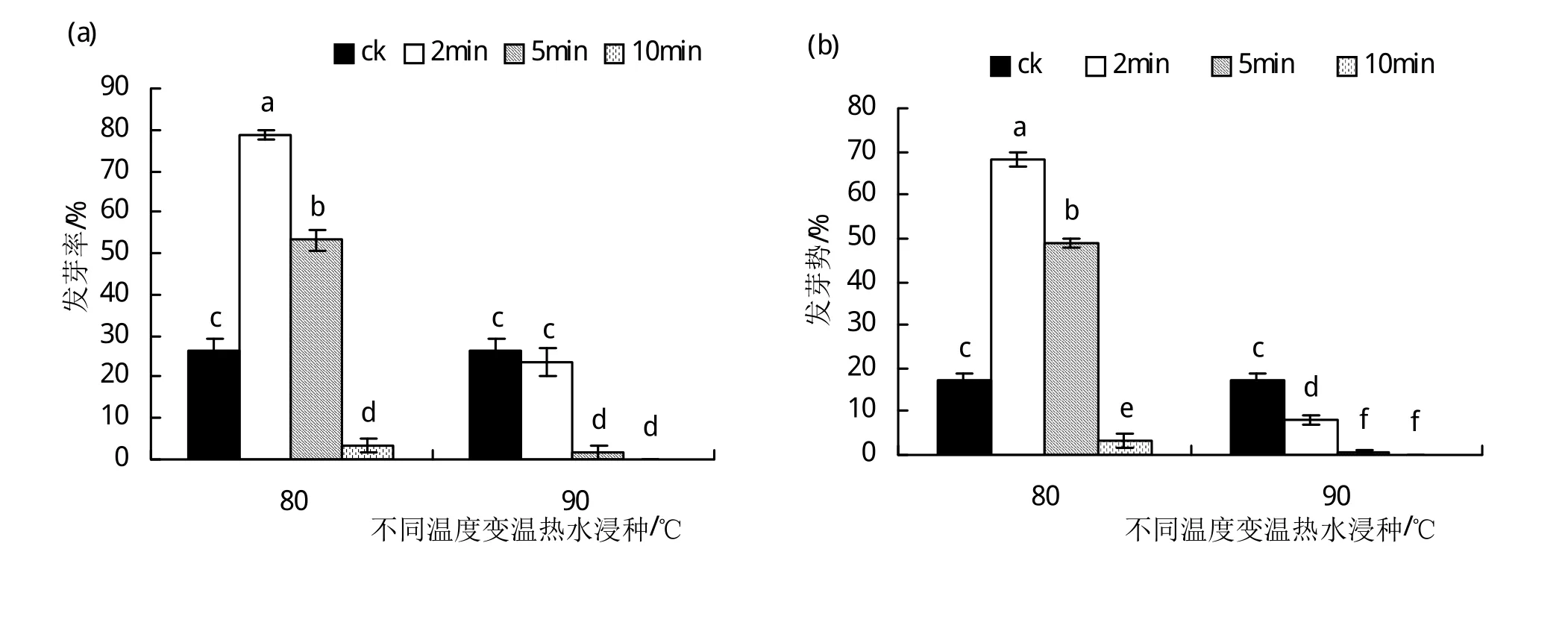
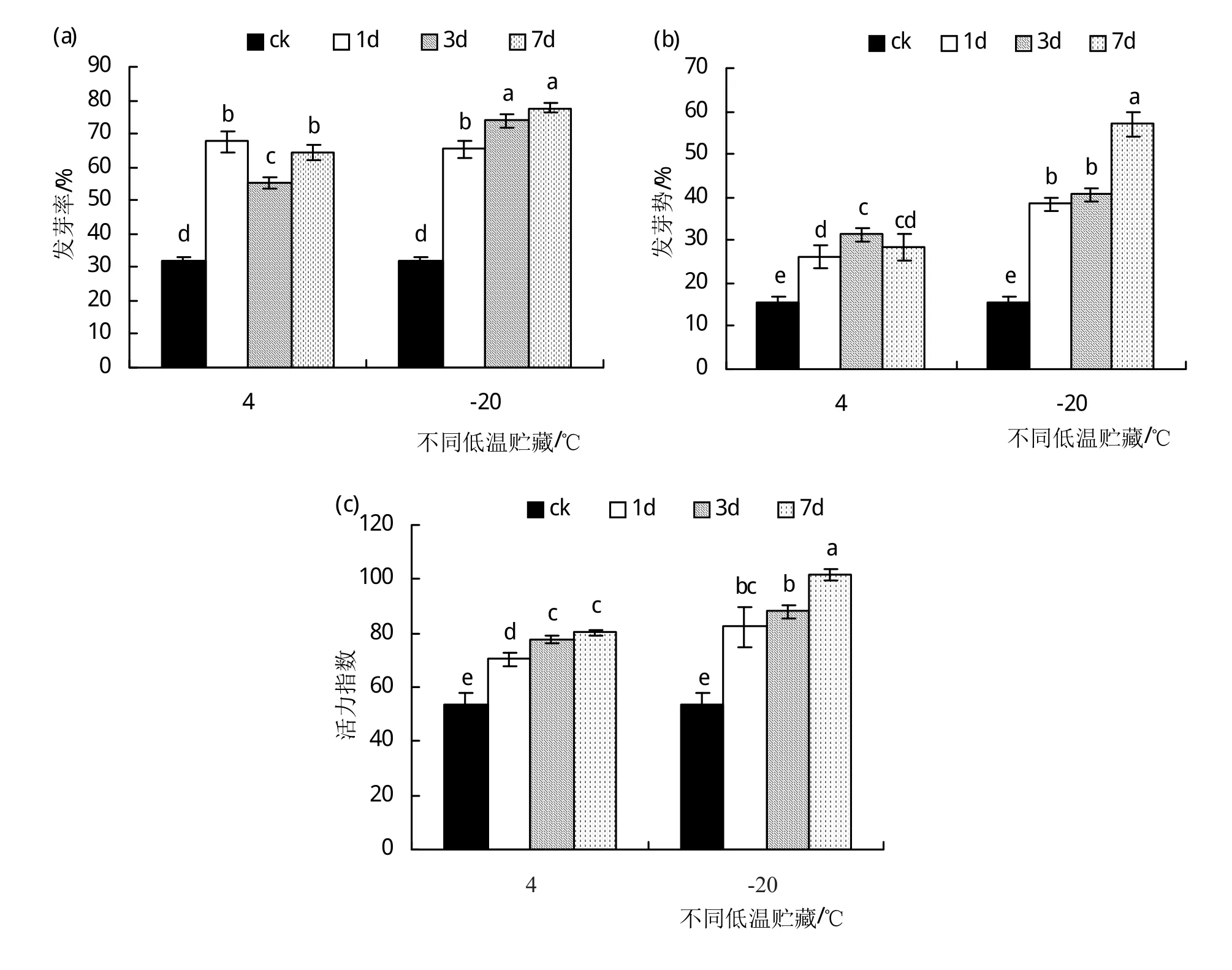
图6 低温贮藏对硬实种子萌发的影响
3 讨论与结论
豆科植物普遍存在种子硬实性。本试验发现:盛冠菜豆硬实种子无论是在百粒重,还是粒长、粒宽、粒厚上都比非硬实种子小。这一结果表明,粒小的种子出现硬实的可能性更大,这与古瑜[12]的结果一致。当盛冠种子含水量为14.28%时,种子硬实率在38%左右,生产上如果不经处理直接播种,田间易大面积出现缺苗或出苗不齐的现象。在周健[13]的研究中表明,机械处理,热水、酸蚀均能较好的解除种子硬实性;此外,程瑶[14]在破除黄芪种子硬实时,采用热沙烫种、激素浸泡处理也能一定程度上破除硬实。考虑到生产上对菜豆种子需求量大,使用机械损伤破除硬实容易伤及胚芽,不利于种子发芽;而酸腐蚀的时间农民不易控制,且操作时不仅会腐蚀种皮也会伤害农民自身;而本试验激素处理的预实验表明,赤霉素浸种对打破菜豆种子硬实效果不大,原因可能是菜豆种皮较厚且致密,短时间的激素浸泡对种皮影响较小,同时,胡晋[15]还指出,硬实不能用激素进行处理,因为这些物质无法透过种皮。
因而,本试验解除种子硬实时选择温水浸种、热水浸种和低温贮藏3种较温和的方式进行。由于本试验目的是筛选出最佳的硬实破除条件,即破除处理及相应的处理时间,而这主要依据硬实破除后种子萌发情况来衡量。温水浸种的结果表明,在50℃和60℃温水浸种60 min以内均能促进种子萌发,且变温浸种与恒温浸种差异不大,这可能是硬实破除只需要打破一瞬间,不需要长期的处理。因而考虑处理时间和处理效果,在60℃恒温浸种30 min对解除种子硬实效果最佳。本研究还发现,70℃浸种除了15 min处理较对照促进了种子萌发以外,时间延长反而促进效果不明显,这可能是70℃浸种60 min处理温度较高,且时间较长,类似于短时间破除种子硬实后,继续用70℃浸种破环种子内部结构,使得种胚损伤无法萌发。这与程瑶[16]在破除黄芪种子硬实时结果一致。热水浸种的结果表明,水温在80℃处理2 min对种子的萌发效果较好,其中,恒温比变温处理效果更好,这可能与种子破除硬实后不适合浸泡在高温环境有关。古瑜等[12]的研究表明,该环境下打破种子硬实仍适合其他品种的菜豆种子;本试验结果还发现,90℃热水浸泡菜豆种子对其萌发效果不利,原因是温度过高,直接使硬实种子失去活力,这与古瑜等[12,16]的研究结果一致。
温水浸种解除种子硬实的原理主要是温度和水同时作用[17-19],促使种皮致密性发生物理变化;但仅用水浸泡硬实种子,短时间内种子吸胀效果不明显,而高温对种子伤害极大,因而,本试验解除种子硬实时还选择了低温贮藏的方式。由于温水浸种与低温贮藏处理的时间间隔较大,因而在低温贮藏时有一个平行对照,但其发芽率比前一对照更高,这可能与种子自身质量有关,试验样本较小,不能确保每次试验种子质量相近。最后低温贮藏结果表明,4℃和-20℃贮藏硬实种子均能一定程度上解除种子硬实,进而促进种子萌发。但是其促进效果远次于60℃浸种30 min,原因可能是,温水处理时种皮在高温环境下热胀冷缩发生物理变化,进而致密性被打破的同时种子还能迅速吸水,而低温贮藏时温度与水是分开作用的,因此,其的硬实种子发芽率相对较低。
综上所述,考虑到菜豆种植的实际情况和硬实破除的最佳效果,对硬实率较高的菜豆种子用60℃恒温浸种30 min后进行播种将会利于种子萌发。
