银杏GbASR基因的克隆、生物信息学及表达分析
2021-12-09谢道龙李虹烨付小侠刘晓霞覃佐东何福林
谢道龙,谭 智,李虹烨,付小侠,王 帆,刘晓霞,3,覃佐东,3,何福林,3,骆 鹰,3
(1湖南科技学院化学与生物工程学院,湖南永州 425199;2湖南大学生物学院,长沙 410082;3湖南省银杏工程技术研究中心,湖南永州 425199)
0 引言
在自然条件下,当植物受到各种不利因素的侵害时,植物可以通过改变形态,关闭或下调一些非必要基因的表达,开启或上调一些抵抗胁迫相关基因的表达等方面来将所受到的伤害尽可能降低。ASR(abscisic acid,stress,ripening-induced)基因作为植物体内一种关键的响应胁迫的调控基因,含ABA/WDS功能域,其长度介于34 aa~284 aa之间,且该基因与果实成熟过程和脱落酸胁迫下的适应性调整密切相关[1]。当ASR1基因首次在番茄(Lycopersicon escdenfum)中被发现后[2],一些ASR基因也随之在其他物种中得到分离鉴定,例如火炬松(Pinus taeda)[3]、盐角草(Salicornia brachiata)[4]和葡萄(Vitis vinifera)[5]等,在拟南芥(Arabidopsis thaliana)中却未找到与ASR相似度较高的基因[6]。许多植物中的ASR基因组成基因家族,如芭蕉属(Musa)的ASR基因成员有4个以上[7],玉米(Zea mays)的ASR成员个数较多,存在9个[8],番茄的ASR成员已被分离的就有5个[9],而葡萄的ASR成员较少,只发现1个[5],这说明各种植物的ASR基因家族成员数量存在差异。目前,有关植物ASR基因应答非生物胁迫的研究发现,转ASR基因的拟南芥能够较好的抵抗各种非生物胁迫如低温、高盐等[10]。香蕉(Musa nana)通过上调MpASR基因的表达而响应甘露醇胁迫,MpASR基因在拟南芥中的过表达能显著增强其对渗透胁迫的抵抗能力[11]。将海蓬子(Salicornia herbacea)SbASR1基因转烟草,用高盐溶液处理过表达株系,发现转基因烟草细胞内的盐浓度较低,其种子生活力较高[12]。Virlouvet等[8]研究发现,玉米ZmASR1基因在应答干旱胁迫时,通过作用于支链氨基酸的合成代谢而使玉米增产。ASR调节植物生长发育过程中糖分子与ABA诱导的信号转导通路也有报道[13];在香蕉雌花中有一个特异性表达的MaASR基因,转基因植株能使开花时间延长[14]。因此,植物ASR基因在调控植物生长发育、生理活动以及应答逆境胁迫方面都具有十分重要的功能。
银杏(Ginkgo biloba)被称为“活化石”,是现存裸子植物中最古老的孑遗植物。在分类上银杏属落叶乔木,其雌花及雄花存在于同一种植物的不同植株上,属国家二级保护植物,具有许多开发利用价值,尤其在生态利用价值和经济价值方面比较突出[15]。近年来,人们对银杏的分子生物学方面有了深入研究,如DNA甲基化修饰位点[16],转录组测序及基因表达谱[17],miRNA的功能鉴定[18-19]及代谢分析[20]等。据报道,中国可供农业生产等方面利用的土地中,有4.88%的盐渍化土壤面积[15]。在冬季,许多地区经常使用NaCl作为融雪剂进行融雪,使得道路两旁银杏树的生长与发育受到阻碍,甚至死亡。本研究对银杏ASR基因进行克隆,分析GbASR蛋白理化性质、空间结构、亚细胞定位及系统进化等,还通过非生物胁迫实验及实时荧光定量PCR分析,对GbASR基因的功能进行初步研究;这为中草药的育种、ASR基因抗逆分子机理及调控网络等研究提供理论依据。
1 材料与方法
1.1 材料
本实验以湖南省永州市桐子坳(地理坐标为26°06′N,111°50′E)的银杏成年植株以及收集同株银杏的种子为实验材料。银杏种子来源于地上自然脱落的果实,将采集的果实置于实验室,待果实在室温下腐烂后去除种皮与果实,用自来水将种子清洗干净后晾干,用湿沙搅拌均匀放置在通风阴凉处,让其自然层积。沙藏期间保持基质的湿润,并取出沙藏种子,用清水洗干净,去除漂浮在水中的种子。选取沉在水底饱满良好的种子,用高锰酸钾溶液(1000 mg/L)消毒15 min,再用无菌蒸馏水冲洗5~6次。最后将处理的种子播种于装有基质的培养盆中,基质的组分的体积比是草炭:蛭石:珍珠岩=1:1:1,基质的pH值保持6.5。培养盆的长、宽、高的规格是650 mm×650 mm×750 mm。培养盆置于温度为35℃人工气候箱中黑暗培养催芽,待银杏种子长出白色嫩芽时,人工气候箱昼夜温度设为28℃/18℃,光照周期为18 h光照/6 h黑暗,空气相对湿度为75%。待银杏幼苗为四叶期时,分别进行高盐、干旱和高温胁迫处理。非生物胁迫处理采取方法为:取健康生长的银杏幼苗分别置于含有300 mmol/L的NaCl溶液模拟高盐胁迫,20%的聚乙二醇(PEG6000)溶液模拟干旱胁迫,以及42℃人工气候箱模拟高温胁迫,以水作为胁迫处理的对照组。非生物胁迫各处理的时间分别为:0 h、6 h、24 h和48 h。每处理3次生物学重复,分别将同一胁迫处理时间采集的银杏幼苗液氮速冻后,置于-80℃冰箱保存备用。
1.2 试剂
TRNzol-A+总RNA提取试剂盒、FastKing cDNA第一链合成试剂盒、SuperReal PreMix Color SYBR Green荧光定量PCR试剂盒、琼脂糖DNA胶回收试剂盒、质粒提取试剂盒及限制性内切酶购于北京天根公司;无缝克隆所需试剂、DH5α感受态细胞、pClone007-T Blunt Vector Kit载体、PCR扩增高保真酶及引物合成购于北京擎科公司;2×CTAB缓冲液购于北京索莱宝公司;pCAMBIA1300-GFP质粒、KpnI、XbaI高保真酶及GV3101农杆菌感受态细胞由武汉大智众成科技有限公司提供。
1.3 RNA提取及cDNA合成
分别称取新鲜银杏幼苗根、茎、叶0.1 g,参考TRNzol-A+总RNA提取试剂盒说明提取总RNA,并置于-80℃冰箱保存备用。取2000 ng总RNA,按照FastKing cDNA第一链合成试剂盒说明反转录合成cDNA第一链,并置于-20℃冰箱保存待用。
1.4 GbASR基因克隆
在NCBI中通过查询银杏GbASR基因(登录号:AY461715.1),并获得银杏GbASR基因的全基因组、CDS及氨基酸序列。利用CTAB法提取银杏幼苗叶片DNA,并以DNA为模板,通过PCR扩增进行克隆。本研究所用具体引物见表1,GbASR基因克隆及pCAMBIA1300-ASR-GFP融合表达载体构建具体过程,参考骆鹰等[21]相关基因克隆操作步骤。

表1 本研究PCR扩增所用引物信息
1.5 生物信息学分析
在对银杏GbASR基因进行生物信息学预测时,利用Expasy ProtParam(https://web.expasy.org/protparam/)进行蛋白理化性质分析;通过Expasy Protscale(https://web.expasy.org/protscale/)进行蛋白亲疏水性分析;通过NCBI中BLAST搜索其他物种的ASR同源蛋白,并利用DNAMAN进行多重比对,最后通过MEGA7.0近邻法(Neighbor joining,NJ)构建系统进化树。
1.6 GbASR蛋白亚细胞定位
通过基因克隆方法获得目的片段,利用KpnI和XbaI酶对质粒pCAMBIA1300-GFP进行酶切,并且把酶切产物与目的片段连接,从而构建pCAMBIA1300-GbASR-GFP融合表达载体。将冻存的GV3101农杆菌种复苏,并制备好感受态细胞。将融合表达载体转入GV3101感受态细胞,涂板,挑选阳性单克隆进行菌落PCR。将阳性单克隆菌液送北京擎科公司测序,参考DNA质粒抽提试剂盒(TIANGEN,Beijing)说明书从测序无误的阳性单克隆菌液中提取质粒。将含有pCAMBIA1300-GbASR-GFP融合表达载体的菌液进行培养、然后进行烟草侵染实验以及共聚焦显微镜观察,具体过程参考谢旻等[22]有关亚细胞定位操作步骤。
1.7 GbASR基因表达分析
通过方法1.1样品处理及采集和1.2 RNA提取及cDNA合成分别获得银杏幼苗根、茎、叶的总RNA和cDNA,用于GbASR基因表达分析。通过高盐、干旱和高温非生物胁迫处理,以抽提银杏幼苗叶片总RNA和反转录获得的cDNA为模板,利用qRT-PCR检测逆境胁迫下GbASR表达量情况。qRT-PCR的总反应体系、扩增条件、样品处理及相对表达量的计算方法参考骆鹰等[21]相关基因表达实验操作方法及步骤。
2 结果与分析
2.1 银杏叶片组织总RNA抽提及GbASR基因克隆
本研究对银杏叶片组织总RNA进行抽提,结果获得比较完好的带型(图1A),该实验抽提的RNA比较完整,DNA和蛋白污染程度小,可用于后续的反转录实验。利用CTAB法提取银杏叶片组织DNA,用1.0%琼脂糖凝胶电泳检测银杏GbASR目的片段扩增产物,发现DNA条带是单一的,片段产物为546 bp,介于500~750 bp之间,这与本研究所设计扩增目的片段大小相符合(图1B)。根据克隆相关步骤将目的片段与酶切后的线性载体连接,转化至DH5α感受态细胞,涂板,挑选阳性单克隆进行菌落PCR及电泳检测(图1C),将阳性菌液送公司测序,从而获得所需GbASR基因重组载体。
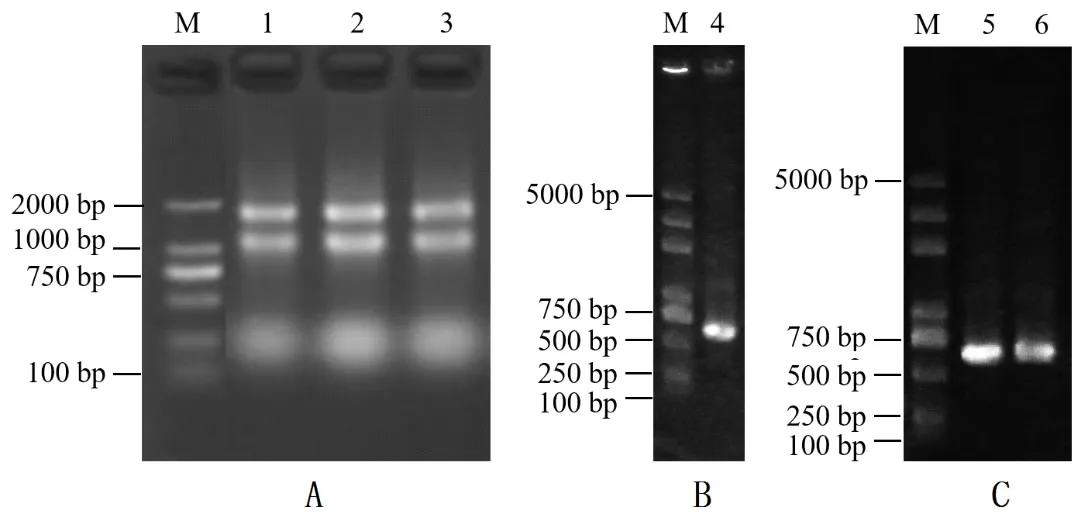
图1 银杏叶片组织总RNA提取及GbASR基因PCR扩增电泳图
2.2 GbASR蛋白质理化性质及结构分析
通过在线程序Expasy Protparam和Expasy Protscale分析银杏GbASR蛋白的理化性质,结果发现,GbASR蛋白的分子式为C861H1254N252O301S5,原子总数为2673个,分子量为20111.24Da,理论等电点(PI)为5.33,消光系数在280 nm时为22350;正电荷残基(Arg+Lys)19个,负电荷残基(Asp+Glu)38个,不稳定系数为39.14,这表明该蛋白是酸性稳定蛋白。蛋白脂肪参数为28.73,总平均亲水性参数(GRAVY)为-1.390,推测该蛋白属于亲水性蛋白。
2.3 GbASR同源蛋白序列及系统发生树分析
通过GbASR蛋白氨基酸序列在NCBI数据库中进行BLAST,下载GeneBank收录的11个物种ASR蛋白氨基酸序列,通过DNAMAN软件分析序列比对结果,并利用MEGA7.0构建系统发生树,结果表明,不同植物间ASR氨基酸序列相似性比较高,ASR蛋白在序列结构上均含有1个高度保守ABA/WDS功能结构域和2个组氨酸基序His-motif(图2)。银杏ASR蛋白(Ginkgo biloba AAR23420.1)的氨基酸序列与火炬松(Pinus taeda AAB03388.1)的相似性较高,为70.09%,在进化树中属于同一个分支(图3),这可能是因为它们同属于裸子植物,其亲缘关系较近。银杏ASR蛋白与其他植物的相似性介于61.87%~81.01%之间,相似性差异范围比较小,说明存在于不同植物中的ASR蛋白在长期进化过程中能保持相对稳定,表现出高度保守,因此,在不同物种中ASR蛋白呈现出多样性。

图2 GbASR蛋白与其他植物ASR蛋白序列比对

图3 不同植物ASR蛋白氨基酸序列构建的系统进化树
2.4 GbASR蛋白亚细胞定位分析
将克隆获得的GbASR基因与酶切后的pCAMBIA1300-GFP载体连接,构建pCAMBIA1300-GbASR-GFP融合表达载体,并利用农杆菌介导将融合表达载体注入烟草叶片下表皮,在显微镜观下察发现(图4),转入空载体pCAMBIA1300-GFP的对照组烟草叶片表皮细胞中均分布比较强的绿色荧光信号,而融合表达载体中的荧光信号只分布在烟草叶片表皮细胞的细胞核中,这说明银杏GbASR蛋白定位于细胞核,与GbASR作为转录因子的功能相符合。
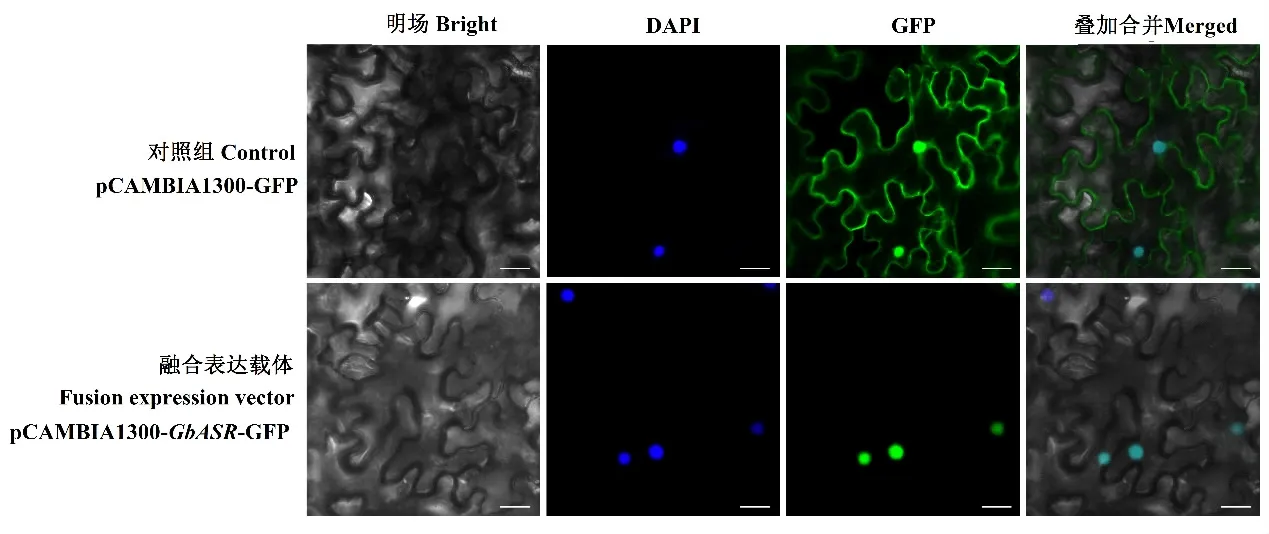
图4 GbASR蛋白亚细胞定位分析
2.5 GbASR基因的表达分析
为探究GbASR基因在银杏幼苗根、茎、叶部的表达情况,以及响应高盐、干旱及高温逆境胁迫的表达情况,本研究通过qRT-PCR检测GbASR基因表达水平。研究发现,GbASR基因在银杏幼苗根、叶、茎部都有表达,且GbASR在叶部的表达水平相对较高,其次是茎部,而表达量最低是在根部(图5A)。GbASR基因显著受高盐诱导,在盐胁迫处理3 h时,其表达明显增加,6 h时表达处于最低水平,然后呈上升趋势,在24 h时其表达量最高(图5B)。在干旱胁迫下,GbASR基因的表达呈先上升后下降,再上升的趋势,在胁迫处理3 h时,其表达量最高(图5C)。高温胁迫下,GbASR基因的表达趋势为先下降再逐步上升,当12 h时达到最高,随后下降,再上升的波动趋势(图5D)。通过非生物胁迫实验可以推测,银杏GbASR基因的表达显著受盐、干旱胁迫诱导,且在3 h时表达明显增加。
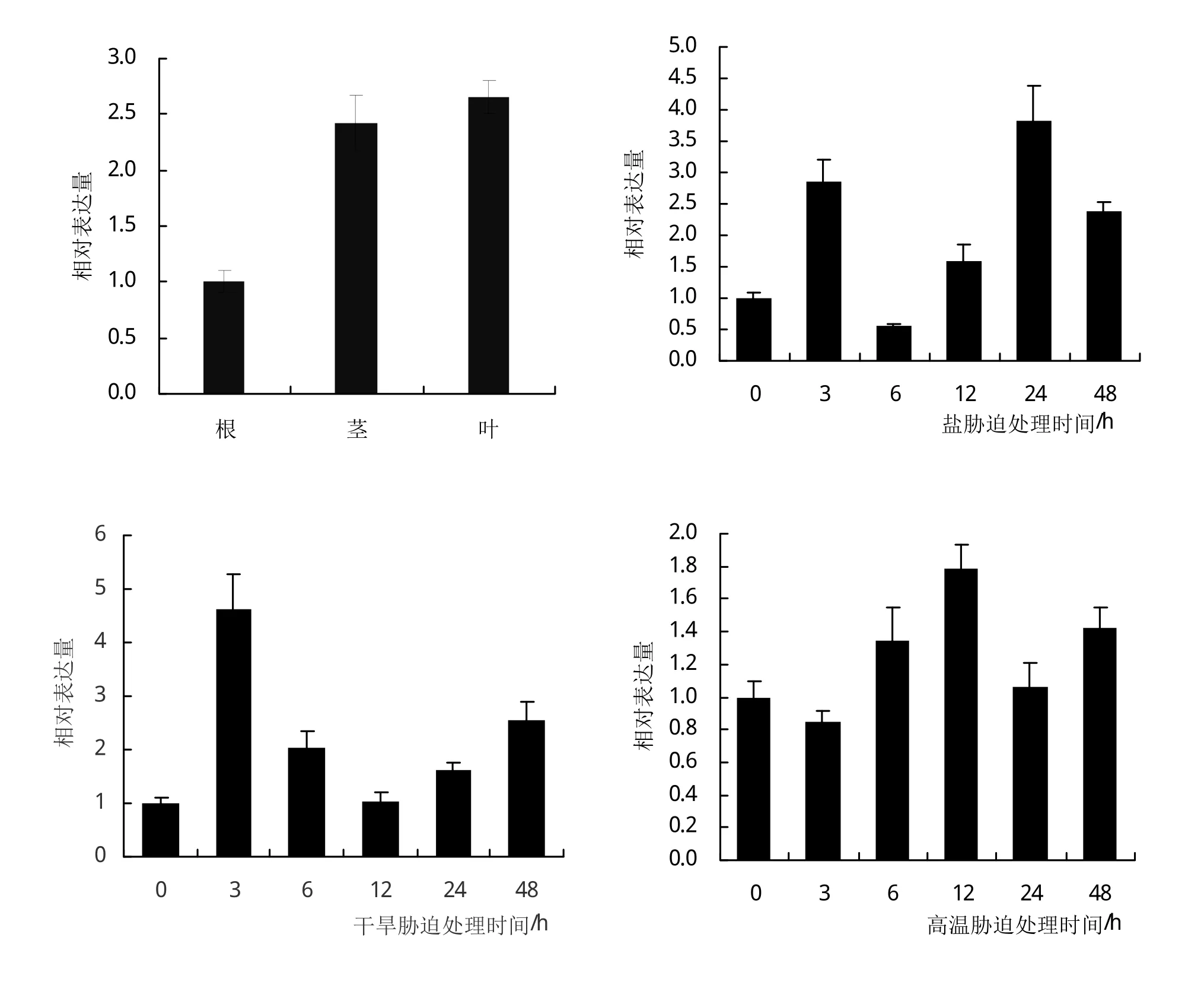
图5 GbASR基因组织特异表达及响应非生物胁迫的表达分析
3 讨论与结论
ASR基因是植物中发现的一类主要参与果实成熟、应答逆境胁迫的基因,当植物受到逆境胁迫时(如高盐、干旱、高温、低温、渗透、ABA胁迫等),ASR基因会被诱导表达,从而降低或消除环境胁迫对植物细胞引起的伤害。因而,本研究对银杏ASR基因进行克隆、蛋白氨基酸序列及非生物胁迫下基因表达分析,这有利于阐明植物抵御不良环境的机理研究。
本研究利用无法克隆技术和生物信息学分析方法,从银杏幼苗叶片中成功克隆ASR基因,该基因编码区全长546 bp,编码氨基酸的长度为182 aa;GbASR蛋白为亲水性蛋白,其原因可能是由于该蛋白组成含有组氨酸等亲水性氨基酸,这与糜子(Panicum miliaceum)、木薯(Manihot esculenta)中发现ASR蛋白的氨基酸组成相似[23-24]。通过与其他植物的ASR蛋白氨基酸序列进行多重比对,结果发现GbASR蛋白中含有1个高度保守ABA/WDS功能结构域和2个组氨酸区域,说明银杏GbASR蛋白具有其他植物ASR蛋白家族的典型特点。进化关系分析表明银杏GbASR蛋白与火炬松的ASR蛋白聚为一类,这验证了银杏与火炬松同属于裸子植物,具有较近的亲缘关系。已有研究显示,ASR蛋白主要分布于细胞核或细胞质,有的还分布于叶绿体中[25],本研究银杏GbASR蛋白亚细胞定位于细胞核,这与葡萄[25]、百合(Lilium longiflorum)花粉[25]、厚藤(Ipomoea pes-caprae)[26]ASR蛋白亚细胞定位结果一致,推测GbASR作为转录因子在细胞核中发挥功能。
植物在应答非生物胁迫(如高盐、干旱、低温等)、生长、发育等过程中通常会涉及ABA依赖/非依赖信号传导途径,而且利用渗透感受器感知周围逆境胁迫信号,通过CDPKs、MAPK等信号途径传递信息,最终引起相关基因表达[27]。据报道,ASR蛋白能够增强植物的耐逆能力,主要体现在三个关键方面,一是植物ASR蛋白含有丰富的组氨酸成分,能够与Fe3+或Cu2+等金属离子结合,从而减少氧自由基产生,使游离于细胞中重金属离子含量降低,减少对细胞的破坏[28]。二是植物ASR蛋白属于无序蛋白,与植物中LEA蛋白具有相似的特征,可以在各种逆境胁迫环境下直接参与保护细胞,防止靶蛋白聚集,使蛋白质活性不发送改变。三是植物ASR蛋白能发挥转录调控作用,如果与Zn2+结合,其蛋白构象则发生变化,ASR蛋白的α螺旋和β折叠比例增加,形成二聚体,可以与DNA发生结合,发生转录调控作用[29]。本研究对银杏GbASR基因进行组织特异性表达模式分析,发现该基因在银杏幼苗根、茎和叶中呈组成性表达,且在茎、叶中表达比在根中表达更强烈。通过盐、干旱及高温胁迫处理下的表达分析,发现盐胁迫下该基因的表达水平呈现先上升后下降,再上升又下降的波动趋势,在胁迫24 h时,其表达量增加到对照(0 h)的4倍左右;干旱胁迫下,GbASR基因则呈现先上升后下降再上升的趋势,在干旱胁迫3 h时,其表达量增加到对照(0 h)的4.5倍左右;高温胁迫下,GbASR基因则呈现先下降后上升,再下降又上升的波动趋势。上述结果表明GbASR基因在高盐、干旱及高温胁迫下被诱导表达,该基因在抵御不良环境可能发挥重要调控功能,这与ASR基因在木薯中的功能报道相一致[28]。研究表明,水稻OsASR1蛋白能够作为分子伴侣,具有清除活性氧的功能,从而增强水稻的抗逆性[30]。在酵母中过表达的厚藤IpASR不仅能够增强对盐胁迫的耐受性,还可以提高对氧化胁迫的耐受性[26]。
本研究利用无缝克隆技术对银杏ASR基因进行了克隆,并获得ASR基因编码区全长546 bp,共编码182个氨基酸;通过亚细胞定位及生物信息学分析发现银杏GbASR蛋白定位于细胞核,并为亲水性稳定蛋白;通过qRT-PCR发现GbASR基因在银杏叶片部位相对表达量最高,且受高盐、干旱及高温胁迫诱导,这些逆境胁迫研究为进一步明确银杏ASR基因的功能奠定基础,同时为中草药的育种、ASR基因抗逆分子机理等研究提供理论依据。
