海洋动物中褪黑素信号系统的研究进展
2021-12-09冯佳倩王天明杨静文
冯佳倩, 王天明, 2, 杨静文, 2
海洋动物中褪黑素信号系统的研究进展
冯佳倩1, 王天明1, 2, 杨静文1, 2
(1. 浙江海洋大学 海洋科学与技术学院, 浙江 舟山 316022; 2. 浙江海洋大学 海洋生物种质资源发掘利用国家地方联合工程实验室, 浙江 舟山 316022)
褪黑素是神经内分泌调控的关键激素之一, 具有重要的生理功能, 在改善睡眠、调节生殖、延缓衰老等生理过程中起到不可或缺的作用, 其功能机制研究亦较为成熟。本文综述了褪黑素和褪黑素受体的基本特征, 特别关注褪黑素受体介导的信号转导特征; 总结了其海洋生物中的褪黑素信号系统研究现状和面临的挑战, 并对海洋生物开展该信号系统研究的理论价值及应用前景进行展望, 以期为进一步探明海洋鱼类及无脊椎动物中褪黑素及其受体的信号转导特征和生理功能提供一定的线索, 为褪黑素信号系统进化演变的探讨提供一定的理论参考。
褪黑素; 褪黑素受体; 信号转导; 信号系统; 海洋动物
1 褪黑素概况
1.1 褪黑素的分泌与合成
褪黑素是一种含吲哚环的化合物, 化学名为N-乙酰-5-甲氧色胺[1]。McCord和Allan于1917年发现了一种可以使蟾蜍皮肤颜色变浅的生物活性物质, 由此开启了褪黑素的研究之路[2]。1958年, Lerner等人首次从牛松果体(pineal gland)中分离并纯化该活性物质, 因其具有使蝌蚪肤色变浅的作用而正式命名该物质为褪黑素[3], 并于1959年鉴定了褪黑素的化学结构[4]。对于脊椎动物, 尤其在哺乳动物中, 褪黑素主要由神经内分泌器官松果体产生, 松果体响应视网膜接收的明/暗信息分泌褪黑素并将其迅速释放进入血液, 经血液循环分布到整个机体并对各个靶器官、组织和细胞发挥作用[5-6]。在鱼类中, 褪黑素也可以在其他一些组织和细胞中局部产生, 如视网膜、消化道和肝脏等[7-9]。例如, 在金鱼()中, 褪黑素可以在视网膜感光细胞和胃肠道组织中合成, 且在一定程度上受环境因子(如光周期和温度)的调控[10]。
在哺乳动物大鼠松果体细胞中, 褪黑素合成的神经传递过程受神经系统(起源于下丘脑室旁核)的控制, 该神经元发出的轴突到达脊髓第一节胸段的节前交感神经元, 随后, 脊髓第一节胸段的节前交感神经元发出的轴突到达颈上神经节节后交感神经元, 从而形成神经纤维到达松果体的实质细胞, 触发节后交感神经末梢释放去甲肾上腺素并通过渗透方式与松果体细胞膜上的α和β去甲肾上腺素受体相互作用, 通过激活cAMP-PKA-CREB和PLC-Ca2+-PKC通路, 引发褪黑素合成[11](图1)。例如在圆尾金翅雀鲷()中, 蓝光刺激(在435~475 nm光谱范围内)能够激活其视网膜光感神经节细胞中的黑视蛋白, 最终抑制褪黑素的合成[12]。褪黑素在人及大部分动物中的化学合成以血液中获取的色氨酸起始, 色氨酸在色氨酸羟化酶的作用下转化为5-羟色氨酸, 然后再转化为5-羟色胺, 随之乙酰化, 由5-羟色胺-N-乙酰转移酶(AANAT)转化为N-乙酰-5-羟色胺(NAS), 再由羟化-O-甲基转移酶(ASMT)转化为褪黑素[13](图1); 其中, AANAT和ASMT为该过程的限速酶[14]。有研究发现, 在三刺鱼()和欧洲鲈鱼()中, AANAT和ASMT是褪黑素合成的关键酶[15-16]。
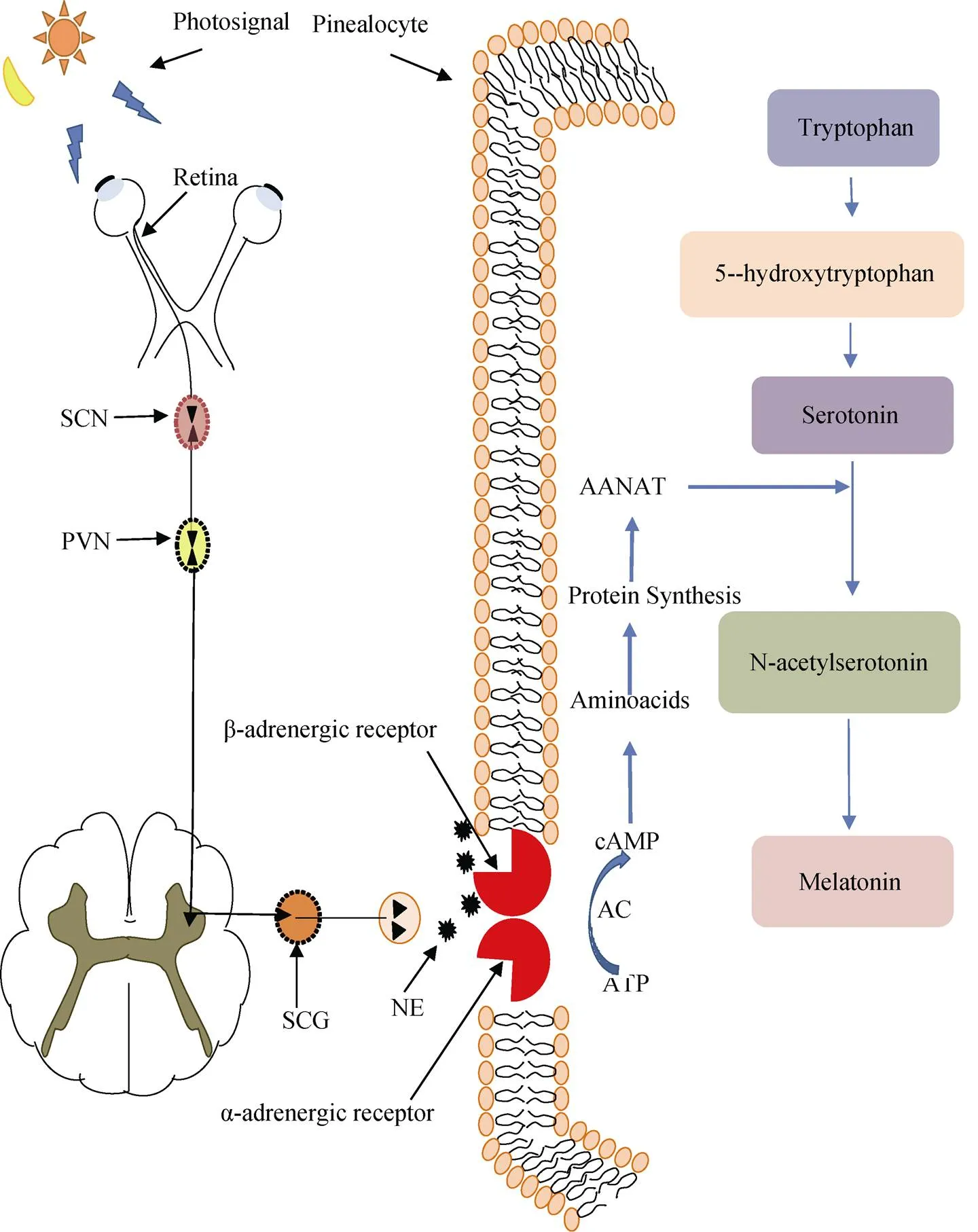
图1 从视网膜到松果体细胞的神经通路及褪黑素的合成路径
注: SCN: 视交叉上核; PVN: 室旁核; SCG: 颈上神经节; NE: 去甲肾上腺素; α-adrenergic receptor: α-肾上腺素受体; β-adrenergic receptor: β-肾上腺素受体; ATP: 三磷酸腺苷(adenosine triphosphate); cAMP: 环腺苷酸(cyclic adenosine monophosphate); AC: 腺苷酸环化酶(adenylate cyclase); Aminoacids: 氨基酸; Protein Synthesis: 蛋白质合成; AANAT: 芳烷基胺N-乙酰转移酶; Tryptophan: 色氨酸; 5-hydroxytryptophan: 5-羟基色氨酸; Serotonin: 五羟色胺; N-acetylserotonin: N-乙酰5-羟色胺; Melatonin: 褪黑素; Photosignal: 光信号; Pinealocyte: 松果腺细胞
1.2 褪黑素的生物学特征
1.2.1 褪黑素的生理特性
机体内褪黑素浓度水平具有独特的昼夜和季节性节律波动, 该波动受控于外界环境因子(主要为光周期和温度)周日或周年变化, 与生物体各种生理活动和行为同步, 进而影响生物个体及种群的环境生态适应。在大多数脊椎动物中, 褪黑素的日常分泌规律是相对保守的, 褪黑素浓度一般在白天最低, 晚上最高; 同时冬季夜间高浓度周期比夏季持续时间更长[17]。这种浓度变化节律具有一定的恒定性, 在海洋无脊椎动物中也同样存在。研究表明软体动物章鱼()和节肢动物大西洋砂招潮蟹()的褪黑素水平存在昼夜节律性, 其含量在夜间可达到峰值[18-19]。然而, 随着研究不断拓展和深入, 近年来有研究发现某些鱼类褪黑素浓度水平在白天较高, 或者在昼夜之间没有明显差异。例如, 红鳟()视网膜中褪黑素在白天而不是在夜间增加[20]; 欧洲鲈鱼()眼部和血浆褪黑素浓度在秋季和冬季白天达到高峰, 但在夏季和春季未发现明显变化[21]。这些物种特定的褪黑素节律变化与物种本身的生理生态适应高度契合, 并具体影响特定的生理和行为过程。例如, 在斑马鱼()中, 褪黑素可促进其夜间睡眠的启动和维持[22-23]。
然而, 褪黑素分泌受环境因子(如光周期和温度)影响, 通过响应环境因子的变动, 对生殖发育等重要生理过程进行调控。例如, 鱼类可直接受到外部温度和昼夜及光照季节性波动影响, 松果体褪黑素神经元细胞中AANAT酶活性受到上游信号传导调控发生改变, 进而调节褪黑素的合成与分泌[24]。目前研究认为, 光周期可控制褪黑素浓度节律的持续时间, 而环境温度则决定了褪黑素浓度节律的振幅。例如, 与较短光照时长相比, 较长的光照时间增加了欧洲鲈鱼()血浆褪黑素浓度升高的时间[21]; 且在菱纹背响尾蛇()中, 低于或高于25 ℃的温度降低了褪黑素浓度节律的振幅[25]。因此, 环境光周期和温度综合影响褪黑素合成与分泌节律, 形成褪黑素的昼夜或季节性变化, 进一步实现对生物体繁殖活动等生理行为的调控。例如, 绿海龟()的夜间繁殖活动与褪黑素昼夜节律相关[26]; 塞内加尔鳎()的血浆褪黑素年度节律在光周期或水温调控下发生变动, 进而调控其季节性生殖[27]。
1.2.2 褪黑素的分子特性
褪黑素是部分亲水性和高亲脂性的化合物, 能与羟自由基和过氧自由基发生反应而迅速扩散到细胞和线粒体中, 其独特的化学特性, 有助于其实现生理及细胞水平的功能活性。例如, 褪黑素扩散至细胞质中, 位于线粒体膜中的转运蛋白1和2(PEPT1/2)帮助褪黑素主动转运进入线粒体[28], 可导致线粒体中的褪黑素比其他常规抗氧化剂浓度高几百倍, 行使线粒体靶向抗氧化剂的功能[29]。线粒体受到损伤会产生大量活性氧(ROS), 而这些ROS争夺周围正常分子的电子后会变成不稳定的自由基, 进而大量“歼灭”其他功能分子, 导致细胞进入异常状态[30]。由于褪黑素结构稳定, 不易发生氧化还原反应, 且其吲哚环上的两个基团(5-甲氧基和N-乙酰基)是清除ROS的必须基团: 其一, 5-甲氧基可增强褪黑素捕获自由基的能力; 其二, N-乙酰基可保护褪黑素免受单胺氧化酶的降解[31]。因此, 线粒体中积聚的褪黑素提高了细胞抵抗氧化应激和细胞凋亡的能力, 从而保障生物个体正常生命活动[32]。近年来, 褪黑素的这一靶向生理作用在水生动物研究中也逐步开展, 在黄尾小丑鱼()[33]等脊椎动物以及中华绒螯蟹()[34]等无脊椎动物中, 褪黑素都以其具有的独特化学特性而发挥强抗氧化剂的作用。
综上所述, 褪黑素的合成与分泌受到各种环境因子的影响, 是生物节律调控的重要神经内分泌因子; 由于其特殊的分子特性和靶器官的多样性, 使得褪黑素的生理功能更为多样和复杂。褪黑素在组织中的广泛分布以及褪黑素受体在组织细胞中正确表达, 是其各类功能实现的前提, 随着褪黑素受体研究的不断深入, 褪黑素生理功能的调控机制被进一步阐释。
2 褪黑素受体基本特征
2.1 褪黑素受体类型及表达分布
褪黑素通过激活特定的靶细胞表面受体而发挥生理功能, 这类受体属于G蛋白偶联受体(G protein- coupled receptor, GPCR)家族, 是一类具有典型7次跨膜结构的细胞膜蛋白[35-36]。1994年, 研究者从非洲爪蟾()中克隆出第一个褪黑素受体Mel1c(MT3、MTNR1C)[37], 随后克隆出人类第一个褪黑素受体Mel1a(MT1、MTNR1A)[38]和第二个褪黑素受体Mel1b(MT2、MTNR1B)[39]。目前, 通过生物功能验证及生物信息学预测研究, 认为褪黑素受体家族由能与褪黑素结合的Mel1a、Mel1b和Mel1c以及孤儿受体GPR50组成[40]。其中GPR50被认为是Mel1c的哺乳动物同源基因[41], 但因其无法与褪黑素结合, 目前也未发现其他配体而被归类为孤儿受体。近年来的研究发现, GPR50可通过与Mel1a和Mel1b作用, 以异二聚体形式影响细胞信号转导, 从而行使褪黑素信号系统调控功能[42]。在人类中, GPR50由位于X染色体(Xq28)上的基因编码[43], 主要在垂体中间部、下丘脑和海马体中表达[36], 研究表明, 高表达的GPR50具有抗增殖作用并降低肿瘤生长速度[44]。
目前, 有关海洋动物的褪黑素受体研究仍处于起步阶段, 在海洋鱼类中, Mel1a、Mel1b和Mel1c均有预测发现和鉴定[45-48]; 而在无脊椎动物(如腔肠、软体和棘皮动物等)有大量预测候选基因, 但尚未见功能鉴定研究报道; 而GPR50也主要存在于海洋哺乳动物(如海豚和鲸鱼类)中(表1)。随着海洋生物生理生态学研究的不断深入, 褪黑素信号系统(特别是褪黑素受体)的鉴定及调控机制研究已成为迫切需要开展的工作。
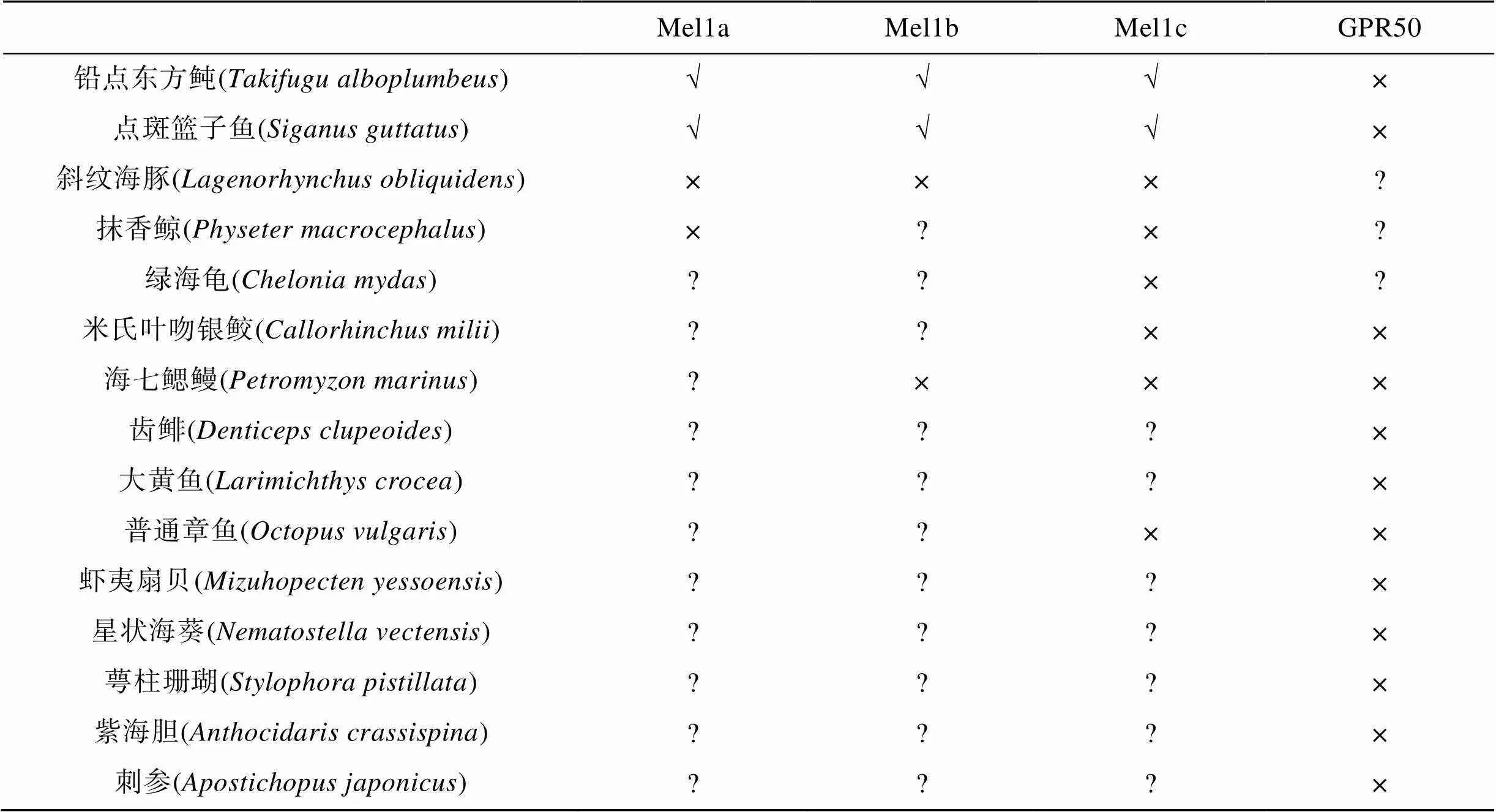
表1 褪黑素受体亚型及其在海洋动物中的分布情况
注: √表示已鉴定, ×表示未发现, ?表示序列已有预测、未进行生理功能鉴定
2.2 褪黑素受体基因序列基本特征
目前研究报道的所有褪黑素受体(包括Mel1a、Mel1b、Mel1c以及GPR50)均为G蛋白偶联受体, 具有7个跨膜α-螺旋结构域[49]。其中哺乳动物的GPR50较为特殊, 其氨基酸序列与人的Mel1a和Mel1b具有约45%的同源性, 包括一个超过300个氨基酸的长胞内C末端, 并且其胞外N末端以及预测的细胞外环中都没有可用于N-糖基化修饰的共有位点[36], 这种结构特殊性可能导致了其无法直接和褪黑素结合进而无法直接介导由此引起的信号转导[50]。褪黑素受体氨基酸序列同源性分析结果显示, 同亚型受体成员之间的氨基酸序列相似性为65%~96%[51], 而三种亚型受体成员Mel1a、Mel1b和Mel1c之间的氨基酸序列相似性也较高, 大约为60%[39, 52]。在特征性结构域方面, 已知褪黑素受体氨基酸序列包括存在于第3个跨膜结构域和第2个细胞内环处的NRY基序, 以及紧跟在NRY下游的C(C/Y)ICHS基序和位于第七跨膜结构域中的NAXXY基序[53]。此外, 在点斑篮子鱼()Mel1c受体基因序列中, 在第2和第4个跨膜结构域氨基末端还具有2个用于N-糖基化的共性位点(NXS/T), 以及在羧基末端中2个蛋白激酶C磷酸化的结合位点(S/TXR/K)[47]。人类褪黑素NRY基序结构域功能研究结果显示, 其天冬酰胺残基对于该受体蛋白结构及信号转导活性具有重要影响[54]。这些褪黑素受体序列和结构的基本特征的研究结果, 为在低等海洋生物中运用生物信息学分析方法查找和筛选褪黑素受体提供了重要参考。
3 褪黑素受体介导的细胞信号转导特征
GPCR是迄今为止了解并应用最广的受体家族, 而褪黑素受体作为该受体家族其中一员, 具有GPCR普遍具有的结构和功能特征: 当配体与GPCR胞外结构域特异性结合后, 受体发生构象改变, 介导膜内结构偶联的G蛋白复合体解离为α、β、γ亚基, 并激活胞内其他下游信号因子[55-56]。根据G蛋白α亚基传递信号的选择性, GPCR大致可分为Gαi/o型、Gαs型以及Gαq/11型等。褪黑素受体Mel1a和Mel1b对天然配体都表现出高亲和性, 两者均介导Gαi/o激活的信号通路, 主要信号途径涉及腺苷酸环化酶(AC)活性的减弱和由此引起的第二信使环磷酸腺苷(cAMP)细胞内水平的降低(如图2所示); 而由于Mel1c主要存在于非哺乳动物中, 其介导的细胞信号转导研究较少, 机制尚不明确。
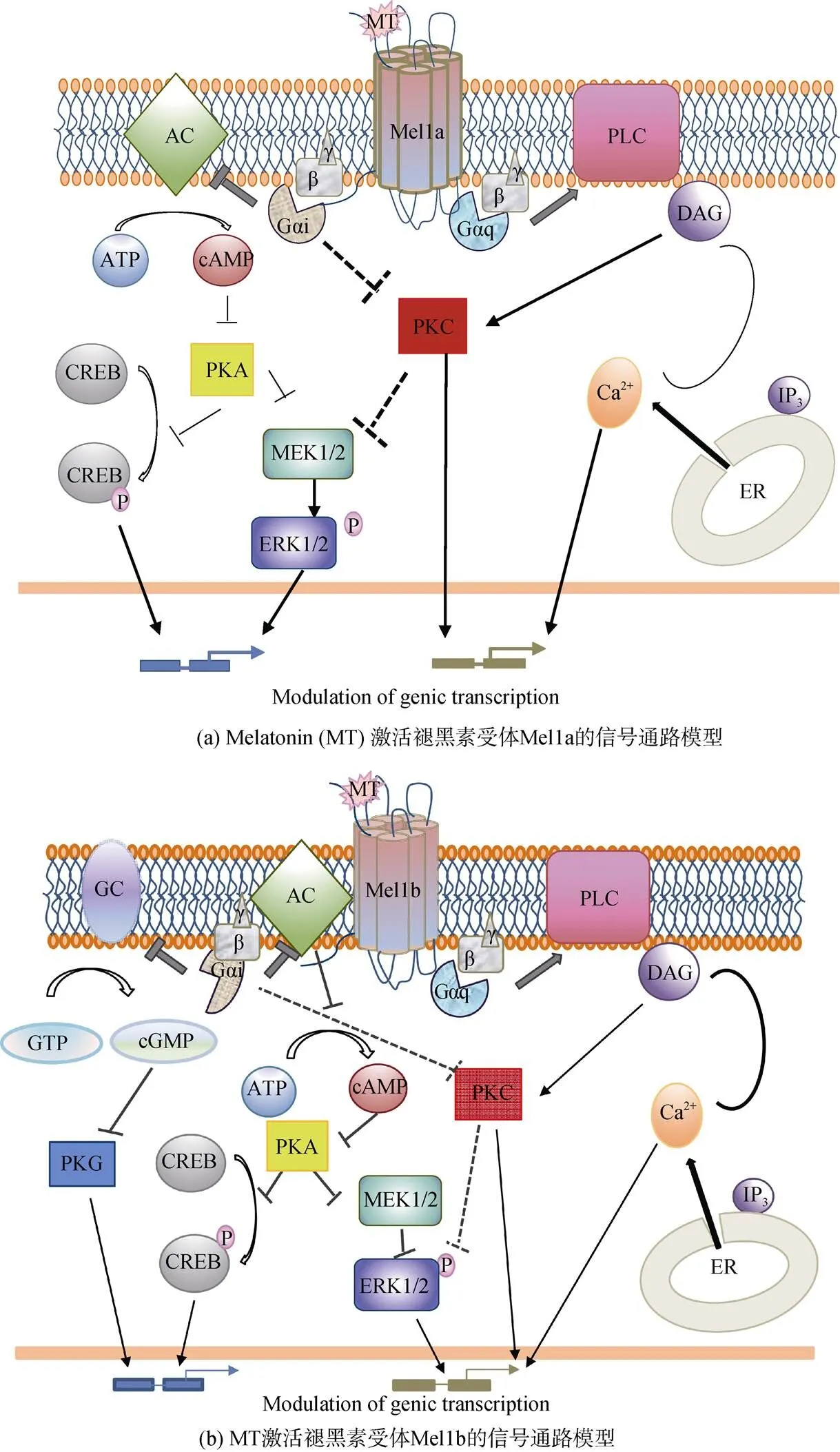
图2 MT激活褪黑素受体Mel1a/Mel1b的信号通路模型
注: PLC: 磷酯酶C(phospholipase C); AC: 腺苷酸环化酶(adenylate cyclase); ATP: 三磷酸腺苷(adenosine triphosphate); cAMP: 环腺苷酸(cyclic adenosine monophosphate); PKA: 蛋白激酶A(protein kinase A); ERK: 细胞外信号调节激酶(extracellular signal-regulated kinase); MEK: 促分裂原活化蛋白的磷酸激酶(mitogen-activated protein kinase kinase); CREB: cAMP响应元件结合蛋白(cAMP-response element binding protein); PKC: 蛋白激酶C(protein kinase C); DAG: 二酰甘油(diacylglycerol); IP3: 三磷酸肌醇(inositol triphosphate); ER: 内质网(endoplasmic reticulum); GC: 鸟苷酸环化酶(guanylyl cyclase); GTP: 三磷酸鸟苷(guanosine triphosphate); cGMP: 环磷酸鸟苷(cyclic guanosine monophosphate); PKG: 蛋白激酶G(protein kinase G); P: 在图中代表磷酸化
3.1 Mel1a细胞信号转导特征
据目前相关研究表明, Mel1a所介导的信号转导通路, 主要通过以下途径执行(图2 a)[57-58]: Mel1a与褪黑素结合激活偶联的Gαi/o蛋白, 抑制AC活性, 降低细胞内第二信使cAMP浓度水平, 从而抑制蛋白激酶A(PKA)、转录因子CREB和胞外信号调节激酶1/2(ERK1/2)的激活, 实现调控下游基因的表达; 与Gαi/o的共同解聚的Gβ/γ亚基也参与蛋白激酶C(PKC)/ MAPK通路的激活[40]。此外, 近年来, 有研究报道显示[59], Mel1a可通过与Gαq蛋白偶联, 激活细胞膜上的磷脂酶C(phospholipase C, PLC), 催化PIP2生成二酰甘油(diacylglycerol, DAG)和三磷酸肌醇(inositol triphophate, IP3), 并增加细胞内钙离子(Ca2+)水平同时激活PKC。
3.2 Mel1b细胞信号转导特征
与Mel1a介导的信号转导通路相似, Mel1b同样可与Gαi/o蛋白偶联, 介导ERK1/2信号通路[60]; 同时, Mel1b还可通过鸟苷酸环化酶(guanylate cyclase, GC)途径调节胞内环磷酸鸟苷(cGMP)浓度水平, 进而调控蛋白激酶G(protein kinase G, PKG)的活化[61]; 例如, 在鲫鱼视网膜中的研究发现, Mel1b的激活可介导cGMP通路, 增强视网膜视杆细胞活动[62]。此外, Mel1b亦可与Gαq/11蛋白偶联, 激活PLC、增加胞内Ca2+水平, 同时活化PKC通路[63], 促进下游信号传递, 以此调控基因表达(图2 b)。
3.3 Mel1c细胞信号转导特征
目前对于Mel1c介导的细胞信号转导的研究较少, 其介导的信号通路及其在机体各种生理活动中的调控机制还有待进一步发掘。目前, 有相关研究结果表明, 原鸡()Mel1c受体可通过激活细胞内Gαq/11/PKC/ERK信号通路介导单色绿光刺激的类胰岛素生长因子-I(IGF-I)合成[64]; 而在非洲爪蟾()中发现, 激活的Mel1c受体一方面可以活化磷脂酰肌醇3-激酶(PI3K), 进而直接或间接通过丝裂原活化蛋白激酶(MAPK)激活磷酸二酯酶(PDE), 另一方面偶联Gαi/o蛋白, 抑制AC活性, 两者协同作用诱导黑色素细胞聚集[65]。这些研究结果初步证明了Mel1c细胞水平的活化, 并进一步探究、确定Mel1c信号转导通路提供了重要线索。
4 褪黑素信号系统功能的研究进展
褪黑素作为内源性神经内分泌激素, 主要合成于松果体等神经组织, 并经扩散或血液循环运输而广泛分布和作用于机体各器官, 执行众多的生理调控功能[66]。褪黑素信号系统由褪黑素及其受体组成, 褪黑素受体是褪黑素功能实现的基础, 褪黑素信号系统则是褪黑素生理功能实现的关键, 而褪黑素受体的类型和表达分布特征对褪黑素信号系统执行生理调控功能具有重要意义。目前, 对褪黑素信号系统功能的研究主要聚焦于昼夜节律、生殖及衰老的调控机制。
4.1 褪黑素信号系统参与调节昼夜节律
节律, 是生命体各种生理过程自然的、内源性的波动, 其中以24 h左右为周期的变动节律被称为昼夜节律[67]。通常认为, 下丘脑视交叉上核(SCN)是控制哺乳动物许多内分泌生理活动的内源性主时钟[68], 且内分泌昼夜节律依赖于SCN和松果体之间的神经联系: SCN通过多突触途径(包括室旁核的自主神经元, 脊髓中的交感神经节前神经元和上颈神经节的去甲肾上腺素能神经元)控制哺乳动物松果体中褪黑素合成的昼夜节律, 褪黑素昼夜变化传递内部的时钟信号, 通过靶细胞和靶组织中受体的信号转导, 调控下游信号因子, 参与调节具体生理活动的昼夜节律[69]。不同于哺乳动物, 斑马鱼体内尚未解剖分析到明显的SCN结构, 但其松果体中, AANAT2活性和褪黑素分泌呈现昼夜节律变化, 且这种昼夜节律受到光的抑制[70]。研究还发现, 在哺乳动物中, 褪黑素主要通过激活Mel1a受体抑制CREB结合蛋白磷酸化, 从而减弱SCN内的神经元电信号, 进而干扰昼夜节律信号的振幅; 而Mel1b的激活则改变了SCN神经元相位转移的昼夜节律[71]。
许多海洋动物生命活动同样具有明显的昼夜节律特征。例如, 海洋棘皮动物刺参()存在明显的昼夜摄食行为, 其在黑暗环境下表现较强的摄食和运动能力[72]。目前, 研究者对褪黑素信号系统在海洋动物昼夜节律的调控研究已取得了一定的成果, 为探讨目标物种的生理生态适应及生理调控机制提供了重要支持。
生物体褪黑素水平响应环境因子(如光照和温度等)周期性变化而产生波动进而创造体内活动的条件并协调其生理和行为活动。例如, 在哺乳动物中, 即使在相当低的光照强度下, 大鼠褪黑素水平下降, 体温和觉醒的昼夜节律也会被削弱[73]; 在鱼类中, 斑马鱼褪黑素浓度水平在夜间达到峰值, 抑制其运动的昼夜节律[74], 且褪黑素信号系统参与调节其睡眠-觉醒的昼夜节律[75]。此外, 在海洋环节动物沙蚕蠕虫()中, 其昼夜游泳行为也受到褪黑素信号系统控制, 且该调控涉及光信号传导过程[76]。
4.2 褪黑素受体信号系统参与调控生殖系统
目前研究发现, 褪黑素受体在脊椎动物性腺及外周组织中均有表达和分布, 且该受体的表达在调节动物下丘脑-垂体-性腺(HPG)轴生殖相关激素内分泌功能中发挥重要作用, 进而对动物生殖发育过程发挥关键作用。随着褪黑素受体介导个体发育的生殖功能机理研究的不断深入, 褪黑素受体调节哺乳动物和鸟类季节性繁殖活动变化的生理机制亦得到揭示: 受环境因子(主要为光周期和温度)刺激的褪黑素激活下丘脑神经肽促性腺激素抑制激素(GnIH)神经元表面的褪黑素受体, 诱导GnIH神经元分泌释放GnIH, GnIH通过直接降低Kisspeptin(由吻素基因编码而来的神经肽)和GnRH神经元的活性或直接作用于垂体来抑制促性腺激素(如LH和FSH)的分泌; 而GnRH则通过刺激促性腺激素合成和释放来激活生殖发育启动[77-78], 进而影响繁殖行为。其中褪黑素受体调节生殖活动涉及的主要信号通路包括: Mel1a和Mel1b分别参与cAMP、IP3通路的调节和cGMP通路的介导[79]; 而激活的Mel1c可以清除DNA附近的自由基[80], 降低动物繁殖过程中产生的氧化应激[81]。
调节脊椎动物季节性繁殖的信号转导途径具有多样性, 不同于哺乳动物和鸟类, 鱼类以其特有的血管囊(saccus vasulosus, Sv)接收光周期信息并调节褪黑素的合成和分泌, 影响相应的内分泌输出。研究发现, 山女鳟()的Sv接收光信号并表达脊椎动物季节性繁殖的关键因子, 如促甲状腺激素(TSH)、促甲状腺激素受体(TSHR)和2型脱碘酶(DIO2), 以此影响繁殖活动[82]。
鱼类中尚未发现垂体结节部(鸟类和哺乳动物季节性繁殖调节中心), 因此, 鱼类季节性繁殖的信号转导途径还有待进一步探索。但近年来, 相关研究发现斑马鱼褪黑素浓度水平的升高可促进Kiss1(吻素1)、Kiss2(吻素2)和GnRH的表达, 进而影响生殖行为[74]; 橙斑石斑鱼()Mel1a可借助Kiss2或直接调节GnRH1的表达, 以此级联信号共同调控橙斑石斑鱼的季节性繁殖; 褪黑素、GnIH和Kiss之间相互作用可控制金鱼()的性成熟[83]。此外, 有关于褪黑素信号系统对生殖调控的机制研究普遍认为, 褪黑素主要通过调节生殖相关激素(如促性腺激素释放激素(GnRH)、黄体生成素(LH)和促卵泡素(FSH)等)分泌及其受体表达, 从而参与动物生殖系统的调控; 同时褪黑素对生殖激素的调节具有一定的复杂性, 会因物种、剂量、环境等因素而表现出促进或抑制的不同效应。例如, 在底鳉()的生殖调控研究中发现, 褪黑素可诱导雌性个体中GnRH的基因表达上升, 进而促进生殖发育和繁殖活动[84]; 然而, 在欧洲鲈鱼()中则表现出对GnRH受体夜间表达的抑制, 导致生殖功能的降低[85]。在LH信号系统的调节中, 褪黑素的作用同样具有类似的复杂性。例如, 褪黑素可诱导斑马鱼的促黄体生成激素受体(LHR)表达从而促使卵泡成熟, 促进生殖[86]; 而在雌性欧洲鳗鱼()中则表现出对LH分泌的抑制[87], 最终导致繁殖水平的下降。由此可知, 在季节性繁殖动物中, 褪黑素以及GnRH、GnIH和Kisspeptin在下丘脑水平上的繁殖调控功能相互作用仍然是未来研究的重要领域。不同于脊椎动物, 在海洋无脊椎动物锯缘青蟹()中, 褪黑素信号系统激活其蜕皮激素和甲基法尼酯的合成与分泌, 进而参与生殖调控[88]。
4.3 褪黑素信号系统参与衰老调控
大量证据表明, 过量的ROS导致的氧化应激与机体衰老和各种疾病之间存在紧密的因果关系, 因此寻找合适的抗氧化剂对解决相关问题显得尤为重要, 褪黑素因其强大的ROS对抗特性而备受关注[89]。目前对于褪黑素信号系统调节机体衰老的机制涉及两种假定: 其一, 褪黑素作为自由基清除剂直接作用于ROS(如氧、氮自由基), 例如, 褪黑素可清除拉鱼巴()产卵时产生的有害自由基, 提高卵巢生理活性, 从而促进其生殖发育[90]; 其二, 褪黑素激活其受体, 经cAMP-PKA、PLC-Ca2+通路或调节ERK和c-Jun氨基末端激酶(JNK)活化, 进而刺激即早基因(immediate early gene, IEG)转录, 从而诱导抗氧化酶表达或抑制促氧化酶的活化, 以此参与抗氧化调节, 间接调控机体衰老[91], 但褪黑素信号系统在该过程中的调控机制还尚未被证实。
近年来, 研究表明褪黑素信号系统通过NF-κB/ iNOS和Nrf2/HO-1信号通路改善雄性小鼠睾丸细胞的氧化应激, 从而影响其衰老[92]。而褪黑素信号系统在海洋动物衰老中的调节作用还有待证实。已有的研究表明, 一定剂量的褪黑素给药可激活海洋脊椎动物龟壳攀鲈()抗氧化酶活性, 进而调节抗氧化防御机制[93]; 而在无脊椎甲壳类动物中华绒螯蟹中, 外源性褪黑素注射4 h后, 出现了脂质过氧化物丙二醛(MDA)活性下降、过氧化氢酶(CAT)水平升高的现象, 但超氧化物歧化酶(SOD)的活性没有明显改变[94]。目前, 对于褪黑素信号系统在海洋动物, 特别是海洋无脊椎动物中的衰老调节机制研究较少, 探究并阐明相关生理调控功能还需要更多的研究结果予以支持。
5 展望
褪黑素对生物机体各种生理活动调控广泛、作用明显, 其与受体组成的信号系统是重要的神经内分泌信号系统, 参与调控各类下游信号因子。目前有关褪黑素信号系统的研究以及相关调控模型的建立, 主要围绕脊椎动物开展; 有关无脊椎动物的褪黑素信号系统生理调控理论发展相对缓慢, 相关调控网络和调控机制至今仍未深入解析。同时, 由于海洋生物的基础研究相对薄弱, 目前关于海洋动物(特别是海洋无脊椎动物)褪黑素信号系统特征及其生理调控作用机制研究仍然是零碎的, 可参考的研究成果报道也较少。因此, 开展海洋无脊椎动物褪黑素信号系统活性鉴定及功能机制研究具有一定挑战。
海洋动物中开展褪黑素受体信号系统的研究, 可以深入了解其生理过程及生理生态适应机制, 为揭示其基础生物学过程的内在调控机制提供重要证据, 为目标经济物种的人工繁育、资源增殖和养殖育种等实际应用技术研发提供参考依据。随着近年来海洋生物基因组、转录组、蛋白组等高通量测序成果的不断积累, 相关基础生物学研究获得一定进展, 开展海洋动物褪黑素信号系统有关的研究工作已经具备一定条件。根据前文综述, 褪黑素信号系统在进化上具有一定的保守性, 不同动物褪黑素合成分泌的生化过程基本一致, 不同类型褪黑素受体介导的信号转导机制具有明显特征。利用这些特点, 通过生物信息学等技术方法, 查找和筛选褪黑素合成分泌相关功能基因, 分析褪黑素合成及组织分布特征, 是探究该信号系统功能机制的重要内容; 查找和筛选褪黑素受体基因, 并进一步分析受体介导的细胞信号转导通路, 可明确受体类型, 并以此为基础开发激动剂和拮抗剂等, 将为深入解析该信号系统特征及功能机制提供关键支持; 同时也为不同进化地位的海洋无脊椎动物(如棘皮动物和头足类等)褪黑素信号系统查找和鉴定提供参考。
[1] STAUCH B, JOHANSSON L C, MCCORVY J D, et al. Structural basis of ligand recognition at the human MT1 melatonin receptor[J]. Nature, 2019, 569(7755): 284-288.
[2] MCCORD C P, ALLEN F P. Evidences associating pineal gland function with alterations in pigmentation[J]. Journal of Experimental Zoology, 1917, 23(1): 207-224.
[3] LERNER A B, CASE J D, TAKAHASHI, et al. Isolation of melatonin, the pineal gland factor that lightens melanocyteS1[J]. Journal of the American Chemical Society, 1958, 80(10): 2587.
[4] LERNER A B, CASE J D, HEINZELMAN R V. Structure of melatonin1[J]. Journal of the American Chemical Society, 1959, 81(22): 6084-6085.
[5] XIE Z, CHEN F, LI W A, et al. A review of sleep disorders and melatonin[J]. Neurological Research, 2017, 39(6): 559-565.
[6] ACKERMANN K, STEHLE J H. Melatonin synthesis in the human pineal gland: advantages, implications, and difficulties[J]. Chronobiology International, 2006, 23(1/2): 369-379.
[7] BESSEAU L, VUILLEUMIER R, SAUZET S, et al. Photoperiodic control of melatonin synthesis in fish pineal and retina[J]. Journal De La Societe De Biologie, 2007, 201(1): 13-20.
[8] SATO K, MENG F, FRANCIS H, et al. Melatonin and circadian rhythms in liver diseases: Functional roles and potential therapies[J]. Journal of Pineal Research, 2020, 68(3): e12639.
[9] BUBENIK G A, HACKER R R, BROWN G M, et al. Melatonin concentrations in the luminal fluid, mucosa, and muscularis of the bovine and porcine gastrointestinal tract[J]. Journal of Pineal Research, 1999, 26(1): 56-63.
[10] VELARDE E, CERDÁ-REVERTER J M, ALONSO- GÓMEZ A L, et al. Melatonin-synthesizing enzymes in pineal, retina, liver, and gut of the goldfish (): mRNA expression pattern and regulation of daily rhythms by lighting conditions[J]. Chronobiogy International, 2010, 27(6): 1178-1201.
[11] AMARAL F G D, CIPOLLA-NETO J. A brief review about melatonin, a pineal hormone[J]. Archives of Endocrinology and Metabolism, 2018, 62(4): 472-479.
[12] TAKEUCHI Y, IMAMURA S, SAWADA Y, et al. Effects of different colors of light on melatonin suppression and expression analysis of Aanat1 and melanopsin in the eye of a tropical damselfish[J]. General and Comparative Endocrinology, 2014, 204: 158-165.
[13] TAN D X, HARDELAND R, BACK K, et al. On the significance of an alternate pathway of melatonin synthesis via 5-methoxytryptamine: comparisons across species[J]. Journal of Pineal Research, 2016, 61(1): 27-40.
[14] TAN D X, MANCHESTER L C, ESTEBAN-ZUBERO E, et al. Melatonin as a potent and inducible endogenous antioxidant: Synthesis and Metabolism[J]. Molecules, 2015, 20(10): 18886-18906.
[15] POMIANOWSKI K, GOZDOWSKA M, BURZYŃSKI A, et al. A study of aanat and asmt expression in the three-spined stickleback eye and skin: Not only “on the way to melatonin”[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2020, 241: 110635.
[16] PAULIN C H, CAZAMÉA-CATALAN D, ZILBERMAN- PELED B, et al. Subfunctionalization of arylalkylamine N-acetyltransferases in the sea bass: two-ones for one two[J]. Journal of Pineal Research, 2015, 59(3): 354-364.
[17] REITER R J. Pineal melatonin: cell biology of its synthesis and of its physiological interactions[J]. Endocrine Reviews, 1991, 12(2): 151-180.
[18] MUÑOZ J L P, LÓPEZ PATIÑO M A, HERMOSILLA C, et al. Melatonin in octopus (): tissue distribution, daily changes and relation with serotonin and its acid metabolite[J]. Journal of Comparative Physiology A: Neuroethology Sensory, Neural, and Behavioral Physiology, 2011, 197(8): 789-797.
[19] TILDEN A R, RASMUSSEN P, AWANTANG R M, et al. Melatonin cycle in the fiddler craband influence of melatonin on limb regeneration[J]. Journal of Pineal Research, 1997, 23(3): 142-147.
[20] BESSEAU L, BENYASSI A, MØLLER M, et al. Melatonin pathway: breaking the 'high-at-night' rule in trout retina[J]. Experimental Eye Research, 2006, 82(4): 620-627.
[21] GARCÍA-ALLEGUE R, MADRID J A, SÁNCHEZ- VÁZQUEZ F J. Melatonin rhythms in European sea bass plasma and eye: influence of seasonal photoperiod and water temperature[J]. Journal of Pineal Research, 2001, 31(1): 68-75.
[22] ZHDANOVA I V, WANG S Y, LECLAIR O U, et al. Melatonin promotes sleep-like state in zebrafish[J]. Brain Research, 2001, 903(1/2): 263-268.
[23] GANDHI A V, MOSSER E A, OIKONOMOU G, et al. Melatonin is required for the circadian regulation of sleep[J]. Neuron, 2015, 85(6): 1193-1199.
[24] SCHOMERUS C, KORF H W. Mechanisms regulating melatonin synthesis in the mammalian pineal organ[J]. Annals of the New York Academy of Sciences, 2005, 1057(1): 372-383.
[25] TILDEN A R, HUTCHINSON V H. Influence of photoperiod and temperature on serum melatonin in the diamondback water snake,[J]. General Comparative Endocrinology, 1993, 92(3): 347-354.
[26] JESSOP T S, LIMPUS C J, WHITTIER J M. Nocturnal activity in the green sea turtle alters daily profiles of melatonin and corticosterone[J]. Hormones and behavior, 2002, 41(4): 357-365.
[27] VERA L M, DE OLIVEIRA C, LÓPEZ-OLMEDA J F, et al. Seasonal and daily plasma melatonin rhythms and reproduction inkept under natural photoperiod and natural or controlled water temperature[J]. Journal of Pineal Research, 2007, 43(1): 50-55.
[28] HUO X, WANG C, YU Z, et al. Human transporters, PEPT1/2, facilitate melatonin transportation into mitochondria of cancer cells: An implication of the therapeutic potential[J]. Journal of Pineal Research, 2017, 62(4): e12390.
[29] ACUÑA-CASTROVIEJO D, MARTÍN M, MACÍAS M, et al. Melatonin, mitochondria, and cellular bioenergetics[J]. Journal of Pineal Research, 2001, 30(2): 65-74.
[30] ZHANG H M, ZHANG Y. Melatonin: a well-documented antioxidant with conditional pro-oxidant actions[J]. Journal of Pineal Research, 2014, 57(2): 131-146.
[31] 张俊毅, 丁春华. 褪黑素的抗氧化作用和抗炎作用的研究进展[J]. 河北医科大学学报, 2006, 27(3): 222.
ZHANG Junyi, DING Chunhua. Research progress on the antioxidant and anti-inflammatory effects of melatonin[J]. Journal of Hebei Medical University, 2006, 27(3): 222.
[32] JOU M J, PENG T I, YU P Z, et al. Melatonin protects against common deletion of mitochondrial DNA-augmented mitochondrial oxidative stress and apoptosis[J]. Journal of Pineal Research, 2007, 43(4): 389-403.
[33] SHIN H S, LEE J, CHOI C Y. Effects of LED light spectra on oxidative stress and the protective role of melatonin in relation to the daily rhythm of the yellowtail clownfish,[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2011, 160(2): 221-228.
[34] ZHANG C, ZHANG Q, PANG Y, et al. The protective effects of melatonin on oxidative damage and the immune system of the Chinese mitten crab () exposed to deltamethrin[J]. The Science of the Total Environment, 2019, 653: 1426-1434.
[35] JOCKERS R, DELAGRANGE P, DUBOCOVICH M L, et al. Update on melatonin receptors: IUPHAR Review 20[J]. British Journal of Pharmacology, 2016, 173(18): 2702-2725.
[36] HAMOUDA H O, CHEN P, LEVOYE A, et al. Detection of the human GPR50 orphan seven transmembrane protein by polyclonal antibodies mapping different epitopes[J]. Journal of Pineal Research, 2007, 43(1): 10-15.
[37] EBISAWA T, KARNE S, LERNER M R, et al. Expression cloning of a high-affinity melatonin receptor from[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(13): 6133-6137.
[38] REPPERT S M, WEAVER D R, EBISAWA T. Cloning and characterization of a mammalian melatonin receptor that mediates reproductive and circadian responses[J]. Neuron, 1994, 15(5): 1177-1185.
[39] REPPERT S M, GODSON C, MAHLE C D, et al. Molecular characterization of a second melatonin receptor expressed in human retina and brain: the Mel1b melatonin receptor[J]. Proceedings of the National Academy of Sciences of the United States of America, 1995, 92(19): 8734-8738.
[40] CECON E, OISHI A, JOCKERS R. Melatonin receptors: molecular pharmacology and signalling in the context of system bias[J]. British Journal of Pharmacology, 2018, 175(16): 3263-3280.
[41] DUFOURNY L, LEVASSEUR A, MIGAUD M, et al. GPR50 is the mammalian ortholog of Mel1c: evidence of rapid evolution in mammals[J]. BMC Evolutionary Biology, 2008, 8: 105.
[42] LEVOYE A, DAM J, AYOUB M A, et al. The orphan GPR50 receptor specifically inhibits MT1 melatonin receptor function through heterodimerization[J]. The EMBO Journal, 2006, 25(13): 3012-3023.
[43] GARCIA-MAYRINO S, REPPERT S M. Assignment of the melatonin-related receptor to human chromosome X (GPR50) and mouse chromosome X (Gpr50)[J]. Genomics, 1999, 55(2): 248-251.
[44] WOJCIECH S, AHMAD R, BELAID-CHOUCAIR Z, et al. The orphan GPR50 receptor promotes constitutive TGFβ receptor signaling and protects against cancer development[J]. Nature Communications, 2018, 9(1): 1216.
[45] PARK Y J, PARK J G, KIM S J, et al. Melatonin receptor of a reef fish with lunar-related rhythmicity: cloning and daily variations[J]. Journal of Pineal Research, 2006, 41(2): 166-174.
[46] PARK Y J, PARK J G, HIYAKAWA N, et al. Diurnal and circadian regulation of a melatonin receptor, MT1, in the golden rabbitfish,[J]. General and Comparative Endocrinology, 2007, 150(2): 253- 262.
[47] PARK Y J, PARK J G, JEONG H B, et al. Expression of the melatonin receptor Mel(1c) in neural tissues of the reef fish[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2007, 147(1): 103-111.
[48] SAUZET S, BESSEAU L, HERRERA PEREZ P, et al. Cloning and retinal expression of melatonin receptors in the European sea bass,[J]. General and Comparative Endocrinology, 2008, 157(2): 186-195.
[49] XIAO C T, CHU M X, FU Y, et al. Analysis of polymorphism, structure and function of exon 2 of ovine melatonin receptor 1b gene: a clue as to why it lacks expression in sheep[J]. Journal of Pineal Research, 2007, 42(1): 97-104.
[50] KOKKOLA T, LAITINEN J T. Melatonin receptor genes[J]. Annals of Medicine, 1998, 30(1): 88-94.
[51] SHIU S Y, NG N, PANG S F. A molecular perspective of the genetic relationships of G-protein coupled melatonin receptor subtypes[J]. Journal of Pineal Research, 1996, 20(4): 198-204.
[52] DUBOCOVICH M L, MASANA M I, IACOB S, et al. Melatonin receptor antagonists that differentiate between the human Mel1a and Mel1b recombinant subtypes are used to assess the pharmacological profile of the rabbit retina ML1 presynaptic heteroreceptor[J]. Naunyn Schmiedebergs Archives of Pharmacology, 1997, 355(3): 365-375.
[53] HU J J, ZHANG X Y, ZHANG Y, et al. Molecular characterization and expression profile of the melatonin receptor MT1 in the ovary of Tianzhu white yak ()[J]. General and Comparative Endocrinology, 2017, 242: 101-107.
[54] KOKKOLA T, SALO O M, POSO A, et al. The functional role of cysteines adjacent to the NRY motif of the human MT1 melatonin receptor[J]. Journal of Pineal Research, 2005, 39(1): 1-11.
[55] HILGER D, MASUREEL M, KOBILKA B K. Structure and dynamics of GPCR signaling complexes[J]. Nature Structural & Molecular Biology, 2018, 25(1): 4-12.
[56] WEIS W I, KOBILKA B K. The molecular basis of G protein-coupled receptor activation[J]. The Annual Review of Biochemistry, 2018, 87: 897-919.
[57] LIU J, CLOUGH S J, HUTCHINSON A J, et al. MT1 and MT2 melatonin receptors: a therapeutic perspective[J]. The Annual Review of Pharmacology and Toxicology, 2016, 56: 363-383.
[58] DEVAVRY S, LEGROS C, BRASSEUR C, et al. Description of the constitutive activity of cloned human melatonin receptors hMT(1) and hMT(2) and discovery of inverse agonists[J]. Journal of Pineal Research, 2012, 53(1): 29-37.
[59] AHMED R, MAHAVADI S, AL-SHBOUL O, et al. Characterization of signaling pathways coupled to melatonin receptors in gastrointestinal smooth muscle[J]. Regulatory Peptides, 2013, 184: 96-103.
[60] OISHI A, CECON E, JOCKERS R, et al. Melatonin receptor signaling: impact of receptor oligomerization on receptor function[J]. International Review of Cell and Molecular Biology, 2018, 338: 59.
[61] PETIT L, LACROIX I, DE COPPET P, et al. Differential signaling of human Mel1a and Mel1b melatonin receptors through the cyclic guanosine 3′-5′-monophosphate pathway[J]. Biochemical Pharmacology, 1999, 58(4): 633-639.
[62] 平勇. 褪黑素对鲫鱼和大鼠外层视网膜视杆信号通路的调制[D]. 上海: 复旦大学, 2009.
PING Yong. Melatonin modulates rod signal in outer retinas of carp and cat[D]. Shanghai: Fudan University, 2009.
[63] CHEN M, CECON E, KARANITRI A, et al. Melatonin MT1 and MT2 receptor ERK signaling is differentially dependent on Gi/o and Gq/11 proteins[J]. Journal of Pineal Research. 2020, 68(4): e12641.
[64] NING S A O, WANG Z, CAO J, et al. Mel1c mediated monochromatic light-stimulated IGF-I synthesis through the intracellular G(α)q/PKC/ERK signaling pathway[J]. International Journal of Molecular Sciences, 2019, 20(7): 1682.
[65] ANDERSSON T P, SKÖLD H N, SVENSSON S P. Phosphoinositide 3-kinase is involved inandmelanophore aggregation[J]. Cell signaling, 2003, 15(12): 1119-1127.
[66] CLAUSTRAT B, LESTON J. Melatonin: physiological effects in humans[J]. Neurochirurgie, 2015, 61(2/3): 77- 84.
[67] IKEGAMI K, REFETOFF S, VAN CAUTER E, et al. Interconnection between circadian clocks and thyroid function[J]. Nature Reviews Endocrinology, 2019, 15(10): 590-600.
[68] STANKOV B, FRASCHINI F, REITER R J. Melatonin binding sites in the central nervous system[J]. Brain Research. Brain Research Reviews, 1991, 16(3): 245-256.
[69] MOREIRA A C, ANTONINI S R, DE CASTRO M. Mechanisms in endocrinology: A sense of time of the glucocorticoid circadian clock: from the ontogeny to the diagnosis of Cushing's syndrome[J]. European Journal of Endocrinology, 2018, 179(1): 1-18.
[70] BEN-MOSHE Z, FOULKES N S, GOTHILF Y. Functional development of the circadian clock in the zebrafish pineal gland[J]. Biomed Research International, 2014, 2014: 235781.
[71] DUBOCOVICH M L. Melatonin receptors: role on sleep and circadian rhythm regulation[J]. Sleep Medicine, 2007, 8(3): 34-42.
[72] 孙佳敏, 王芳, 张立斌, 等. 不同光照周期对刺参摄食节律和消化生理的影响[J]. 海洋科学, 2015, 39(5): 1-8.
SUN Jiamin, WANG Fang, ZHANG Libin, et al. Effects of photoperiods on feeding rhythm and digestive physiology of sea cucumber,[J]. Marine Sciences, 2015, 39(5): 1-8.
[73] EASTMAN C, RECHTSCHAFFEN A. A rechtschaffen circadian temperature and wake rhythms of rats exposed to prolonged continuous illumination[J]. Physiology & Behavior, 1983, 31(4): 417-427.
[74] LIMA-CABELLO E, DÍAZ-CASADO M E, GUERRERO J A, et al. A review of the melatonin functions in zebrafish physiology[J]. Journal of Pineal Research, 2014, 57(1): 1-9.
[75] ELBAZ I, FOULKES N S, GOTHILF Y, et al. Circadian clocks, rhythmic synaptic plasticity and the sleep-wake cycle in zebrafish[J]. Frontiers in Neural Circuits, 2013, 7: 9.
[76] TOSCHES M A, BUCHER D, VOPALENSKY P, et al. Melatonin signaling controls circadian swimming behavior in marine zooplankton[J]. Cell, 2014, 159(1): 46-57.
[77] SATAKE H, MATSUBARA S, AOYAMA M, et al. GPCR Heterodimerization in the reproductive system: Functional regulation and implication for biodiversity[J]. Frontiers in Neuroendocrinology, 2013, 4: 100.
[78] TSUTSUI K, UBUKA T, BENTLEY G E, et al. Review: regulatory mechanisms of gonadotropin-inhibitory hormone (GnIH) synthesis and release in photoperiodic animals[J]. Frontiers in Neuroscience, 2013, 7: 60.
[79] DEL CASTILLO-VAQUERO A, SALIDO G M, GONZ ALEZ A. Melatonin induces calcium release from CCK-8- and thapsigargin-sensitive cytosolic stores in pancreatic AR42J cells[J]. Journal of Pineal Research, 2010, 49(3): 256-263.
[80] LI D Y, SMITH G D, HARDELAND R, et al. Melatonin Receptor genes in vertebrates[J]. International Journal of Molecular Sciences, 2013, 14(6): 11208-11223.
[81] TAMURA H, TAKASAKI A, TAKETANI T, et al. The role of melatonin as an antioxidant in the follicle[J]. Journal of Ovarian Research, 2012, 5: 5.
[82] NAKANE Y, IKEGAMI K, IIGO M, et al. The saccus vasculosus of fish is a sensor of seasonal changes in day length[J]. Nature Communications, 2013, 4: 2108.
[83] CHOI C Y, SHIN H S, KIM N N, et al. Time-related effects of various LED light spectra on reproductive hormones in the brain of the goldfish[J]. Biological Rhythm Research, 2015, 46(5): 671-682.
[84] LOMBARDO F, GIOACCHINI G, FABBROCIN I A, et al. Melatonin-mediated effects on killifish reproductive axis[J]. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2014, 172: 31-38.
[85] SERVILI A, HERRERA-PÉREZ P, DEL CARMEN RENDÓN M, et al. Melatonin inhibits GnRH-1, GnRH-3 and GnRH receptor expression in the brain of the European Sea Bass,[J]. International Journal of Molecular Sciences, 2013, 14(4): 7603-7616.
[86] CARNEVALI O, GIOACCHINI G, MARADONNA F, et al. Melatonin induces follicle maturation in[J]. PLoS One, 2011, 6(5): 19978.
[87] SÉBERT M E, LEGROS C, WELTZIEN F A, et al. Melatonin activates brain dopaminergic systems in the eel with an inhibitory impact on reproductive function[J]. Journal of Neuroendocrinology, 2008, 20(7): 917-929.
[88] GIRISH B P, SWETHA C, REDDY P S. Induction of ecdysteroidogenesis, methyl farnesoate synthesis and expression of ecdysteroid receptor and retinoid X receptor in the hepatopancreas and ovary of the giant mud crab,by melatonin[J]. General and Comparative Endocrinology, 2015, 217/218: 37-42.
[89] CHENG Y, FENG Z, ZHANG Q Z, et al. Beneficial effects of melatonin in experimental models of Alzheimer disease[J]. Acta Pharmacologica Sinica, 2006, 27(2): 129-139.
[90] MAITRA S K, HASAN K N. The Role of melatonin as a hormone and an antioxidant in the control of fish reproduction[J]. Frontiers in Endocrinology, 2016, 7: 38.
[91] RODRIGUEZ C, MAYO J C, SAINZ R M, et al. Regulation of antioxidant enzymes: a significant role for melatonin[J]. Journal of Pineal Research, 2004, 36(1): 1-9.
[92] GUO Y, SUN J, LI T, et al. Melatonin ameliorates restraint stress-induced oxidative stress and apoptosis in testicular cells via NF-κB/iNOS and Nrf2/ HO-1 signaling pathway[J]. Scientific Reports, 2017, 7(1): 9599.
[93] SREEJITH P, BEYO R S, DIVYA L, et al. Triiodothyronine and melatonin influence antioxidant defense mechanism in a teleost(Bloch): in vitro study[J]. Indian Journal of Biochemistry & Biophysics, 2007, 44(3): 164-168.
[94] SHE Q, HAN Z, LIANG S, et al. Impacts of circadian rhythm and melatonin on the specific activities of immune and antioxidant enzymes of the Chinese mitten crab ()[J]. Fish & Shellfish Immunology, 2019, 89: 345-353.
Research progress of the melatonin signaling system in marine animals
FENG Jia-qian1, WANG Tian-ming1, 2, YANG Jing-wen1, 2
(1. Marine Science and Technology College, Zhejiang Ocean University, Zhoushan 316022, China; 2. National and Provincial Joint Laboratory of Exploration and Utilization of Marine Aquatic Genetic Resources, Zhejiang Ocean University, Zhoushan 316022, China)
Melatonin is one of the key hormones in neuroendocrine regulation and has essential physiological functions. It plays indispensable roles in improving sleep, regulating reproduction, and delaying aging and other physiological processes; moreover, the mechanism regulating its physiological functions has been well studied. This paper mainly reviews the key characteristics of melatonin and its receptors, the receptor-mediated signaling pathway, andthe prospects and challenges inherent in melatonin signaling system research in marine organisms. We hope that our work will serve as a valuable reference for studies on melatonin signal transduction, physiological functions, and signaling system evolution in marine animals.
melatonin; melatonin receptor; signal transduction; signal system; marine animals
Jul. 28, 2020
Q42
A
1000-3096(2021)11-0144-12
10.11759/hykx20200728001
2020-07-28;
2020-09-01
国家自然科学基金资助项目(41876154, 41606150, 41406137); 舟山市科技项目(2019C21020)
[National Natural Science Fund, No. 41876154, No. 41606150, No. 41406137; The Technical Applied Research Project of Zhoushan, No. 2019C21020]
冯佳倩(1997—), 女, 浙江绍兴人, 硕士研究生, 主要从事海洋生物细胞分子生物学研究, 电话: 18858393991, E-mail: fengjiaqian116@ 163.com; 杨静文(1984—),通信作者, E-mail: silence84309@163.com, yangjingwen@zjou.edu.cn
(本文编辑: 杨 悦)
