基于网络药理学探讨山慈菇治疗乳腺癌的分子机制Δ
2021-12-09房立源李慧杰王志鹏李秀荣
房立源,冯 雪,李慧杰,王志鹏,李秀荣#
(1.山东中医药大学第一临床医学院,山东 济南 250014; 2.山东中医药大学附属医院重症医学科,山东 济南 250014; 3.山东中医药大学附属医院肿瘤科,山东 济南250014)
全球恶性肿瘤统计数据显示,2018年乳腺癌在全球的发病率为11.6%,其发病率、死亡率在女性肿瘤中居首位,分别为24.2%、15.0%,严重威胁女性的身心健康[1]。国家癌症中心发布的统计数据表明,2015年我国乳腺癌发病率为17.10%,居女性肿瘤发病率之首,发病患者数约为30.4万例[2]。近年来,乳腺癌的发病率呈现出逐年升高和年轻化的趋势[3-4]。乳腺癌早期的临床症状多表现为乳房肿块,质硬,与周围组织有粘连;中晚期多表现为乳头内陷,乳房皮肤呈现“橘皮样”外观,并伴有内脏转移和骨转移。目前,乳腺癌的治疗方式主要有外科手术、放疗、化疗、分子靶向、内分泌、免疫及中医药等综合治疗模式。近年来,中医药成为乳腺癌治疗中的重要组成部分并涵盖其各治疗阶段。中医药治疗乳腺癌的疗效可靠,尤其是在减毒增效、预防复发转移[5-6]、防治肿瘤及治疗相关并发症[7-8]和提高患者生活质量[9-10]等方面得到了越来越多的认可和支持。山慈菇味甘、微辛,性凉,归肝、脾经,具有清热解毒、软坚散结的功效,主要用于痈肿疔毒等[11]。目前,山慈菇在临床上被广泛应用于肿瘤的治疗,涉及乳腺癌、肝癌和肺癌等[12-15]。随着科学技术的发展,网络药理学-分子对接技术逐渐成为新型的疾病-药物预测模型。本研究运用网络药理学方法收集山慈菇的活性成分和靶点,分析预测其作用于乳腺癌的潜在机制,验证活性成分和核心靶点的结合强度,以期为山慈菇在临床上的广泛使用提供更多有价值的参考。
1 资料与方法
1.1 网络药理学
1.1.1 山慈菇成分收集和筛选:在中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)和UniProt数据库(https://www. uniprot.org /uniprot/)中获取山慈菇的活性成分和相关作用靶点。筛选条件为口服生物利用度(oral bioavailability,OB)≥30%,类药性(drug-likeness,DL)≥0.18。
1.1.2 山慈菇和乳腺癌作用靶点的获取:以“Breast Cancer”为关键词,通过GeneCards(https://www.genecards.org/)、人类孟德尔遗传综合数据库(online mendelian inheritance in man,OMIM)(https://www. omim.org/)和毒性与基因比较数据库(comparative toxicogenomics database,CTD)(https://ctdbase.org/)数据库,检索并筛选乳腺癌相关的作用基因。利用Venny 2.1在线工具进行山慈菇作用靶点和乳腺癌靶点的映射并绘制韦恩图,交集基因作为山慈菇治疗乳腺癌的重要靶点。
1.1.3 山慈菇活性成分与作用靶点网络构建:将山慈菇的活性成分和作用靶点导入Cytoscape Version 3.7.1软件,构建“山慈菇-活性成分-作用靶点”网络。其网络的节点表示靶点或活性成分,边表示两者之间具有相互作用。
1.1.4 蛋白质-蛋白质相互作用(protein-protein Interaction,PPI)网络构建:将山慈菇作用靶点和乳腺癌疾病靶点交集部分输入至STRING数据库(https://string-db.org/),选择物种为“Homo sapiens”进行下一步操作,设定相互作用阀值为“medium confidence=0.4”,获取PPI网络图。
1.1.5 关键靶点筛选:运用Cytoscape Version 3.7.1软件对“1.1.4”项下获得的网络图进行拓扑属性分析,计算网络图整体的中介中心性(betweenness centrality,BC)、接近中心性(closeness centrality,CC)和点度中心性(degree centrality,DC),以BC、CC和DC的平均数为“阈值”,选取BC、CC和DC同时在阈值之上的靶点作为关键靶点。
1.1.6 基因本体(gene ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析:通过R语言把山慈菇-乳腺癌的共有靶点转化成entrez ID,加载“BiocManager”“clusterProfiler”等程序包,运行R语言获得GO功能富集分析和KEGG通路富集的气泡图。最后运用Perl语言把entrez ID转换为基因靶点信息。根据生物过程分析和通路富集结果,对山慈菇治疗乳腺癌的物质基础和分子机制进行分析预测。
1.1.7 中药活性成分与关键靶点的分子对接:选取山慈菇的主要活性成分与核心靶蛋白进行活性成分与核心靶蛋白的分子对接。从PDB数据库中下载靶蛋白的3D结构,从TCMSP数据库中下载化合物的结构,并保存为mol2格式。利用PYMOL软件对靶蛋白进行除水除配体,利用AutoDock 1.5.6软件将活性成分及靶蛋白格式转换为pdbqt格式,最后运行Auto Dock vina进行对接,再使用PyMOL对结果进行可视化[16]。相关文献报道,化合物和靶标之间结合能<-20.93 kJ/mol被认为具有较好作用[17]。
1.2 细胞实验
1.2.1 细胞:人乳腺癌MDA-MB-231细胞,购自上海泽叶生物科技有限公司。
1.2.2 仪器:CO2细胞培养箱(美国Thermo Scientific公司);DMi1型倒置显微镜(日本Olympus公司);FD-1 A-50型真空冷冻干燥机(北京博医康实验仪器有限公司)。
1.2.3 药品与试剂:山慈菇(购于山东中医药大学附属医院),制备成3 g/ml的山慈菇水煎液。DMEM培养液(德国Lonza公司);胎牛血清、青霉素和链霉素(美国Gibco公司);噻唑蓝(MTT)(北京兰博利德生物技术有限公司)。
1.2.4 MTT法检测人乳腺癌MDA-MB-231细胞生长增殖情况:将人乳腺癌MDA-MB-231细胞接种于6孔板中,每孔100 μl,置入37 ℃、5% CO2培养箱中培养24 h,吸除原培养液,实验组分别加入90、180、360和720 mg/ml山慈菇水煎剂,对照组加入等量细胞培养液,空白组不接种细胞。全部置于培养箱中48 h,用4 ℃的0.9%氯化钠溶液洗2次,加入0.5 mg/ml的MTT溶液100 μl,避光,孵育4 h,加入二甲基亚砜150 μl,继续避光,振摇15 min后上机检测,于490 nm处检测吸光度(A),重复3次,计算细胞存活率,细胞存活率=(A实验组-A空白组)/(A对照组-A空白组)×100%。
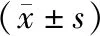
2 结果
2.1 山慈菇有效成分的筛选
将山慈菇输入到TCMSP和UniProt数据库,共检索到山慈菇的3个活性成分,70个作用靶点,见表1。

表1 山慈菇活性成分Tab 1 Active ingredients of iphigenia indica
2.2 乳腺癌作用靶点的获取
以“Breast Cancer”为关键词在Gene Cards、OMIM和CTD数据库进行检索,并合并3个数据库检索内容,利用Excel软件对数据进行去重,最终寻找到乳腺癌相关靶点基因364个。
2.3 药物-作用靶点网络图构建
运用Cytoscape Version 3.7.1软件构建“山慈菇-活性成分-作用靶点”网络,该网络中共有74个节点,423条相互作用的边,见图1。
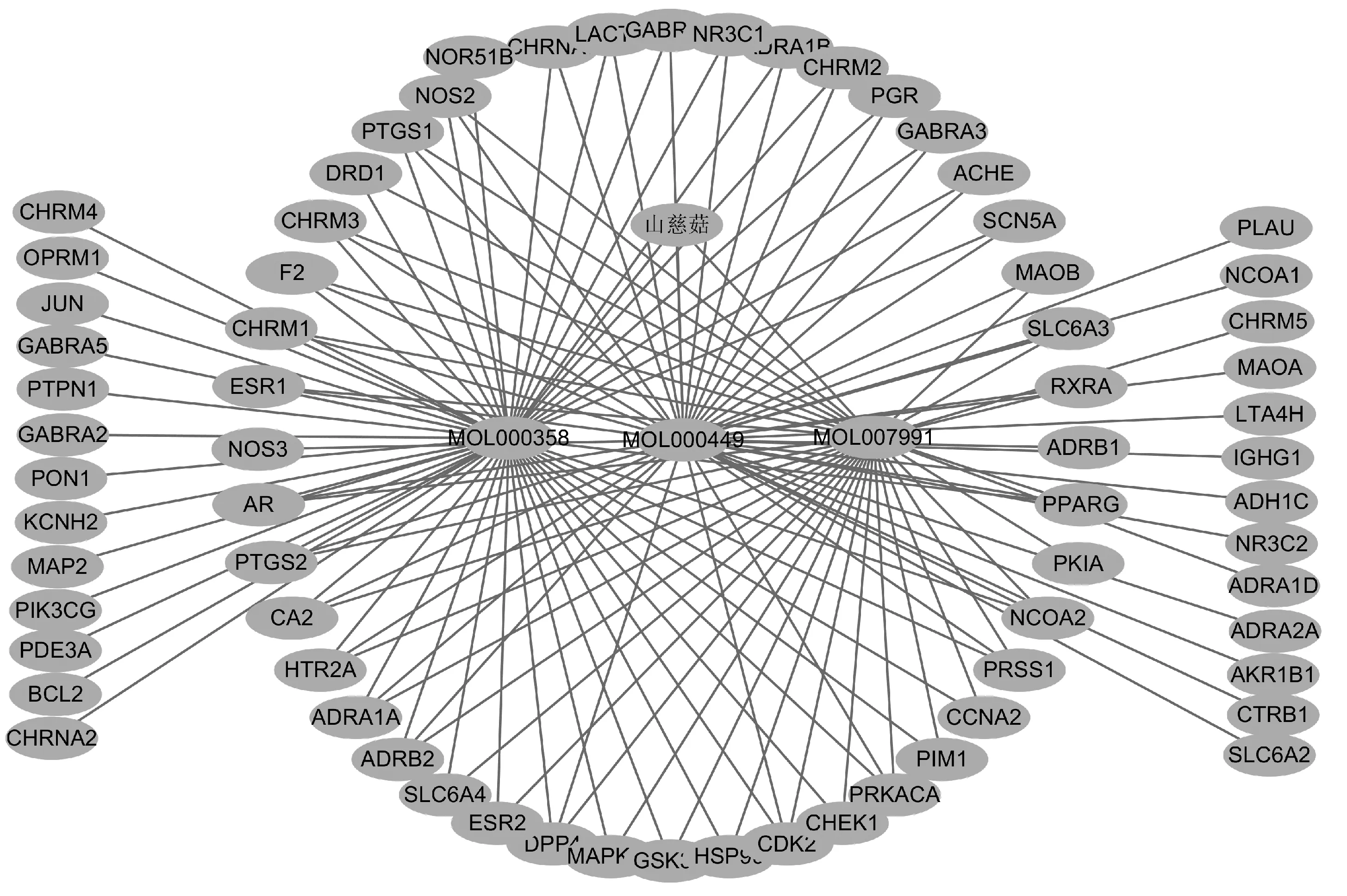
图1 “山慈菇-活性成分-作用靶点”网络图Fig 1 Network diagram of “iphigenia indica-active ingredients-targets”
2.4 PPI网络的构建
将山慈菇相关靶点网络映射到乳腺癌靶点网络中,2个网络中交集基因共有14个,即认为这是山慈菇治疗乳腺癌的可能作用靶点。结果显示,14个靶蛋白发生较强的相互作用,共产生32条蛋白质相互作用的边,见图2—3。
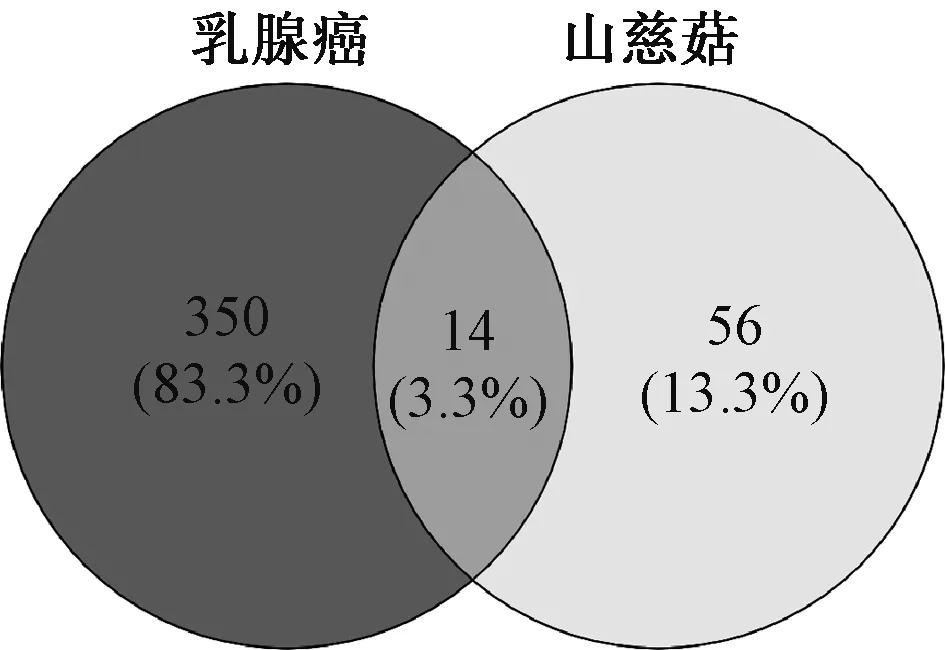
图2 韦恩图Fig 2 Venny diagram
2.5 关键靶点网络图
通过Cytoscape Version 3.7.1计算得到,PPI网络中BC平均数为2,CC平均数为0,DC平均数为0.482,将节点的BC、CC和DC均大于其平均数的节点基因作为核心靶基因,共筛选出核心靶点基因7个,其中比较重要的为PTGS2、JUN、ESR1和NOS3。关键靶点网络图见图4,图中节点大小表示度值的大小,节点越大对应的度值越大,边的粗细表示合并分数,边越粗提示合并分数越大,表示该节点蛋白与其他节点作用网络越广泛。
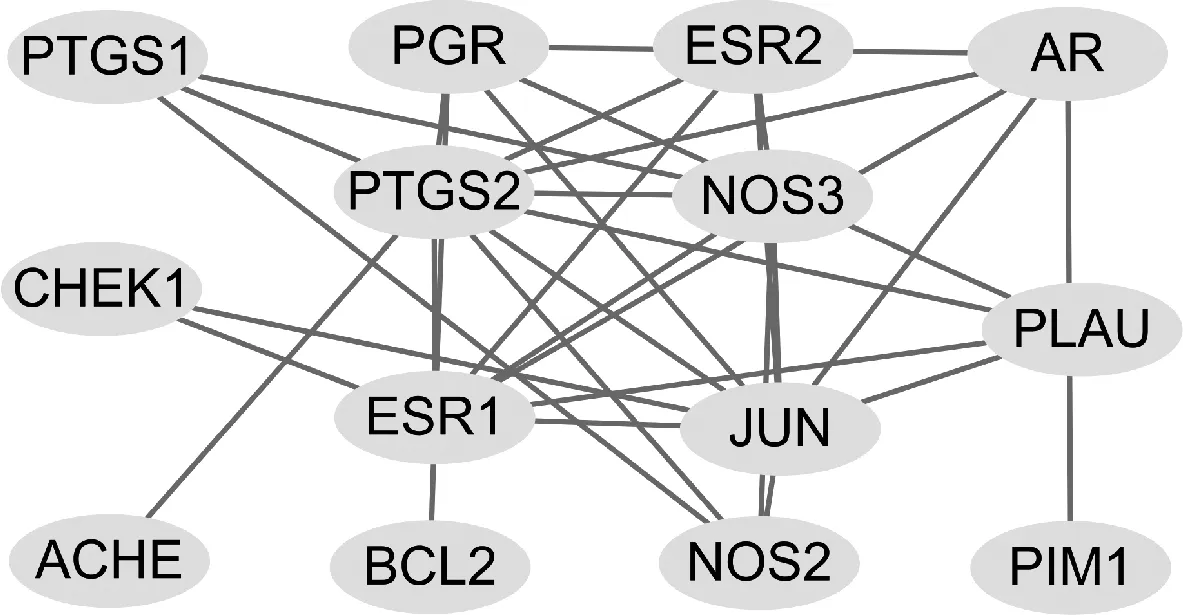
图3 PPI网络图Fig 3 PPI network
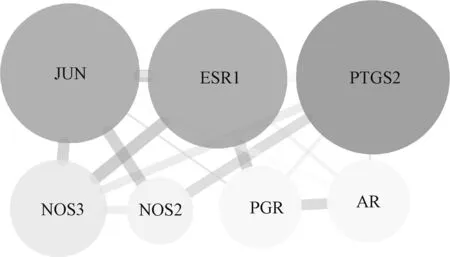
图4 关键靶点网络图Fig 4 Network diagram of core target
2.6 生物通路及富集分析
2.6.1 GO功能富集分析:运用R语言对14个潜在作用靶点进行生物功能富集分析,共有475条GO数据(P<0.05)。其中生物学过程条目最多,共有420个,主要集中在对类固醇激素的反应(response to steroid hormone)、生殖结构发展(reproductive structure development)和生殖系统发育(reproductive system development);分子功能相关条目有51个,主要涉及核受体活性(nuclear receptor activity)、配体激活转录因子活性(ligand-activated transcription factor activity)和类固醇结合(steroid binding);细胞组成相关条目有4个,主要涉及细胞器外膜(organelle outer membrace)和外膜支架(outer membrace)等,见图5—7。
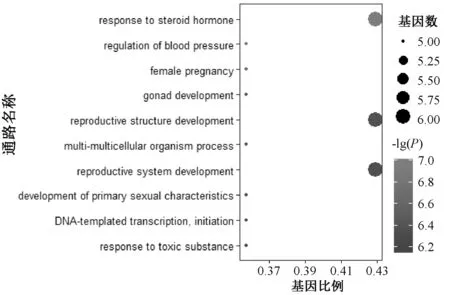
图5 生物学过程GO功能富集分析Fig 5 GO function enrichment analysis of biological process
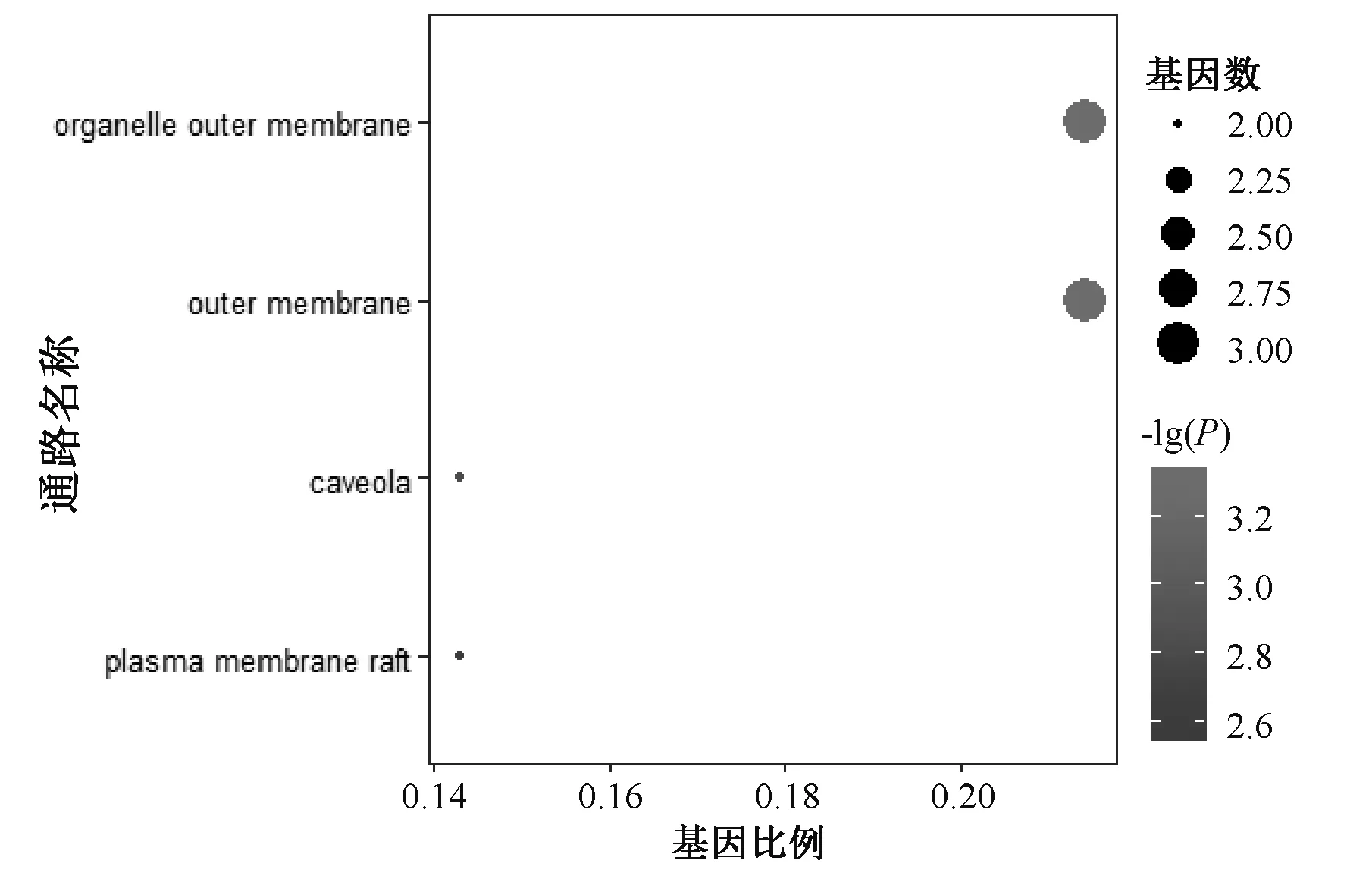
图6 细胞组成GO功能富集分析Fig 6 GO function enrichment analysis of cell component

图7 分子功能GO功能富集分析Fig 7 GO function enrichment analysis of molecular function
2.6.2 KEGG通路富集分析:运用R语言对14个潜在作用靶点进行代谢通路富集分析,共获得23条通路(P<0.05)。山慈菇治疗乳腺癌主要涉及雌激素信号通路(estrogen signaling pathway)、内分泌抵抗(endocrine resistance)、糖尿病并发症中的AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications)和乳腺癌(breast cancer)等通路,见图8。
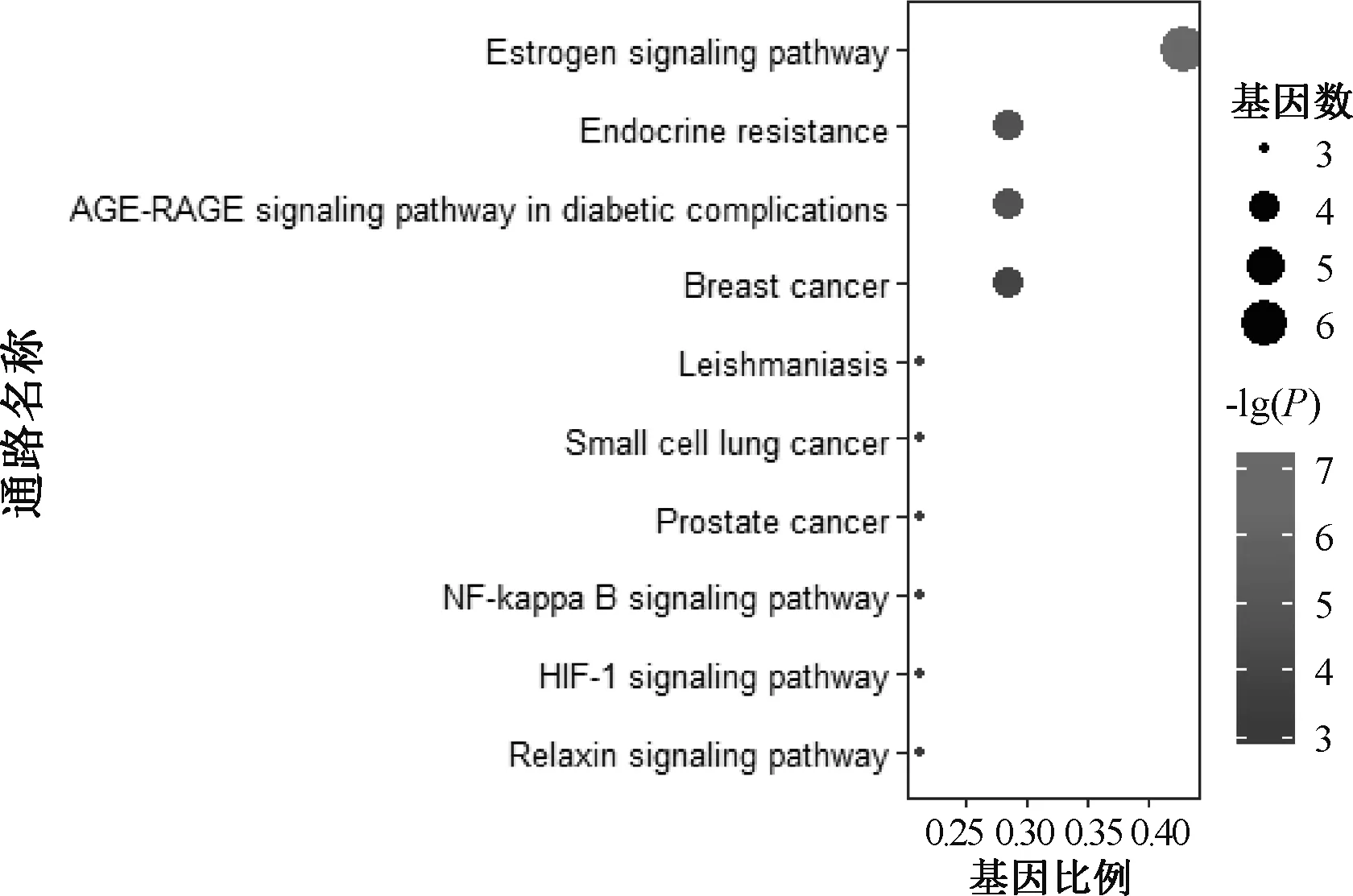
图8 KEGG通路富集分析Fig 8 KEGG pathway enrichment analysis
2.7 分子对接结果
山慈菇中活性成分与靶标的结合能信息见表2,具体对接过程见图9—10。分子对接过程充分说明,山慈菇中活性成分与乳腺癌的核心基因靶点具有较好的结合能力。

表2 分子对接结果Tab 2 Result of molecular docking
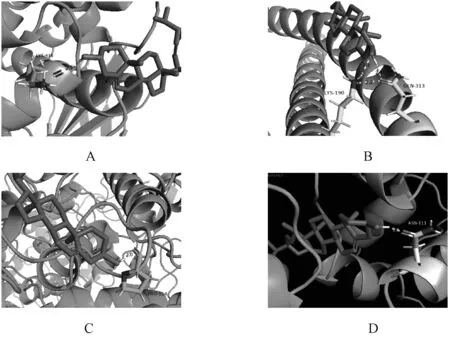
A.PTGS2;B.JUN;C.ESR1;D.NOS3A.PTGS2;B.JUN;C.ESR1;D.NOS3图9 β-谷甾醇与靶点的分子对接Fig 9 Molecular docking of beta-sitosterol with targets
2.8 山慈菇对乳腺癌细胞增殖的影响
实验结果显示,90 mg/ml的山慈菇水煎液A组细胞存活率为92.25%,与对照组相比,差异无统计学意义(P>0.05),见表3。其他质量浓度的山慈菇水煎液对乳腺癌细胞具有不同程度的抑制作用,且表现出细胞存活率与质量浓度呈负相关性的趋势。
表3 山慈菇水煎液对乳腺癌细胞增殖的影响Tab 3 Effects of water extract of iphigenia indica on proliferation of breast cancer cells n=96)
3 讨论
本研究运用网络药理学方法预测山慈菇对乳腺癌的可能作用机制,发现山慈菇共有3个活性成分,作用于70个药物靶点。其中豆甾醇和β-谷甾醇是山慈菇治疗乳腺癌的主要化合物。现代研究结果表明,山慈菇发挥抑制肿瘤增殖的作用与干预IL-6等炎症因子释放、改善肿瘤微环境有关[18]。山慈菇中的豆甾醇可通过调控凋亡基因表达,阻断恶性肿瘤细胞转移[19-20];β-谷甾醇可阻滞恶性肿瘤细胞的细胞周期,并触发凋亡性死亡[21]。
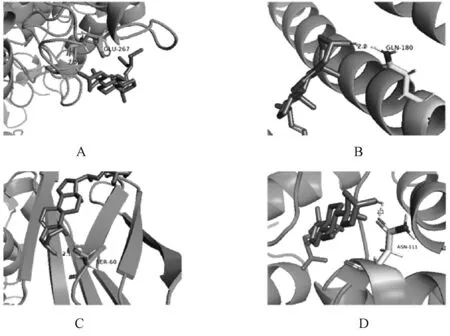
A.PTGS2;B.JUN;C.ESR1;D.NOS3A.PTGS2;B.JUN;C.ESR1;D.NOS3图10 豆甾醇与靶点的分子对接Fig 10 Molecular docking of stigmasterol with targets
对山慈菇与乳腺癌的共同靶点进行PPI映射,并构建核心靶点网络图,出现频次较高的关键靶点有4个,分别为PTGS2、JUN、ESR1和NOS3,可作为潜在治疗靶点。前列腺素内过氧化物合酶2(PTGS2/COX-2)在肿瘤细胞增殖和转移中具有重要作用。研究结果表明,COX-2在伴有淋巴结转移的乳腺癌中处于活跃状态,且高表达的COX-2常提示患者不良预后[22-23]。化合物豆甾醇和β-谷甾醇能够抑制COX-2的表达,进而在乳腺癌的治疗中发挥效能[24]。ER是乳腺癌内分泌治疗的重要靶点之一,其中ERα蛋白由ESR1基因编码,与乳腺癌关系最为密切[25-26]。基础研究结果发现,晚期乳腺癌患者中ESR1突变率高,对内分泌治疗效果较差,常联合中医药辅助治疗,效果显著[27-28]。郭淳等[29]通过实验发现,山慈菇水煎剂对ER阳性的Luminal型乳腺癌细胞的增殖具有一定的抑制作用。一氧化氮合酶(NOS)能够催化产生一种重要的信号调节因子(一氧化氮)。NOS在乳腺癌中表达增多,推动了肿瘤血管生成、肿瘤进展和转移[30]。Pandith等[31]的研究结果发现,豆甾醇能明显减少COX-2和NOS mRNA的表达。
进一步分析发现,山慈菇治疗乳腺癌涉及多个生物学过程,主要集中在对类固醇激素的结合和反应;代谢通路富集分析表明,关键靶点富集在雌激素信号通路、内分泌抵抗、糖尿病并发症中的AGE-RAGE信号通路和乳腺癌等通路。从分子对接结果可知,豆甾醇和β-谷甾醇与PTGS2、JUN、ESR1和NOS3的结合能均<-20.93 kJ/mol,说明山慈菇与靶点具有较好的结合活性。最后通过细胞实验证实,山慈菇水煎液对乳腺癌细胞具有较强的抑制作用,且随着浓度的提升,对乳腺癌细胞的杀伤作用逐渐增强。
综上所述,本研究运用网络药理学方法、分子对接技术和细胞实验,对山慈菇抗乳腺癌的作用机制和物质基础进行了初步探索。山慈菇中的主要化合物豆甾醇和β-谷甾醇,可能以PTGS2、JUN、ESR1和NOS3为主要结合靶点,通过癌症途径、雌激素信号通路等发挥抗肿瘤作用,并通过实验证实山慈菇对乳腺癌细胞的杀伤作用,充分体现了中药抗肿瘤具有多成分、多靶点和多层次的特点。但本研究仍存在一些不足之处,数据库不能完全包括药物所有的化学成分及其相应的靶点,且化学生物学方法本身也具有一定的局限性。
