乳疾康纳米微乳制剂治疗乳腺增生小鼠的药效学研究Δ
2021-12-09徐巧玲唐华非
张 弦,赵 强,徐巧玲,丁 一,李 霞,唐华非,马 瑞#
(1.解放军第305医院药局,北京 100017; 2.空军军医大学西京医院药学部,陕西 西安 710032)
乳腺增生在中年女性群体中具有较高的发病率,并与乳腺癌的发生有着密切关联[1]。伴有非典型乳腺增生的女性,在10年内发展为浸润性乳腺癌的风险约为4%~7%,在整个生命过程中发展为恶性肿瘤的概率增加4倍[2]。调查结果显示,我国女性乳腺增生的发生主要在30~40岁,近年来发病率呈逐步升高趋势[3]。目前,乳腺增生的发病机制尚未完全阐明,关于该病的治疗方法多样,西医学认为主要病因以内分泌失调为主,通过心理和药物干预,必要时采取手术进行治疗[4];国内多采用中医药治疗乳腺增生,其中中药外用治疗方法安全有效、无显著不良反应,易于被患者接受[5-7]。乳疾康纳米微乳制剂是由丹参、黄芪、肉苁蓉、葛根、山药和玫瑰等多种中药材制成的中药复方制剂,采用恒低温18 ℃破壁提取技术,保留了植物的有效活性成分,递送载体为90 nm微乳技术组分,全方具有温阳活血、化痰软坚的功效[8]。本研究旨在对乳疾康纳米微乳制剂治疗乳腺增生小鼠的药效学进行研究。
1 材料与方法
1.1 仪器
80-2型台式低速离心机(上海医疗器械股份有限公司医疗设备厂);WH-2型振荡器(上海沪西分析仪器厂);Tanon5200型化学发光成像系统(上海天能科技有限公司);muLISKANMK3型酶标仪(美国Thermo公司);JJ-12J型脱水机(武汉俊杰电子有限公司);RM2016型切片机(德国莱卡公司);JB-P5型包埋机(武汉俊杰电子有限公司);Nikon Eclipse CI型成像系统(日本尼康公司);Centrifuge 5415R型4 ℃离心机(美国Eppendorf公司);muLISKANMK3型磁力搅拌器(江苏中大仪器科技有限公司);KD-P型组织摊片机(浙江省金华市科迪仪器设备有限公司)。
1.2 实验动物与分组
选取7~8周的SPF级雌性ICR小鼠30只,体重20~25 g(购买于斯贝福,动物合格证编号:NO.1103242011003580),随机分为5组,每组6只小鼠,分别为正常组、模型组和治疗组[溴隐亭组(涂抹溴隐亭)、高剂量组(涂抹高剂量乳疾康纳米微乳制剂)和低剂量组(涂抹低剂量乳疾康纳米微乳制剂)]。
1.3 药品与试剂
苯甲酸雌二醇(北京Solarbio公司,批号为E8430);黄体酮注射液(浙江仙琚制药股份有限公司,批准文号为国药准字H33020828,规格为1 ml∶20 mg);0.9%氯化钠溶液(国药集团荣生制药有限公司,批准文号为国药准字H20044024,规格为10 ml∶90 mg);乳疾康纳米微乳制剂(自制);甲磺酸溴隐亭片(意大利DOPPEL Farmaceutici S.r.l.公司,注册证号为国药准字HJ20160030,规格为2.5 mg);雌二醇(E2)检测试剂盒(南京建成生物工程研究所,批号为H102);孕酮(P)检测试剂盒(南京建成生物工程研究所,批号为H089);苏木素-伊红染色液(北京雷根生物技术有限公司,批号为DH0006);TUNEL细胞凋亡检测试剂盒(上海碧云天生物技术有限公司,批号为C1098);抗小鼠Caspase-3抗体(英国Abcam公司,批号为ab4051);抗小鼠Bcl-2抗体(英国Abcam公司,批号为ab182858)。
1.4 造模与实验方法
模型组和治疗组小鼠分别腹腔注射苯甲酸雌二醇,剂量为0.5 mg/kg,隔日注射1次,连续30 d;正常组小鼠注射等体积0.9%氯化钠溶液,周期为30 d[9]。给药30 d后,模型组和治疗组小鼠连续3 d腹腔注射黄体酮,剂量为0.5 mg/kg;正常组小鼠注射等量0.9%氯化钠溶液。模型构建成功后,治疗组小鼠乳房涂抹不同剂量的乳疾康纳米微乳制剂,1日2次,连续30 d;溴隐亭组小鼠涂抹溴隐亭,1日1次,连续30 d;模型组和正常组小鼠涂抹0.9%氯化钠溶液,1日2次,连续30 d。
1.5 样本收集和观察指标
动物模型构建过程中,每周观察小鼠体重;末次给药后,小鼠经异氟烷呼吸麻醉后,腹部脱毛,游标卡尺量取腹部第二对乳头乳晕直径、乳头直径;腹主动脉采血,应用生化检测法测定血清中E2、P水平;乳晕基底部最大面积截取乳房,经4%多聚甲醛固定后,脱水,石蜡包埋,制备切片,采用苏木精-伊红(HE)染色观察小鼠乳房组织病理变化,对乳房增生病理变化核心指标进行分析[10];应用TUNEL染色法观察小鼠乳房组织细胞凋亡情况并进行半定量统计分析;应用免疫印迹(Western Blot)法检测活化Caspase-3和Bcl-2蛋白变化。
1.6 统计学方法
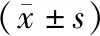
2 结果
2.1 体重变化
注射苯甲酸雌二醇30 d后,与正常组比较,模型组小鼠的体重明显升高,差异有统计学意义(P<0.05);与模型组比较,溴隐亭组小鼠的体重明显降低,差异有统计学意义(P<0.01);与模型组比较,乳疾康纳米微乳低剂量、高剂量治疗组小鼠的体重均明显降低,差异均有统计学意义(P<0.05);治疗组与正常组小鼠体重比较,差异均无统计学意义(P>0.05),见表1。这可能是因为模型组小鼠体内雌激素水平升高,导致小鼠代谢紊乱,而外用乳疾康纳米微乳制剂能通过调理小鼠体内雌激素水平,改善小鼠代谢水平。

表1 五组小鼠体重变化比较Tab 1 Comparison of changes of body mass among five
2.2 乳晕与乳头直径的变化
模型组小鼠注射苯甲酸雌二醇后,乳晕、乳头直径明显增大,与正常组比较,差异均有统计学意义(P<0.001,P<0.000 1);治疗组小鼠涂抹乳疾康纳米微乳制剂30 d后,高剂量组小鼠乳晕、乳头直径较模型组明显减小,差异均有统计学意义(P<0.01,P<0.001),低剂量组小鼠与模型组的差异也有统计学意义(P<0.05,P<0.05),见表2。表明乳疾康纳米微乳制剂能显著抑制小鼠体内雌激素对乳腺的刺激作用。

表2 五组小鼠乳晕和乳头直径变化比较Tab 2 Comparison o changes of areola and nipple diameter among five groups of
2.3 血清E2、P水平变化
五组小鼠血清E2、P水平变化见图1。由图1可见,与正常组比较,模型组小鼠血清E2水平显著升高,P水平显著降低,差异均有统计学意义(P<0.001);溴隐亭组与模型组小鼠血清E2、P水平比较,差异均有统计学意义(P<0.001);与模型组比较,高剂量组小鼠血清E2水平大幅降低,且P水平明显升高,差异均有统计学意义(P<0.05);与模型组比较,低剂量组小鼠血清E2水平降低,P水平升高,但差异无统计学意义(P>0.05)。说明乳疾康纳米微乳制剂能够很好地调节小鼠体内雌激素水平的变化,有效抵抗雌激素紊乱。

A.E2;B.P;与模型组比较,*P<0.05,***P<0.001;与正常组比较,###P<0.001A.E2;B.P; vs. the model group, *P<0.05, ***P<0.001; vs. the normal group, ###P<0.001图1 五组小鼠血清E2、P水平变化Fig 1 Comparison of changes of serum E2 and P levels among five groups of mice
2.4 病理结构变化
A.正常组;B.溴隐亭组;C.高剂量组;D.低剂量组;E.模型组;与模型组比较,*P<0.05,***P<0.001;与正常组比较,####P<0.000 1A.normal group; B.bromocriptine group; C.high-dose group; D.low-dose group; E.model group; vs. the model group, *P<0.05, ***P<0.001; vs. the normal group, ####P<0.000 1图2 五组小鼠病理结构变化(×100)Fig 2 Changes of pathogeny structure in five groups of mice (×100)
对各组小鼠乳房组织HE染色结果进行观察发现,正常组小鼠乳腺组织结构正常,乳腺小叶形态规则,体积小,腺泡上皮细胞正常,乳腺导管上皮细胞排列整齐,见图2(A)。溴隐亭组小鼠乳腺组织结构轻度异常,腺泡数量无明显增多,腺腔无明显扩张,个别上皮细胞可见坏死,腺泡腺腔轻度扩张,见图2(B)。模型组小鼠乳腺组织结构异常,乳腺小叶数量明显增多,小叶体积较大,腺泡数增多,腺泡腔和腺导管腔扩张,多囊呈筛状,上皮细胞排列紊乱,部分上皮细胞坏死,胞核固缩深染,间质水肿,纤维组织增生,见图2(E)。与模型组比较,高剂量组小鼠乳腺组织结构只有轻度异常,腺泡数量增多,上皮细胞结构基本恢复正常,无明显变性坏死,泡腺腔轻度扩张,见图2(C);但是低剂量组小鼠的乳腺结构仍异常,乳腺小叶腺泡数量较多,部分乳腺管腔扩张,上皮细胞可见坏死变性,图2(D)。对各组小鼠的病理结构变化评分结果进行统计分析,模型组小鼠与正常组比较,差异有统计学意义(P<0.000 1);溴隐亭组小鼠与模型组比较,差异有统计学意义(P<0.001);高剂量组小鼠与模型组比较,差异有统计学意义(P<0.05),见图2(F)。该结果提示,外用高剂量的乳疾康纳米微乳制剂对乳腺增生具有良好的预后效果。
2.5 组织细胞凋亡情况
各组小鼠乳腺组织TUNEL染色结果显示,正常组几乎没有观察到凋亡细胞,见图3(A);溴隐亭组只有少量凋亡细胞,与模型组比较,差异有统计学意义(P<0.001),见图3(B)、图3(F);与正常组比较,模型组凋亡细胞数量急剧增加,差异有统计学意义(P<0.000 1),见图3(E)、图3(F);高剂量组有部分凋亡细胞,但与模型组比较,凋亡细胞显著降低,差异有统计学意义(P<0.001),见图3(C)、图3(F);与模型组比较,低剂量组凋亡细胞也有所减少,差异有统计学意义(P<0.001),见图3(D)、图3(F)。该结果说明乳疾康纳米微乳制剂在一定程度上还可以抑制乳腺组织上皮细胞凋亡。

A.正常组;B.溴隐亭组;C.高剂量组;D.低剂量组;E.模型组;与模型组比较,***P<0.001;与正常组比较,###P<0.000 1A.normal group; B.bromocriptine group; C.high-dose group; D.low-dose group; E.model group; vs. the model group, ***P<0.001; vs. the normal group, ###P<0.000 1图3 五组小鼠组织细胞凋亡情况(×200)Fig 3 Cell apoptosis in five groups of mice (×200)
2.6 Casepase-3和Bcl-2蛋白表达情况
各组Western Blot蛋白定量分析结果显示,与正常组比较,模型组的Caspase-3表达明显降低(P<0.001),Bcl-2的表达明显升高(P<0.001),差异均有统计学意义;而治疗组分别与模型组比较,Caspase-3表达显著上调(P<0.001,P<0.001),Bcl-2的表达显著下调(P<0.001,P<0.01),差异均有统计学意义,见图4。该结果进一步说明,乳疾康纳米微制剂可通过抑制乳腺细胞的凋亡,降低乳腺组织癌变概率。
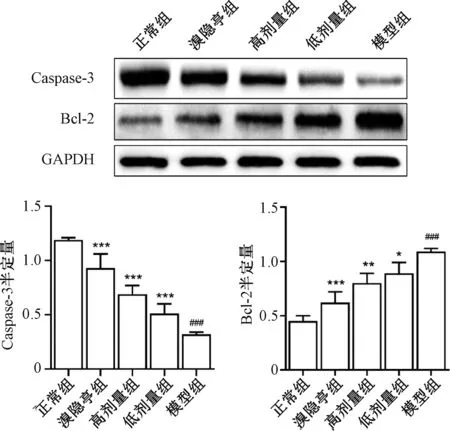
与模型组比较,*P<0.05,**P<0.01,***P<0.001;与正常组比较,###P<0.001vs. the model group, *P<0.05, **P<0.01, ***P<0.001; vs. the normal group, ###P<0.001图4 五组小鼠Caspase-3和Bcl-2蛋白表达水平Fig 4 Expression of Caspase-3 and the Bcl-2 protein in five groups of mice
3 讨论
乳腺增生为女性人群高发疾病,其病理因素主要包括:(1)雌激素和孕激素比例失调,使乳腺实质增生过度;(2)乳腺性激素受体异常,使乳腺各部分增生程度参差不齐;(3)催乳素水平升高,影响乳腺生长、发育和泌乳功能[11]。中医认为,乳腺增生的病因是肝郁痰凝、冲任失调,病机多为因肝气郁结或肝病犯脾,导致气滞、血瘀、痰凝互结于乳房,形成肿块或疼痛[12-13]。
乳腺增生组织癌变是一种多基因多分子共同参与的过程,涉及凋亡、坏死和氧化应激等多种机制,其中Caspase-3和Bcl-2在细胞凋亡过程中起到重要调控作用,且与恶性肿瘤的发展密切相关[14]。临床研究结果发现,在乳腺癌患者中,Caspase-3蛋白表达阳性率显著低于乳腺良性病变患者,而Bcl-2蛋白表达阳性率显著高于乳腺良性病变患者。故Caspase-3和Bcl-2蛋白表达被作为临床评价乳腺癌生物学行为及判断预后的重要参考指标[15]。
本研究采用性激素紊乱乳腺增生小鼠模型,研究中药制剂乳疾康纳米微乳制剂对乳腺增生及肿瘤相关蛋白的调控作用,结果显示,乳疾康纳米微乳制剂能有效调控内分泌失调、雌激素紊乱所致体重增加,乳晕、乳头增大,血清E2水平升高和P水平降低等病理变化,且相关疗效呈剂量依赖趋势,由此可以推测,该药对机体性激素具有很好的平衡调控作用,可能与肉苁蓉、葛根和玫瑰提取物的激素样作用以及黄芪提取物抑制炎症因子表达相关[16-20]。同时,使用乳疾康纳米微乳制剂能显著调控增生乳腺结节组织中凋亡相关蛋白Caspase-3及Bcl-2的表达水平,因此具有一定程度的抑制增生乳腺结节癌变的作用。
综上所述,乳疾康纳米微乳制剂能显著抑制由于激素紊乱而导致的小鼠乳腺增生及相关并发症,并能够一定程度抑制增生组织癌变进程,其机制可能与其中多种有效成分的抗氧化作用及类激素作用相关。本实验可为中药治疗乳腺增生的研究和开发提供前期的理论依据,但所有中药组分的协同治疗机制还有待进一步研究。
