大柴胡汤加减联合利拉鲁肽对肥胖2型糖尿病患者糖代谢指标与炎性因子水平的影响
2021-12-09徐敏
徐 敏
(丰都县中医院内分泌科,重庆 408299)
肥胖2型糖尿病是一种由胰岛素分泌受损、胰岛素抵抗等原因导致的内分泌疾病,可明显降低机体对于糖分的代谢利用率,临床上可表现为口渴、口干、多尿等症状,如不及时加以治疗并控制血糖水平,严重者可引发周围神经病变,危及患者生命健康。利拉鲁肽是一种人胰高糖素样肽-1(GLP-1)类似物,其能够使胰岛细胞再生,同时还能降低血压,减轻体质量,保护心血管,但可能会造成患者低血糖或出现急性胰腺炎,影响患者消化系统[1]。中医认为,肥胖2型糖尿病属于“消渴”范畴,其重要病因在于“中满内热”,因而肝脏郁结、气血不顺,治疗应遵循清热解郁、补气祛湿等原则[2]。大柴胡汤加减中含有柴胡、黄芩等多种中药,有祛痰败火、疏通经脉等功效,能够消除内热、疏郁补气,同时减少并发症的发生,且安全性较高,多用于治疗高血压、胆囊炎等疾病[3]。本研究旨在探讨大柴胡汤加减联合利拉鲁肽对肥胖2型糖尿病患者糖代谢指标及血清肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-2(IL-2)、C-反应蛋白(CRP)水平的影响,现报道如下。
1 资料与方法
1.1 一般资料 按照随机数字表法将丰都县中医院2019年2月至2020年2月收治的40例肥胖2型糖尿病患者分为对照组(20例,在常规治疗的基础上采用利拉鲁肽治疗)和试验组(20例,在对照组的基础上采用大柴胡汤治疗)。对照组中男、女患者分别为12、8例;年龄34~69岁,平均(50.87±6.41)岁;病程1~12年,平均(7.48±2.13)年。试验组中男、女患者分别为11、9例;年龄35~69岁,平均(51.56±5.91)岁;病程1~11年,平均(8.11±1.97)年。对比两组患者一般资料,差异无统计学意义(P>0.05),可实施组间对比。诊断标准:符合《中国2型糖尿病防治指南(2017年版)》[4]与《中药新药临床研究指导原则(试行)》[5]中关于“消渴病”的诊断标准。纳入标准:符合上述中西医诊断标准,且经临床医师检查确诊者;年龄30~70岁者;对本研究所用药物无过敏反应者等。排除标准:1型糖尿病者;并发恶性肿瘤、肝肾功能不全及严重贫血者;临床治疗依从性较差无法配合研究者等。本研究经丰都县中医院医学伦理委员会批准,且患者签署知情同意书。
1.2 治疗方法 两组患者均进行常规治疗:控制饮食、口服常规降糖药物等。同时给予对照组患者利拉鲁肽注射液(Novo Nordisk A/S,注册证号J20160037,规格:3 mL∶18 mg)皮下注射治疗,起始剂量为0.5 mg/次,1次/d;当空腹血糖(FPG)水平>7.5 mmol/L,餐后2 h血糖(2 h PG)水平>11.5 mmol/L时,将剂量调至1.2 mg/次,1次/d;剂量调整周期为1次/2周,但最大剂量不超过1.8 mg/d。试验组患者在对照组的基础上联合大柴胡汤加减进行治疗。大柴胡汤方剂:柴胡、黄芩各18 g,大黄、黄连、枳实、全瓜蒌各16 g,半夏、白芍各9 g,甘草7 g。将药材水煎去渣滓至200 mL,1剂/d,早晚2次分别温服。两组患者均以4周为1个疗程,共治疗3个疗程。
1.3 观察指标 ①对比两组患者治疗前后体质量、体质量指数(BMI),BMI=体质量(kg)/身高2(m2)。②对比两组患者治疗前后的FPG、2 h PG及糖化血红蛋白(HbA1c)水平。分别于治疗前后抽取两组患者空腹静脉血5 mL与餐后2 h静脉血5 mL,离心(3 000 r/min,10 min),取血清,采用葡萄糖氧化酶法测定FPG、2 h PG水平,采用高效液相离子交换层析法测定HbA1c水平。③使用放射免疫分析法检测并对比两组患者治疗前后空腹血胰岛素水平(FINS),并计算胰岛素抵抗(HOMA-IR)与β-细胞功能指数(HOMA-β),HOMA-IR=FPG×FINS/22.5,HOMA-β=20×FINS/(FPG-3.5)。④对比两组患者治疗前后的血清炎性因子水平。血液采集与血清制备同方法②,使用酶联免疫吸附实验法测定。
1.4 统计学方法 通过SPSS 23.0统计软件进行数据分析,计量资料以(±s)表示,采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 体质量、BMI水平 相较于治疗前,治疗后试验组患者体质量、BMI水平均显著降低,且试验组显著低于对照组,差异均有统计学意义(均P<0.05),见表1。
表1 两组患者体质量、BMI水平比较( ±s)
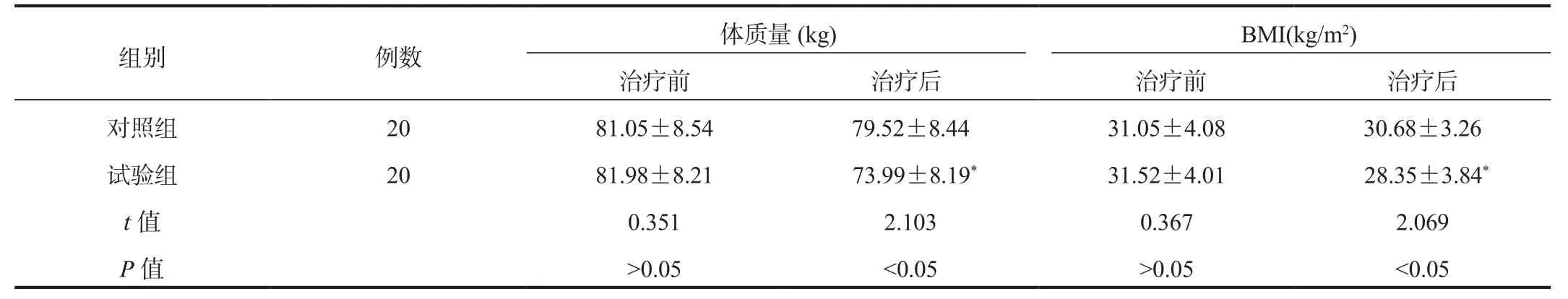
表1 两组患者体质量、BMI水平比较( ±s)
注:与治疗前比,*P<0.05。BMI:体质量指数。
组别 例数 体质量(kg) BMI(kg/m2)治疗前 治疗后 治疗前 治疗后对照组 20 81.05±8.54 79.52±8.44 31.05±4.08 30.68±3.26试验组 20 81.98±8.21 73.99±8.19* 31.52±4.01 28.35±3.84*t值 0.351 2.103 0.367 2.069 P值>0.05<0.05>0.05<0.05
2.2 FPG、2 h PG及HbA1c水平 相较于治疗前,治疗后两组患者FPG、2 h PG及HbA1c水平均显著降低,且试验组显著低于对照组,差异均有统计学意义(均P<0.05),见表2。
表2 两组患者FPG、2 h PG及HbA1c水平比较( ±s)
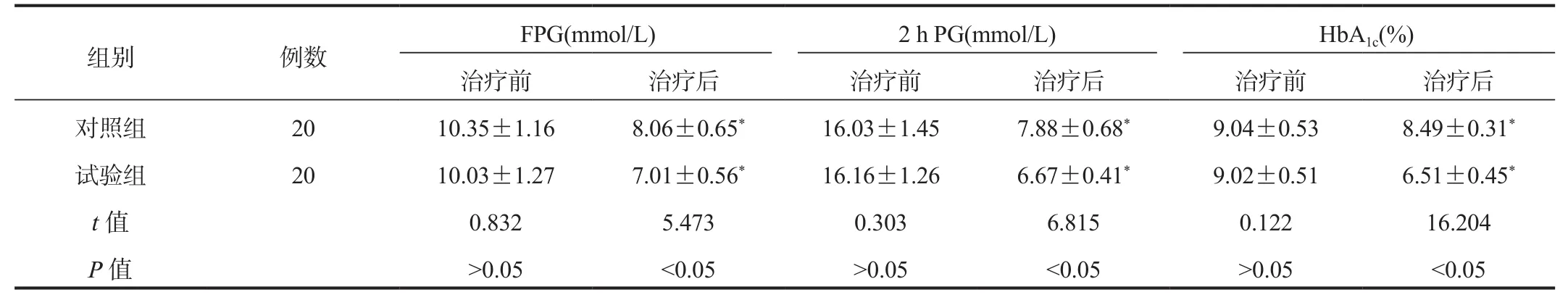
表2 两组患者FPG、2 h PG及HbA1c水平比较( ±s)
注:与治疗前比,*P<0.05。FPG:空腹血糖;2 h PG:餐后2 h血糖;HbA1c:糖化血红蛋白。
组别 例数 FPG(mmol/L) 2 h PG(mmol/L) HbA1c(%)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 20 10.35±1.16 8.06±0.65* 16.03±1.45 7.88±0.68* 9.04±0.53 8.49±0.31*试验组 20 10.03±1.27 7.01±0.56* 16.16±1.26 6.67±0.41* 9.02±0.51 6.51±0.45*t值 0.832 5.473 0.303 6.815 0.122 16.204 P值>0.05<0.05>0.05<0.05>0.05<0.05
2.3 HOMA-IR、HOMA-β水平 相较于治疗前,治疗后两组患者HOMA-IR水平均显著降低,且试验组显著低于对照组;治疗后两组患者HOMA-β水平均显著升高,且试验组显著高于对照组,差异均有统计学意义(均P<0.05),见表 3。
表3 两组患者HOMA-IR和HOMA-β水平比较( ±s)
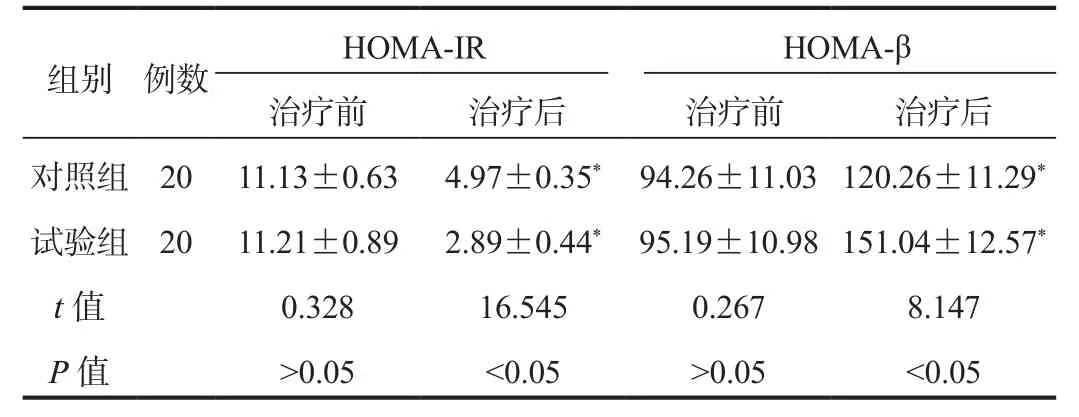
表3 两组患者HOMA-IR和HOMA-β水平比较( ±s)
注:与治疗前比,*P<0.05。HOMA-IR:胰岛素抵抗;HOMA-β:β-细胞功能指数。
组别 例数 HOMA-IR HOMA-β治疗前 治疗后 治疗前 治疗后对照组 20 11.13±0.63 4.97±0.35* 94.26±11.03 120.26±11.29*试验组 20 11.21±0.89 2.89±0.44* 95.19±10.98 151.04±12.57*t值 0.328 16.545 0.267 8.147 P值>0.05<0.05>0.05<0.05
2.4 炎性因子水平 相较于治疗前,治疗后两组患者血清TNF-α、IL-6、IL-2及CRP水平均显著降低,且试验组显著低于对照组,差异均有统计学意义(均P<0.05),见表4。
表4 两组患者血清TNF-α、IL-6、IL-2及CRP水平比较( ±s)
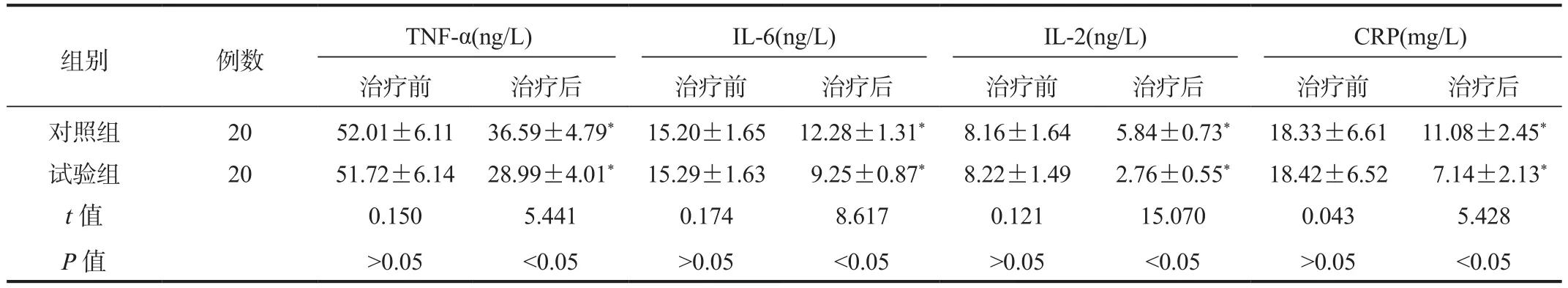
表4 两组患者血清TNF-α、IL-6、IL-2及CRP水平比较( ±s)
注:与治疗前比,*P<0.05。TNF-α:肿瘤坏死因子-α;IL-6:白细胞介素-6;IL-2:白细胞介素-2;CRP:C-反应蛋白。
组别 例数 TNF-α(ng/L) IL-6(ng/L) IL-2(ng/L) CRP(mg/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 20 52.01±6.11 36.59±4.79* 15.20±1.65 12.28±1.31* 8.16±1.64 5.84±0.73* 18.33±6.61 11.08±2.45*试验组 20 51.72±6.14 28.99±4.01* 15.29±1.63 9.25±0.87* 8.22±1.49 2.76±0.55* 18.42±6.52 7.14±2.13*t值 0.150 5.441 0.174 8.617 0.121 15.070 0.043 5.428 P值>0.05<0.05>0.05<0.05>0.05<0.05>0.05<0.05
3 讨论
肥胖2型糖尿病的主要病理在于胰岛β细胞功能衰竭,同时胰岛素对葡萄糖的刺激效应有所减弱,进而引发患者血糖波动。由于肥胖患者体内脂肪细胞增大,脂肪细胞表面的胰岛素受体密度变小,导致机体对胰岛素的敏感性明显降低,进而可产生胰岛素抵抗,长期可发展成为2型糖尿病,因此肥胖与2型糖尿病的发病相互影响且有密切联系。利拉鲁肽通过激活GLP-1受体,从而促进胰岛素的释放,对胰高血糖素的分泌起到抑制作用,减轻饥饿感并减少能量摄入,从而降低体质量,达到降低血糖、增强胰岛素敏感性的效果,但是使用过程中患者易产生胃肠不适、腹痛等不良反应[6]。
中医认为,肥胖2型糖尿病属于“消渴”范畴,消渴亦包括甲状腺功能亢进、尿崩症等有消渴证候的疾病,可由情志、饮食、劳伤、外感等方面因素诱发,阴虚与燥热是消渴病(糖尿病)的主要病机,两者互为因果,因此临床上可表现出肺燥、胃热、肾虚的病理变化。大柴胡汤加减方中柴胡解表退热、疏气缓阳;大黄驱热解毒、舒络消滞;甘草清热顺气、败火燥湿;瓜蒌润燥卸热、清热涤痰;黄芩泻火解毒、消炎抗菌;半夏止咳化痰、去肺热;白芍养血调脾;枳实破气散痞;黄连清热燥湿、泻火解毒,多种药物相辅相成,共同发挥内泻热结、行气活血的功效[7]。糖尿病的重要病理环节就是胰岛素抵抗,柴胡可抑制肠道对脂质的吸收,促进脂质的排泄,从而缓解患者机体出现的胰岛素抵抗;大黄可促进葡萄糖耐量的改善,进而有助于恢复胰岛素的分泌功能,对胰岛功能起到保护作用;枳实可促进脂质代谢,降低患者的血糖水平,同时具有减肥的功效[8]。本研究结果显示,治疗后,试验组患者的体质量、BMI、FPG、2 h PG、HbA1c及HOMA-IR水平均显著低于对照组;试验组患者HOMA-β水平显著高于对照组,表明大柴胡汤加减联合利拉鲁肽能够减轻肥胖2型糖尿病的体质量,优化糖代谢指标,改善糖代谢紊乱,提高治疗效果。
TNF-α主要通过阻碍脂肪细胞中葡萄糖转运蛋白4(GLUT4)基因转录,使得mRNA降解的方式抑制胰岛素,从而引发HOMA-IR,影响患者糖代谢指标,加重患者的病情严重程度。GLUT4在细胞层的水平可对血清IL-6浓度造成一定影响,对由胰岛素参与的脂肪和葡萄糖运输过程起到显著的阻碍作用,最终引起糖尿病[9]。现代药理学研究显示,柴胡中的皂苷可使炎性组胺的释放与白细胞游走被抑制,减轻炎症反应对机体造成的损伤;黄芩中的黄芩素可促进花生四烯酸的代谢,从而抑制炎性介质的生成;大黄中的蒽类衍生物等成分可刺激肾上腺皮质激素增加,促进炎症机体抗炎抗毒的应激反应;甘草的甘草甜素能使得肥大细胞的释放能力得到控制,有明显的抗炎作用[10]。本研究结果显示,相较于对照组,治疗后试验组患者炎性因子水平显著下降,说明大柴胡汤加减联合利拉鲁肽可有效抑制机体炎症反应,提高对肥胖2型糖尿病患者的治疗效果,与李书文[11]研究结果基本一致。
综上,大柴胡汤加减联合利拉鲁肽可明显减轻肥胖2型糖尿病患者的体质量,改善糖代谢紊乱和胰岛β细胞功能,抑制机体炎症反应,但目前本研究样本量较少,临床上可通过增加样本量进行深入研究。
