γ-谷氨酰转移酶与冠心病的相关性研究
2021-12-08蒋元英史玲刘瑶
蒋元英,史玲,刘瑶
随着社会经济发展、饮食结构的改变、社会人口老龄化的趋势,冠心病已经成为危害人类健康的主要病因之一。我国卫生统计数据显示,2009—2016年城市人口心脏疾病病死率仅次于恶性肿瘤,排第2位,农村人口心脏疾病病死率仅次于恶性肿瘤和脑血管病,排第3位。且心脏疾病病死率呈逐年上升趋势[1]。冠心病不仅严重威胁着人类健康,而且其导致劳动力丧失及高昂的医疗费用也给社会和家庭带来了沉重的负担。由于冠心病的高发病率、高致残率和高病死率,其防治工作一直是国内外研究的重点。
γ-谷氨酰转移酶(gamma-glutamyltransferase,GGT)是一个分子量为68 kDa包含2条不等量蛋白链的糖蛋白,其中长链的分子量为46 kDa,短链的分子量为 22 kDa[2]。1993 年,CONIGRAVE 等[3]首次报道了血清GGT活性与心血管疾病病死率相关。PAOLICCHI等[4]发现,GGT、氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)和 CD68(+)泡沫细胞同时存在于脑血管、颈动脉和冠状动脉斑块中。近年来研究认为,血清GGT水平升高是代谢综合征、2型糖尿病、冠心病和脑卒中的危险因素[5-8]。除传统的危险因素之外,近年来又有研究发现多种新型指标与冠心病相关:同型半胱氨酸、GGT、胱抑素C、平均血小板体积(mean platelet volume,MPV)、平均血小板体积/淋巴细胞比值(mean platelet volume lymphocyte ratio,MPVLR)、血小板/淋巴细胞比值(platelet lymphocyte ratio,PLR)、中性粒细胞/淋巴细胞比值(neutral lymphocyte ratio,NLR)等[9-13]。由于 GGT 存在于人体多种组织器官,GGT水平是否能预测冠心病仍未明确。本研究分析GGT是否可以作为冠心病的独立预测指标,以及对比其他新型血常规指标对冠心病的预测效能。
1 对象与方法
1.1 纳入与排除标准 纳入标准:(1)有胸闷、胸痛等典型心绞痛症状;(2)辅助检查如心电图、肌钙蛋白、运动试验等提示为心肌缺血、冠心病或急性冠脉综合征(acute coronary syndrome,ACS);(3)接受过冠状动脉造影检查。排除标准:(1)其他心血管疾病,如心功能不全、心肌病、心脏瓣膜疾病等;(2)感染性疾病、免疫系统疾病、血液疾病;(3)严重肝病,丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)高于参考范围上限2倍;(4)恶性肿瘤;(5)使用过糖皮质激素或免疫抑制剂;(6)超量和大量饮酒者(25~59 g/d为超量饮酒,≥60 g/d为大量饮酒);(7)两周内行外科手术;(8)临床资料缺失。
1.2 研究对象 选取2016年9月—2018年1月在复旦大学附属华山医院行冠状动脉造影的患者481例,其中男302例,女179例;年龄32~94岁,平均年龄(63.9±10.2)岁,<65岁244例,≥65岁237例。根据冠状动脉造影结果分为冠心病组351例,非冠心病组130例。
1.3 一般资料 记录患者性别、年龄、身高、体质量,有无高血压、糖尿病、冠心病家族史、脑梗死、吸烟等。
1.4 实验室检查指标 收集患者术前实验室检查指标,患者入院后空腹12 h采集外周静脉血,包括1管乙二胺四乙酸(EDTA)抗凝管,采血量为1.5~2.2 ml,用于血常规分析。1管生化管,采血量为 4.0~5.0 ml,1 h后3 000 r/min 离心 10 min(离心半径为 21 cm)。实验室检查指标包括:糖化血红蛋白(HbA1c)、GGT、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆 固 醇(low density lipoprotein cholesterol,LDL-C),脂蛋白(a)〔Lipoprotein(a),LP(a)〕、总胆红素、清蛋白、尿酸、肌酐、MPV、ALT、AST,计算MPVLR=平均血小板体积/淋巴细胞计数,PLR=血小板计数/淋巴细胞计数,NLR=中性粒细胞计数/淋巴细胞计数。
1.5 超声心动图 超声心动图仪器型号为:飞利浦 EPIQ5。 左心室射血分数(left ventricular ejection fraction,LVEF)=(舒张末容积-收缩末容积)/舒张末容积×100%。
1.6 冠状动脉狭窄程度评分 根据美国心脏病协会规定的冠状动脉血管图像记分分段评价标准[14],冠状动脉狭窄程度评分×病变部位评分即为病变部位积分,将所有病变部位积分相加即Gensini积分(见表1)。根据Gensini积分将患者分为低危组(<20分)(n=260)、中危组(20~50分)(n=121)、高危组(>50分)(n=100)。

表1 Gensini积分标准Table 1 Gensini scoring system for determining the severity of coronary heart disease
1.7 统计学方法 应用SPSS 20.0统计学软件和MedClac软件分析数据。计量资料符合正态分布采用(±s)表示,两组比较采用独立样本t检验,多组间数据比较采用单因素方差分析(one-way ANOVA),组间两两比较采用LSD-t检验;计数资料比较采用χ2检验;采用MedClac软件绘制受试者工作特征(ROC)曲线,采用Z检验比较ROC曲线下面积(AUC)。以P<0.05为差异有统计学意义。
2 结果
2.1 非冠心病组与冠心病组临床资料比较 非冠心病组与冠心病组性别、年龄、糖尿病发生率、脑梗死发生率、吸烟率、HbA1c、GGT、HDL-C、LP(a)、清蛋白、尿酸、肌酐、ALT、AST、PLR、LVEF比较,差异均有统计学意义(P<0.05)。两组间BMI、高血压发生率、冠心病家族史、TC、LDL-C、总胆红素、MPV、MPVLR、NLR比较,差异均无统计学意义(P>0.05,见表2)。
2.2 低危组、中危组、高危组临床资料比较 低危组、中危组、高危组GGT、NLR比较,差异均有统计学意义(P<0.05,见表3)。三组间其他临床指标比较,差异均无统计学意义,表格中未再展示。
表3 低危组、中危组、高危组临床资料比较(±s)Table 3 Comparison of clinical data of patients with low,medium and high risk of coronary heart disease

表3 低危组、中危组、高危组临床资料比较(±s)Table 3 Comparison of clinical data of patients with low,medium and high risk of coronary heart disease
组别 例数 GGT(U/L) NLR低危组 260 23.6±23.6 2.25±1.01中危组 121 28.5±23.7 2.53±1.31高危组 100 37.4±32.0 2.99±1.88 F值 10.53 11.67 P 值 <0.01 <0.01
2.3 冠心病组及非冠心病组不同年龄间GGT水平、Gensini积分比较 冠心病组患者中,<65岁者GGT水平高于≥65岁,差异有统计学意义(P<0.05);<65岁与≥65岁者Gensini积分比较,差异无统计学意义(P>0.05)。非冠心病组患者中,<65岁与≥65岁者GGT水平、Gensini积分比较,差异均无统计学意义(P>0.05,见表4)。
表4 冠心病组及非冠心病组不同年龄间GGT水平、Gensini积分比较(±s)Table 4 Comparison of average GGT level and Gensini score between patients aged less than 65 years and those aged 65 or over in coronary heart disease group and non-coronary heart disease group

表4 冠心病组及非冠心病组不同年龄间GGT水平、Gensini积分比较(±s)Table 4 Comparison of average GGT level and Gensini score between patients aged less than 65 years and those aged 65 or over in coronary heart disease group and non-coronary heart disease group
组别 例数 G G T(U/L) G e n s i n i积分(分)冠心病组<6 5岁 1 7 4 3 4.4±3 3.8 3 7.3±2 7.6≥6 5岁 1 7 7 2 7.3±2 2.8 3 7.0±3 4.6 t值 2.2 6 0.1 4 P值 0.0 2 0.8 9非冠心病组<6 5岁 7 0 1 9.4±9.7 3.0±3.5≥6 5岁 6 0 1 7.1±7.1 4.3±3.9 t值 -1.4 4 2.1 6 P值 0.1 6 0.3 3
2.4 冠心病发生影响因素的多因素Logistic回归分析以是否发生冠心病为因变量(赋值:是=1,否=0),以单因素分析差异有统计学意义的项目性别(赋值:男=1,女=2)、年龄(连续变量)、糖尿病(赋值:是=1,否=0)、脑梗死(赋值:是=1,否=0)、吸烟(赋值:是=1,否=0)、HbA1c(连续变量)、GGT(连续变量)、HDL-C(连续变量)、LP(a)(连续变量)、清蛋白(连续变量)、尿酸(连续变量)、肌酐(连续变量)、ALT(连续变量)、AST(连续变量)、PLR(连续变量)、LVEF(连续变量)、Gensini积分(连续变量)为自变量,代入多因素Logistic回归方程,结果显示,HbA1c、GGT、ALT、AST和Gensini积分与冠心病发生有回归关系(P<0.05,见表5)。
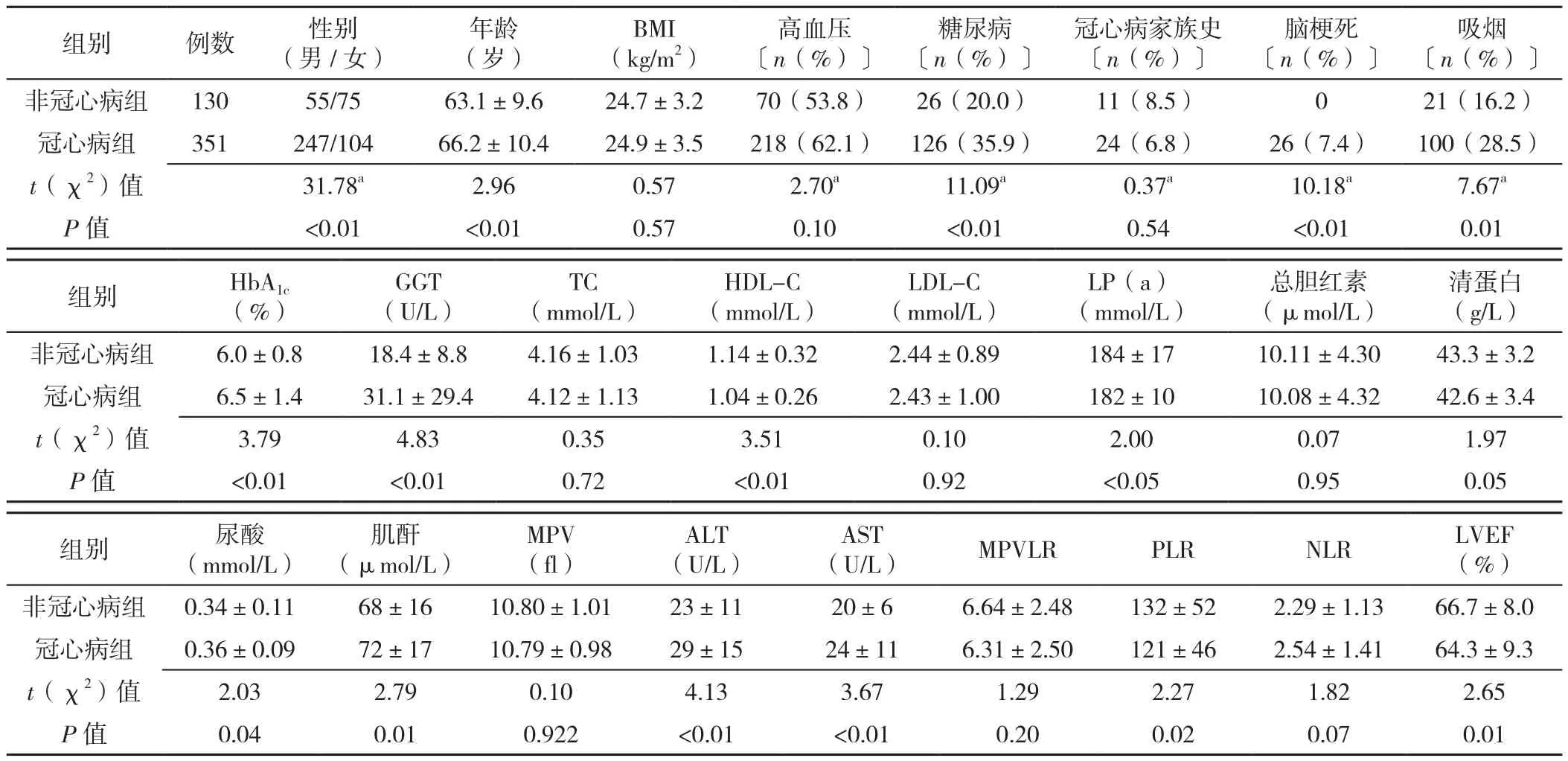
表2 非冠心病组与冠心病组临床资料比较Table 2 Comparison of clinical data between patients with coronary heart disease and those without
2.5 ROC曲线分析 HbA1c诊断冠心病的AUC为0.572〔95%CI(0.527,0.617)〕,GGT诊断冠心病的AUC为0.679〔95%CI(0.635,0.720)〕,Gensini积分诊断冠心病的AUC为0.959〔95%CI(0.937,0.975)〕(见图1)。Gensini积分诊断冠心病的AUC大于HbA1c和GGT,差异有统计学意义(Z=10.305,P<0.001;Z=13.865,P<0.001);GGT诊断冠心病的AUC大于HbA1c,差异有统计学意义(Z=2.906,P=0.004)。
3 讨论
2004年公布的INTERHEART研究对包括中国在内的52个国家的262个中心的15 152例急性心肌梗死患者和14 820例正常人群进行了病例对照分析,发现九大因素可以解释90%的男性和94%的女性发生心肌梗死的原因,其中包括六大危险因素:血脂异常、吸烟、高血压、糖尿病、腹型肥胖、精神心理压力过大;三大保护因素:水果和蔬菜的摄入、少量规律饮酒、规律运动。这九大因素为冠心病的传统危险因素(或保护因素)[15]。
3.1 GGT与冠心病发展程度相关 本研究结果显示,GGT水平升高与冠心病的发生独立相关。2007年,一项纳入3 451例正常人群的前瞻性研究表明,调整其他危险因素后,GGT水平的对数每增加一个标准差,冠心病的发病率和全因死亡率分别增加13%和26%,并且最高GGT水平组较最低GGT水平组的冠心病发病风险增加67%[16]。德国一项纳入1 878例正常人群的前瞻性研究按 GGT 水平分为 4 组(<13 U/L,13~<20 U/L,20~<35 U/L,≥ 35 U/L),4 组人群发生心肌梗死的风险比(HR)分别为1.00、1.84、2.02、3.08,调整其他影响因素后,最高GG水平组与最低GGT水平组发生心肌梗死的HR为2.34[17]。

表5 冠心病发生影响因素的多因素Logistic回归分析Table 5 Multivariate Logistic regression analysis of the influencing factors of coronary heart disease
本研究结果显示冠心病患者GGT水平明显升高,且随着冠状动脉狭窄程度的增加而升高。DOGAN等[18]在一项纳入237例急性冠脉综合征患者的研究中发现,GGT水平与轻中度冠状动脉病变无明显相关,而与严重冠状动脉病变相关。EMIROGLU等[19]认为GGT水平与急性心肌梗死的相关程度明显高于稳定性心绞痛。本研究的结论与以上论点一致:GGT与冠状动脉严重病变有显著相关性。
3.2 GGT与冠心病患者年龄相关 本研究发现冠心病组患者中,<65岁者GGT水平高于≥65岁。李俊丽[20]研究发现,GGT与早发冠心病相关性更明显,可能由于早发冠心病的危害大、危险因素少且GGT水平明显升高,所以GGT水平对早发冠心病更具提示意义。SHEIKH等[21]对367例早发冠心病患者研究发现,GGT水平在参考范围上限的基础上升高10 U/L可以有效预测冠心病的发生,此时GGT水平与冠心病的OR值为13.34〔95%CI(7.19,24.78)〕,AUC为80.9%〔95%CI(76.5%,85.3%)〕,cut-off值为22.5 U/L,对应的灵敏度和特异度分别为80.1%、70.2%。
正常人群GGT水平随着年龄的增长而升高[22],冠心病患者GGT水平随着年龄增长而降低的机制目前还不清楚[2],其中一种可能的原因是低密度脂蛋白(LDL)-GGT复合物参与斑块的形成,病变部位储存了大量的GGT,从而导致GGT水平的下降。GGT直接参与斑块形成这也可以解释大量流行病学证实的GGT水平越高,人群不良事件发生风险越高。同时这一假设也解释了GGT直接参与斑块形成而不是作为“旁观者”被发现存在于斑块内。
3.3 GGT的致病机制 还原型谷胱甘肽(γ-glutamylcystinyl-glycine,GSH)是机体内主要的抗氧化剂,是清除人体内自由基的主要物质[23-24]。GGT参与细胞外GSH代谢,使其分解为前体氨基酸并通过氨基酸转运体重新吸收进入细胞内合成新的GSH,新合成的GSH在转运体的作用下转移至细胞外继续发挥抗氧化作用和参与γ谷氨酰循环。GSH代谢过程产生了大量活性巯基、活性氧自由基(reactive oxygen species,ROS),包括:超氧化物、硫自由基和过氧化氢等氧化性产物,从而引起铁依赖的氧化反应[25]。其中与冠状动脉斑块形成最密切的氧化反应是LDL氧化为ox-LDL。GSH-GGT来源的过氧化氢可以诱导核因子(NF)-κB通路的激活产生多种细胞因子参与炎性反应和氧化应激,另外氧自由基还参与了脂质过氧化的过程[26]。氧自由基反应和脂质过氧化反应对机体的新陈代谢起着重要的作用,正常情况下两者处于协调与动态平衡状态,调节体内多种生理生化反应和免疫反应。一旦这种协调与动态平衡产生紊乱与失调,就会引起一系列的新陈代谢紊乱和免疫功能降低,形成氧自由基连锁反应,损害生物膜及其功能。
目前,GGT导致冠心病发生的机制主要考虑与以下几个原因:(1)GGT参与体内GSH的代谢,代谢过程中产生的ROS调节脂质氧化和血管平滑肌增殖改变[27-30];(2)ROS 激 活 JNK、MAPK、PI3K/Akt、NF-κB等炎性信号通路,诱导机体产生一系列的炎性反应和氧化应激反应[31-33];(3)GGT与传统冠心病危险因素如高血压、糖尿病、血脂异常、肥胖等相关并相互作用[12]。
研究认为GGT水平提示体内氧化应激状态的意义大于SYNTAX评分[34]。GGT作为明确的氧化应激反应的标志物和参与者,通过药物干预降低血清GGT水平,可达到治疗和预防疾病的目的。笔者认为目前新型治疗药物的研发可以分为两个方向:一是通过抑制机体氧化应激反应;二是降低GGT水平。目前常用的GGT抑制剂主要有阿西维辛和GGsPTM[35]。阿西维辛由于不良反应大,目前很少使用。GGsPTM是目前研究中抑制GGT的有效药物。但是这一类药物目前对人体的安全性相关资料不并完善,还未进入临床应用,所以需要大量的临床试验来验证其有效性和安全性,以期使氧化应激相关的疾病得到有效控制。
综上所述,本研究认为GGT水平升高与冠心病发病独立相关,对早发冠心病和严重冠状动脉病变的诊断和预后有一定的提示意义。由于部分严重冠心病患者临床表现并不典型,一经发现就已经多支病变,需要多根支架植入。而GGT作为相对无创性实验室检查,其对未行冠状动脉造影的严重冠状动脉病变的诊断价值有待后续研究。
由于本文为回顾性研究,对于非实验室指标可能存在回忆性偏倚。且本文样本量不够大,部分数据由于不是用于科学研究用途,所以在结果分析中部分数据和结果可能存在偏差。
作者贡献:蒋元英进行文章的构思与设计,研究的实施与可行性分析,数据收集、整理,统计学处理,结果的分析与解释,撰写论文;刘瑶进行论文的修订;史玲、刘瑶负责文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。
