多模态MRI鉴别胶质母细胞瘤和原发性中枢神经系统淋巴瘤的临床应用价值
2021-12-08龙美霞
龙美霞
原发性中枢神经系统淋巴瘤(intracranial primary central nervous system lymphoma,PCNSL)属于临床上较为常见的恶性肿瘤疾病,属于非霍奇金淋巴瘤,其发病与原位淋巴细胞恶性克隆增生,嗜中枢性淋巴细胞及病毒感染有关,发病后会导致患者出现恶心呕吐、视力障碍、肢体无力和眩晕等症状,严重影响患者的生活品质和生命安全[1]。虽然该肿瘤疾病发生率较低,但近年来随着艾滋病、恶性肿瘤及先天免疫缺陷人群数量增加,该疾病发病率也呈现上升趋势,因此对其的诊断和治疗属于重点研究内容[2]。但该疾病发病机制临床表现多样,给术前诊断带来诸多困难,而影像学作为近年来被广泛应用的诊断技术,将其应用在PCNSL诊断中具有一定的价值[3]。胶质母细胞瘤(glioblastoma,GBM)属WHO Ⅳ级,约占颅内肿瘤的12%~15%,以及星形细胞瘤的60%~70%,常见于成人,儿童发病率低,高峰年龄45~75岁,平均61.3岁,男性多发,是恶性程度最高的星形细胞肿瘤,随着医学诊断技术的进步,该肿瘤日益受到医学界关注[4]。为此,本次研究对MRI多模态检查对GBM和PCNSL的诊断价值进行了探讨,现报告如下。
1 资料与方法
1.1 一般资料
选择本院于2016年5月至2020年5月期间收治的经手术病理确诊的GBM和PCNSL患者65例作为研究对象,均表现出头痛、恶心、视物模糊等症状。其中男性38例,女性27例,年龄30~72岁,平均(49.24±3.46)岁,病程7 d至10个月,平均(2.25±0.48)个月,其中单发59例,多发6例,包含大脑脑叶25例、小脑7例、基底节16例、丘脑6例、胼胝体6例;排除其他部位淋巴系统肿瘤病史患者。
1.2 诊断方法
CT诊断:选择SOMATOM Force 128排螺旋CT机和CE Lightspeed64层螺旋CT扫描机进行检查,协助患者取仰卧位,进行中心定位后,将听眦线作为基线,从颅顶开始扫描,到枕骨大孔下缘。管电压120 kV,管电流200 mA。平扫完成后行增强扫描,层厚5 mm,层距5 mm,矩阵512×512,将碘普罗胺作为对比剂,肘前静脉推注,速率为3.5 ml/s。
MRI诊断:选择MAGNETOM Prisma 3.0T超导型MRI诊断仪进行检查,扫描序列:SET1WI:TR:400 ms,TE13 ms,TSE T2WI:TR:4000 ms,TE110 ms。经肘静脉注射Gd-DTPA,剂量为0.1 mmol/kg,行轴位、冠状位、矢状位扫描。DWI采用EPI序列,TR:6000-90000 ms,TE80-90 ms,层厚5.0 mm,层距0.5 mm,通过单体素1H-MRSTR:1400 ms,TE40 ms,多体素1H-MRSTR:1400 ms,TE140 ms进行釆集,将病灶实性强化区作为感兴趣容积(VOI)区[5]。
1.3 观察指标
两种影像成像均由至少2名资深诊断医师进行独立分析,诊断结果不统一时经讨论后统一结果。比较CT单独诊断、MRI单独诊断及两者联合诊断的阳性率;开展肿瘤实质区、灶周近侧水肿、正常组织代谢物的相对定量分析,包含胆碱(Cho)/肌酸(Cr),Cho/N-乙酰天门冬氨酸(NAA),NAA/Cr[6]。
1.4 统计学处理
2 结果
2.1 多模态MRI诊断成像特征分析
65例患者共69个病灶,经CT平扫检査,69个病灶呈等或高密度,53个为均匀密度,增强扫描表现为均匀强化;经MRI平扫诊断,69个病灶为等或稍低信号,30个病灶DWI为均匀高信号,增强扫描表现为均匀强化,少数表现出环形强化。
2.2 CT、MRI诊断阳性率分析
经诊断,CT检査确诊阳性例数25例,检出率为61%,MRI检査确诊阳性例数27例,检岀率为66%,多模态MRI检査确诊阳性例数35例,检出率为85%,显著高于单独CT和MRI(χ2=6.213,χ2=4.232,P<0.05)。
2.3 肿瘤实质区、灶周近侧水肿区、正常组织代谢物的相对定量分析
22例患者行多体素1H-MRS检查,肿瘤实质区各数据均显著高于灶周近侧水肿区(t=33.95,F=9.37,t=7.36,P<0.05),而灶周近侧水肿区各值3个月后则显著高于正常组织,(F=4.75,F=10.65,F=8.10,P<0.05),结果见表1。
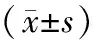
表1 肿瘤实质区、灶周近侧水肿、正常组织代谢物的相对定量分析
2.4 病灶部位
肿瘤位于额叶者4例,位于颞叶者8例。位于顶叶者2例,位于枕叶者3例,其中突破中线者4例,1例突破脑室并于脑室内形成团块样肿瘤灶。
2.5 MRI表现
总体来讲肿瘤T1WI以低信号为主,T2WI以高信号为主,病灶信号不均匀,病灶中心部位多有囊状液性信号影。大部分病灶边缘不清晰,增强时以边缘增强为主。周围水肿带不强化,Flair系列病灶仍呈较高信号。5例患者病灶突破中线结构。4例患者病灶边缘相对清晰,其内密度较均匀,坏死囊变较少,增强时呈现较均匀强化。
3 讨论
胶质母细胞瘤是中枢神经系统恶性程度最高的1种星形细胞瘤,相当于WHO中枢神经系统肿瘤分类Ⅳ级。原发性中枢神经系统淋巴瘤较胶质母细胞瘤相对少见[7]。但近年来由于艾滋病及使用免疫制剂患者的增多,原发性中枢神经系统淋巴瘤的发生率逐年上升。随着造血干细胞移植技术的发展,自体外周血干细胞移植已成为治疗恶性淋巴瘤的重要手段。而胶质母细胞瘤恶性程度较高,多需手术并辅以术后放化疗[8]。因此,正确的术前诊断对提高患者的预后有很大帮助。胶质母细胞瘤和原发性中枢神经系统淋巴瘤的常规MRI特点:典型的胶质母细胞瘤在MRI上表现为实体部分T1WI呈等或低等混杂信号,T2WI呈混杂高信号,少数肿瘤实体内出现T1WI高信号,与肿瘤增殖旺盛或出血有关,且由于肿瘤浸润生长,故边缘模糊,常伴有明显指套样水肿,而典型的原发性中枢神经系统淋巴瘤在MRI表现为T1WI等或稍低信号,T2WI稍低或等信号,信号均匀区,伴有轻中度水肿,钙化、出血及囊变十分少见,这与淋巴瘤胞质少、细胞核大、细胞器缺乏、核糖体丰富以及细胞含水量较少的病理学特征有关[9]。因此,典型的胶质母细胞瘤与原发性中枢神经系统淋巴瘤在MRI平扫上的信号特点有较大不同。但由于原发性中枢神经系统淋巴瘤发病年龄与胶质母细胞瘤相近,部分病灶也可出现囊变坏死,其MRI平扫可表现为不规则混杂长T1长T2信号,增强后呈不规则环状强化,与胶质母细胞瘤类似且不易鉴别[10]。本组原发性中枢神经系统淋巴瘤有10例表现为囊实性混杂长T1、混杂长T2信号,其中有5例初诊为胶质瘤或转移瘤。
胶质母细胞瘤具有高度的恶性生物学行为,属WHO分级Ⅳ级,可以一开始即为恶性,也可能由良性肿瘤(多为WHOⅡ级)发展而来。其生长方式主要为浸润性生长,但血供丰富,生长较快,外观上往往呈现膨胀性生长,呈团块样改变,肿瘤周围血脑屏障破坏并相邻血管功能的异常,造成血管通透性增加,间质水肿[11]。以上的生物学行为特点,同时因肿瘤细胞的间变性,发育不成熟,细胞含水量大且形态不规则,决定了胶质母细胞瘤在MRI上表现为以长T1长T2为主的不均匀信号改变;肿瘤的不均匀快速增长使得中心部位多因缺血缺氧而坏死,故使瘤区中央部位多见囊性液性信号;肿瘤虽然血供丰富,但供瘤血管多不成熟,功能不全,故易出血后造成局部含铁血黄素沉积,因影响局部磁场均匀性,而出现复杂性异常信号(包括短T1短T2和短T1长T2信号);肿瘤的高侵袭性使得病灶常突破中线结构呈现蝴蝶征,本组病例均未发现远处转移[12]。总之,胶质母细胞瘤瘤体大,生长快,病程短,侵袭性强,强化明显,以长T1长T2为主的不均匀信号为其典型影像学表现,可作为其诊断的主要依据[13]。在本组的病例中15岁以下者有4例,在本组中所占比率较高,而胶质母细胞瘤在儿童发病率并不高,考虑原因首先可能是本组病例存在选择偏倚,本组病例选择2016年5月至2020年5月间经本院磁共振检查室检查并且有手术治疗的病人,其中包括外院转诊病人,选取时间段较短,选取范围较窄。其次,从肿瘤信号来讲,本组病例15岁以下者表现为信号及增强较均匀,其原因可能是儿童正处于生长发育期,血管生成的微环境比如VEGF水平等可能更加有助于血管生成,肿瘤缺血缺氧程度因此可能较轻,但在此方面尚无详细报道。第三,胶质母细胸瘤病程短,本组中平均病程6个月,可能病程更快,因此某些复杂影像学特点尚未表现出来。
PCNSL是颅内少见的恶性肿瘤,近年来,随着免疫抑制剂的使用、器官移植的广泛开展,发病率呈増加的趋势,其病因与发病机制目前仍不清楚,临床表现典杂多样,治疗方案以化疗为首选,而胶质瘤是颅内最常见的肿瘤,治疗多采取手术切除,二者鉴别诊断困难[14]。因此,治疗前明确诊断具有直接的临床意义。PCNSL多发于中老年人,平均发病年龄59.4岁,与文献报道一致,胶质瘤好发于中青年,平均发病年龄39.9岁,二者具有统计学羞异,PCNSL和胶质瘤患者以慢性起病多见,其中2例PCNSL患者及5例胶质瘤患者以急性发病就,PCNSL患者多表现为认知功能障碍、偏身肢体无力及头痛等,胶质瘤多表现为头痛、偏身肢体、癫痫等,PCNSL患者无以癫痫症状就诊[15]。PCNSL好发于中线区域深部脑组织,在幕上病灶多位于基底节、胼胝体、丘脑及颞叶等部位,幕下多累及小脑半球,可能是由于PCNSL多起自血管周围间隙内的单核吞噬系统,发生于皮质或皮髓质交界处较少见,本组17例PCNSL患者中,累及基底节9例、胼胝体7例、丘脑6例、颞叶2例,其中7例跨中线生长,与文献报道一致。胶质瘤可发生于颅脑任何部位,额叶17例,顶叶14例,颞叶11例,胼胝体3例,枕叶2例,累计胼胝体3例患者中2例跨中线生长,均为胶质母细胞瘤。病理上PCNSL肿瘤细胞密度较高、有较高的核/浆比、肿瘤组织沿血管周围间隙生长及肿瘤细胞容易聚集,T1WI呈低或稍低信号,T2WI大多数呈等信号或稍高信号,17例患者中未见出血、坏死囊变区,同时由于细胞密度较高、有较高的核/浆比,细胞外间隙变小,水分子弥散受限,DWI呈明显高信号,ADC图信号明显减低,由于肿瘤以血管周围间隙为中心向外浸润生长,破坏血脑屏障导致对比剂大量外渗,増强扫描病变多呈团块状和结节状均匀强化,14例病灶表现为“抱拳征”、“尖角征”等特征性表现,可能与瘤细胞以血管为中心、围绕血管呈“嗜血管”袖套状生长及生长速度不一致有关。由于病变以单个细胞或紧凑的细胞团的形式向脑实质浸润,占位效应较轻;胶质瘤多呈T1WI低信号,T2WI呈高值号,信号均匀程度及强化程度取决于其病理分级。低级别胶质瘤MRI信号较均匀,増强扫描多无强化或仅轻微强化,高级别胶质瘤病灶信号多不均匀,出血、囊变坏死多见,増强扫描呈明显不均匀强化,高级别胶质瘤肿瘤细胞増殖旺盛、细胞密集度高,DWI可呈高信号,而低级别胶质瘤病灶呈浸润性生长且生长速度缓慢,DWI多呈等或稍低信号,本组病例中共4例胶质母细胞瘤,DWI呈明显高信号,中心伴有出血、坏死奏变区,増强扫描呈明显环状强化。有研究表明PCNSL影像学还与患者的免疫状态及组织学类型有关,获得性免疫缺陷综合征患者PCNSL病灶可呈典型的“环样”强化合并中心性坏死。
PCNSL作为起源于神经系统,对脑组织、颅神经、脊神经等造成损害的恶性肿瘤疾病,发生在脑实质及脑膜内,在免疫缺陷群体发病率也较高。对其的术前诊断可采用CT及MRI检査,其中经CT平扫检查呈等或高密度、均匀密度,增强扫描为均匀强化。MRI平扫诊断为等或稍低信号,DWI为均匀高信号,增强扫描表现为均匀强化,少数表现出环形强化[16]。随着影像学诊断技术的不断进步和发展,不仅可通过影像特征进行诊断,如今MRI还可对病灶进行定性诊断,提供更加详细全面的信息,为诊断及治疗提供可靠依据。本次研究结果显示,CT阳性检出率为61%,MRI阳性检出率为66%,联合检出率为85%,差异显著(P<0.05)。肿瘤实质区各数据均显著高于灶周近侧水肿区(P<0.05),而灶周近侧水肿区各值3个月后则显著高于正常组织(P<0.05),表明釆用CT、MRI多模态检査可进一步提高诊断阳性率,且可通过定量分析进一步明确病灶位置,为治疗提供可靠依据。但术前影像学诊断仍存在疏漏情况,认为与PCNSL的不典型表现有关,即可能表现出病灶密度或信号不均匀,出现囊变、坏死、出血等,此外还可能与血管中心性淋巴瘤、原发性硬脑膜淋巴瘤等误诊。
综上所述,CT、MRI多模态检査对GBM和PCNSL的诊断价值较高,能够进一步提高肿瘤检出率,且可跟踪观察病灶的密度变化,值得推广应用。
