卵巢上皮性浆液性囊腺癌中APR3、HMGB1的表达及意义
2021-12-08田晓娜肖艳景张春艳
李 钊 田晓娜 肖艳景 张春艳
卵巢癌是女性生殖系统肿瘤死亡率最高的肿瘤疾病,其中卵巢上皮肿瘤是最常见的卵巢恶性肿瘤类型,其中以上皮性浆液性囊腺瘤最为常见。但由于卵巢上皮癌缺乏早期诊断的特异性临床症状和肿瘤标记物,患者确诊时多已为癌症中晚期且缺乏有效的治疗手段,5年生存率显著下降,不足25%[1]。因而,探寻早期诊断卵巢癌的特异性指标并为治疗提供新的靶点具有重要意义。截至目前,卵巢上皮癌的发病机制尚不明晰,多认为可从基因和分子水平通过探索细胞周期的调控机制,分析和寻找卵巢癌发生、发展的主要原因[2]。文献[3]提示凋亡相关蛋白3(apoptosis-related protein 3,APR3)可在多种肿瘤细胞中高表达并可参与肿瘤细胞的凋亡和分化过程。高迁移率族蛋白1(high mobility group protein 1,HMGB1)在结直肠癌、黑色毒瘤及乳腺癌等多种恶性肿瘤中均存在过表达现象,可通过激活细胞内MARK等信号传导通路调控肿瘤细胞增殖和抑制凋亡,但关于卵巢上皮癌的研究资料较少[4]。本文就卵巢上皮性浆液性囊腺癌组织中APR3、HMGB1表达及意义进行研究,现汇报如下。
1 材料与方法
1.1 一般资料
选取2018年1月至2020年1月我院保存的卵巢上皮性浆液性囊腺癌标本60例,良性肿瘤70例(浆液性囊腺瘤),同时选取卵巢浆液性囊腺癌标本中正常卵巢组织35例作为对照,各组一般资料比较差异无统计学意义(P>0.05),见表1。纳入标准:①均经病理学确诊;②术前未行放化疗等抗肿治疗;③临床病理资料完整;④患者及家属知情同意。排除标准:①合并有其他系统肿瘤;②合并有免疫系统疾病、急慢性感染、血液系统疾病等。

表1 各组一般资料比较
1.2 实验方法
标本采用免疫组化染色法检测APR3、HMGB1表达:取适量上皮性卵巢癌组织甲醛固定后常规石蜡包埋,连续切片后烤片2~3 h;二甲苯及梯度乙醇脱蜡至水化;3次PBS缓冲液冲洗后清水冲洗;EDTA修复抗原;过氧化氢10 min孵育阻断过氧化物酶,PBS缓冲液冲洗3次;拭去水分,滴加山羊血清,温育2 h,分别滴加APR3、HMGB1一抗,4 ℃过夜孵育;分别吸除PBS液后滴加辣根过氧化物酶标记的二抗并进行2 h室温孵育,DAB溶液显色;苏木精复染;封片观察;已知卵巢癌阳性切片为阳性对照;PBS代替一抗作阴性对照[5]。
1.3 结果判断
400倍光镜下随机选取5个视野,APR3主要在胞质及细胞核中表达,为淡黄色或棕黄色染色颗粒样或团块样染色;HMGB1主要在胞质中,表现为淡蓝色背景下淡黄色或棕黄色染色颗粒样或团块样染色。染色阳性为细胞核或细胞质含有棕黄色和黄色颗粒,染色强度:无着色为0分,淡黄色为1分,黄色为2分,棕色为3分;阳性细胞比例:≤5%为0分,>5%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。阳性细胞比例和染色强度得分之积≥4分为阳性表达[6]。
1.4 统计学处理
2 结果
2.1 各组APR3和HMGB1表达比较
卵巢上皮性浆液性囊腺癌APR3、HMGB1蛋白阳性表达率明显高于卵巢浆液性囊腺瘤和正常卵巢组织(P<0.05);卵巢浆液性囊腺瘤组织和正常卵巢组织APR3、HMGB1蛋白阳性表达率比较,差异无统计学意义(P>0.05)。见表2。

表2 各组APR3和HMGB1表达阳性率比较(例,%)
2.2 卵巢上皮性浆液性囊腺癌组织APR3、HMGB1表达与临床病理关系
卵巢上皮性浆液性囊腺癌患者FIGO分期Ⅲ~Ⅳ期、病理分级G3和有淋巴结转移患者APR3、HMGB1蛋白阳性表达率明显高于Ⅰ~Ⅱ期、G1+G2和无淋巴结转移患者(P<0.05),见表3。
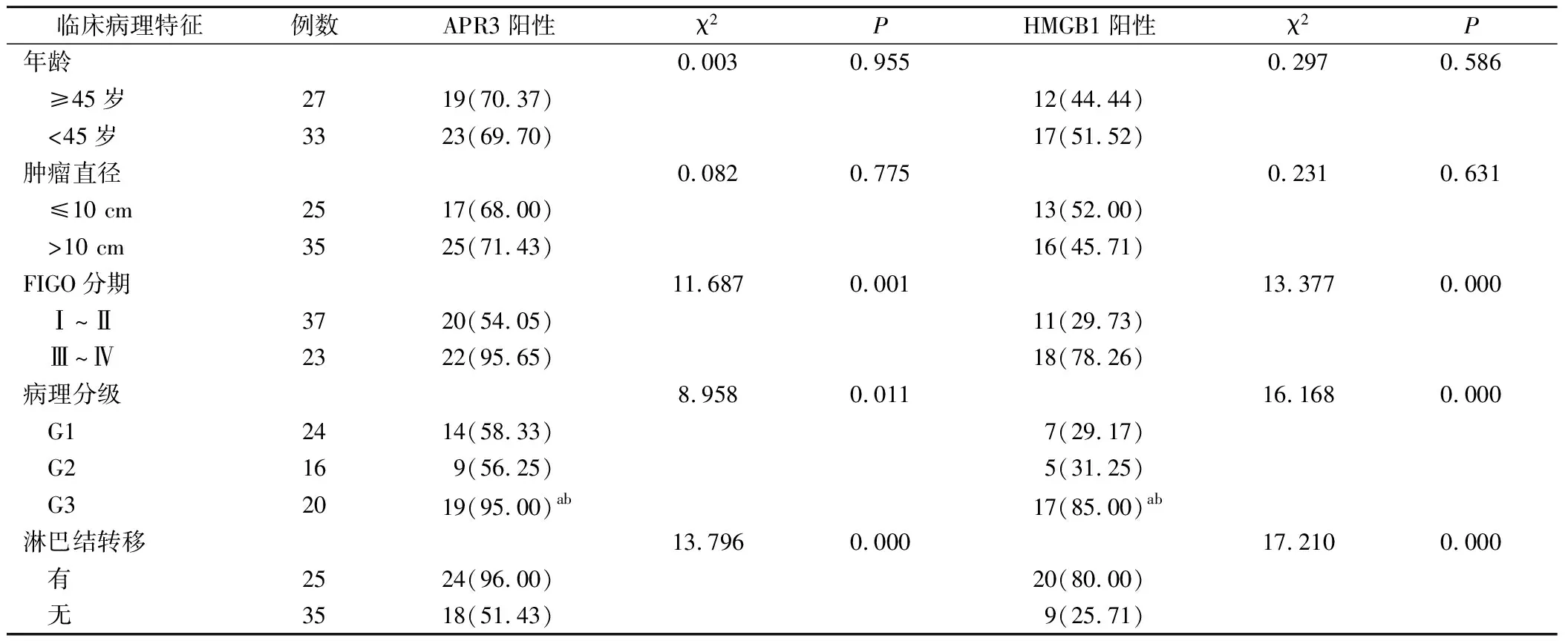
表3 卵巢上皮恶性肿瘤APR3、HMGB1表达与临床病理关系(例,%)
2.3 相关性分析
将卵巢上皮性浆液性囊腺癌组织APR3与HMGB1蛋白表达情况进行相关分析,结果显示:APR3与HMGB1蛋白表达呈正相关(γs=0.771,P<0.05),见表4。

表4 卵巢上皮恶性肿瘤组织APR3与HMGB1蛋白相关性分析/例
3 讨论
卵巢上皮性浆液性囊腺癌是卵巢恶性肿瘤最常见的病理类型,卵巢恶性肿瘤早期多无明显的临床症状,多因腹水等原因就诊,超过4/5的患者确诊时已为中晚期或存在腹腔内种植及淋巴转移,预后极差[7]。综合治疗是卵巢恶性肿瘤的主要治疗方式[8],对于早期的卵巢恶性肿瘤,手术切除能够延长患者生存期,而对于中晚期的卵巢癌,更多的采取放化疗等方式进行治疗。但卵巢恶性肿瘤具有高度恶性生物学行为,综合治疗的预后仍不满意,因此对于卵巢恶性肿瘤发生及进展的分子生物学机制进行深入的研究,能够为改善卵巢癌的干预治疗及预后的改善提供进一步的理论基础。
APR3在细胞中广泛分布并与细胞凋亡有关,有文献[9-10]提示,经全反式维甲酸诱发后细胞APR3可出现一定程度的升高。与蛋白数据库配比后发现凋亡基因Notch4与APR3的EGF样功能区有接近一半的同源性,而Notch4在激活后能够抑制线粒体介导的细胞凋亡,在细胞发育和分化中具有重要作用,因而APR3也可能具有与Notch4同样的生物学作用,但还需要机制研究证实[11]。HMGB1能够介导细胞分化、血管形成及组织修复等多种病理生理活动;HMGB1还属于一类重要的致炎因子,与脓毒血症的发生、发展关系密切并参与恶性肿瘤的发生及进展过程[12]。HMGB1的过表达能够抑制恶性细胞的凋亡过程,引起肿瘤细胞增殖和凋亡失衡,进而促进肿瘤的发展。
研究发现[13],在卵巢上皮性浆液性囊腺癌组织中,APR3、HMGB1蛋白存在过表达现象,表达阳性率要明显高于良性的卵巢肿瘤组织及正常卵巢组织,提示其可能在卵巢癌的发生及发展过程中发挥着重要作用。
进一步对临床特征比较发现卵巢上皮性浆液性囊腺癌不同FIGO分期Ⅲ~Ⅳ期、病理分级G3和有淋巴结转移患者APR3及HMGB1蛋白阳性表达率明显高于Ⅰ~Ⅱ期、G1+G2和无淋巴结转移患者。上述结果说明APR3及HMGB1在卵巢上皮性浆液性囊腺癌的发展和转移中具有重要作用,能够评估卵巢上皮性囊腺癌的恶性程度及病情,其对肿瘤的临床分期也具有一定的参考价值,上述结果也与Yu等[14]在宫颈组织的研究结果具有一致性。
本研究将卵巢上皮性浆液性囊腺癌组织APR3与HMGB1蛋白进行相关分析,结果显示:APR3与HMGB1蛋白表达呈正相关,该结果说明卵巢上皮恶性肿瘤APR3、HMGB1表达上调可能通过某种机制相互促进。研究[15]发现Bcl-2能够促进线粒体释放APR3,而HMBG1的高表达能够支持Bcl-2的表达,进而促进线粒体途径APR3的表达,使异常增生的肿瘤细胞凋亡受阻,进一步促进肿瘤的进展。此外,APR3的抑制细胞凋亡途径与CIAP2抗凋亡蛋白高表达有关,APR3与CIAP2特异性结合后可解除对caspases的凋亡调控作用。笔者推测卵巢上皮肿瘤患者HMGB1的高表达能够调控Bcl-2促进线粒体释放APR3,进一步促进APR3与CIAP2的结合,增加caspases的抑制而抑制肿瘤细胞的凋亡,但其具体的信号分子通路和调控机制还需要进一步研究。
综上所述,卵巢上皮性浆液性囊腺癌组织中APR3、HMGB1表达上调,存在过表达现象,其表达水平与FIGO分期、病理分级和淋巴结转移有一定关系,在卵巢上皮性浆液性囊腺癌中APR3、HMGB1存在相关关系。在卵巢上皮性囊腺癌的发生及发展过程中,APR3、HMGB1参与肿瘤的发生及发展过程,并且可能通过共同的机制进行相互调控,检测APR3、HMGB1的表达情况对卵巢上皮性浆液性囊腺癌的病情评估具有一定的价值。
