ID-1、ILK蛋白表达与宫颈癌病理特征的关系
2021-12-08杨晓艳董国玲刘爱敏
杨晓艳 董国玲 刘爱敏
宫颈癌是由正常宫颈黏膜组织经历宫颈上皮内瘤变(CIN)而逐步演变而来的疾病,该过程受抑癌基因抑制和癌基因激活的共同作用,当抑癌基因和癌基因间失衡时,导致细胞无控性增殖及细胞凋亡受抑制[1-3]。细胞分化抑制因子(ID-1)与多种恶性肿瘤如乳腺癌、胃癌、卵巢癌的细胞分化有关[4]。有研究报道[5-6]ID-1通过激活Ki-67途径诱导细胞增殖,从而对细胞分化起到负性调控作用,阻滞肿瘤细胞凋亡进程,诱使恶性肿瘤进展。但关于ID-1与宫颈癌发生发展的关系目前相关报道较少。本研究利用免疫组织化学方法对比分析宫颈癌组织标本、宫颈上皮瘤变(CIN)组织标本及正常宫颈组织标本中ID-1蛋白、ILK蛋白的表达,分析宫颈癌不同病理表现与ID-1蛋白、ILK蛋白表达的关系,旨在确定上述指标在宫颈癌诊断和预后评估中的临床价值。现报告如下。
1 材料与方法
1.1 临床资料
选取2018年7月至2020年6月的84例宫颈癌组织标本(宫颈癌组)、同期获取的宫颈上皮瘤变(CIN)组织标本40例(CIN组)、正常宫颈组织标本40例(对照组)。
宫颈癌组,年龄41~65岁,平均(54.1±8.2)岁;国际妇产联盟分期(FIGO):Ⅰ期17例、Ⅱ期32例、Ⅲ期26例、Ⅳ期9例;肿瘤分化程度:高∶中∶低为22∶35∶27;淋巴结转移阳性46例;肌层浸润深度≥1/2 35例、<1/2深度 49例;肿瘤病灶:≥3.0 cm 41例、<3.0 cm 43例。CIN组,年龄37~62岁,平均(50.3±8.0)岁;CIN分级:Ⅰ级11例、Ⅱ级19例、Ⅲ级10例。对照组,年龄40~65岁,平均(51.4±8.7)岁。3组的年龄比较,差异不具有统计学意义(P>0.05)。
诊断及入选标准:①所有标本已被病理学检查所证实;②均为首次诊断,既往无放化疗病史;③本研究符合医学伦理学相关规定。排除标准:①其他类型或部位的癌症;②手术后复发的宫颈癌患者;③未经病理学检查证实。
1.2 免疫组化检测
将3组组织样本进行修正处理,随后经石蜡包埋制备为标本,通过4%多聚甲醛溶液进行固定,总时长为3 d,取出后进行4 μm切片。制备载玻片并滴入5%多聚赖氨酸,随后染色,待样本出现棕黄色后停止,移至显微镜下,设置为400倍视野观察样本总细胞及阳性细胞数。
ID-1、ILK蛋白阳性染色主要定位于细胞质中,阳性表达均显色为黄色、棕黄色、褐色。①根据免疫组化染色的深度:无色(0分)、淡黄色(1分)、棕黄色(2分)、褐色、黑色(3分);②根据免疫组化染色的细胞占比情况进行评分:比例≤10%为1分、所占比例范围>10%~50%为2分、所占比范围>50%~75%为3分、所占比范围>75%为4分。两种积分相乘总分<3分为阴性、≥3分为阳性。
1.3 统计学方法
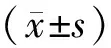
2 结果
2.1 宫颈癌组、CIN组和对照组的ILK蛋白、ID-1蛋白阳性表达率比较
宫颈癌组织中的ILK蛋白、ID-1蛋白阳性表达率分别为64.29%、70.24%均显著高于CIN组(27.50%、35.00%)和对照组(12.50%、20.00%),差异具有统计学意义(P<0.05);CIN组和对照组的ILK蛋白、ID-1蛋白阳性表达率差异无统计学意义(P>0.05)(表1)。

表1 宫颈癌组、CIN组和对照组的ILK蛋白、ID-1蛋白阳性表达率比较(例,%)
2.2 宫颈癌组织中ILK蛋白、ID-1蛋白阳性表达率与病理学特征的关系
宫颈癌组织中的ID-1蛋白阳性表达率在不同FIGO分期、是否发生淋巴结转移、不同肌层浸润深度组织中比较,差异具有统计学意义(P<0.05);宫颈癌组织中的ILK蛋白阳性表达率在不同组织学分化程度、是否发生淋巴结转移、不同肌层浸润深度组织中比较,差异具有统计学意义(P<0.05)。见表2。

表2 宫颈癌组织中ID-1蛋白阳性表达率与病理学特征的关系(例,%)
3 讨论
宫颈癌是一种侵袭力较强,常伴随淋巴结转移,且预后效果差的女性高发肿瘤疾病。据流行病学统计[7]大陆地区女性宫颈癌术后5年生存率不足30%,严重威胁妇女的生命安全。根治切除术是本病目前最有效的干预手段,但目前临床上仅仅依靠妇科肿瘤指标对手术指征的指导和手术预后评估效果检查,临床上尚需要更具特异性的肿瘤标志物。
整合素连接激酶(ILK)是一种在多种生物中广泛存在的丝氨酸/苏氨酸蛋白激酶,ILK内含3个高度保守的结构域[8]。有研究报道[9]ILK与细胞分裂、增殖和上皮性间质细胞间的转移和信息传导有关。有研究报道[10]ILK在恶性肿瘤如乳腺癌、肺小细胞癌、结直肠癌等组织中异常高表达,且表达水平与恶性肿瘤的分化程度、淋巴结转移与否、肌层浸润程度等密切相关。有学者解释ILK参与细胞增殖分化及细胞间信息传递的分子学机制,主要表现如下:ILK通过与整合素β亚单位结合,异常激活下游与细胞核内转录因子活性相关的PI3K/PKB/AKT信号通路,进而介导细胞间信号传递因子,连接蛋白的表达,破坏细胞间的连接状态、促进细胞形态学的改变,有利于细胞向间质部位的侵袭[11]。故相关学者表示[12]ILK水平尤其在上皮性恶性肿瘤组织中高表达。有研究报道[13]ILK通过激活PI3K通路,并增强上皮细胞内波形蛋白的表达,损伤上皮细胞间连接状态,降低抑制上皮细胞向间质细胞转化的E-cadherin蛋白的表达。但ILK作用宫颈癌、宫颈上皮内瘤变的具体机制,临床研究较少。仅有部分学者发现[14]ILK在宫颈癌组织中异常高表达。本研究发现较CIN和正常宫颈黏膜组织,宫颈癌组织中ILK水平显著升高,与既往研究报道一致[15]。本研究还发现宫颈癌组织中的ILK蛋白阳性表达率在不同组织学分化程度、淋巴结转移与否、肌层浸润深度程度比较,差异显著(P<0.05)。既往研究报道仅发现ILK在肺癌组织中不同病理组织学分型中的差异(肺小细胞癌组织中ILK异常表达高于其它亚型肺部组织如腺癌)而IL较少研究发现ILK与宫颈癌亚型的相关性。本研究发现ILK与宫颈癌亚型、淋巴结转移的相关性是本文的创新性。提示,ILK广泛参与宫颈癌的远处转移和侵袭过程,可作为预后评估的有效指标。
有研究报道[16]恶性肿瘤的远处转移和侵袭不仅与上皮细胞间的信息传递改变导致的细胞间联系降低有关,还与抑癌基因和癌基因的表达失调、肿瘤细胞新生微血管的形成有关。ID-1位于人类染色体22q11,由155个氨基酸残基组成,包括2个外显子和1个内显子,在激活癌基因异常表达,抑制抑癌基因表达方面具有重要作用,其作为细胞分化的负性调控因子已有实验证实其在多种恶性肿瘤如乳腺癌、胃癌、结直肠癌组织中的异常高表达,进而抑制细胞凋亡、老化,并提高瘤体血管新生及转移能力。本研究结果显示,宫颈癌组织的ID-1阳性率远高于健康宫颈黏膜和CIN病变组织。说明,ID-1高表达或可能是正常宫颈上皮向宫颈上皮内瘤变,及宫颈癌转变进程的促进因子,该指标或可用于宫颈癌变早期预测工作中,这与既往研究报道一致[17-19]。另外,本研究还发现,ID-1在宫颈癌组织的表达水平与组织学分化程度、淋巴结转移和肌层浸润深度有关。再次确定ID-1高表达在宫颈癌远处转移和浸润的重要作用,可能是通过诱导基质金属蛋白酶-9表达,诱导肿瘤微血管形成,及上调肿瘤血管内皮因子及其受体,从而促进微血管新生,最终为宫颈癌的浸润和转移提供条件。
综上所述,ID-1蛋白、ILK蛋白在宫颈癌组织中呈典型的高表达,可能与促进宫颈癌的发生发展有关。本研究创新处,明确ID-1、ILK在宫颈癌诊断中的价值,且确定其与宫颈癌远处转移和浸润的相关性,为临床宫颈癌的诊断和预后评估提供科学依据,有利于治疗方案的选择,具有重要的临床意义。
