游泳训练对小鼠心肌PKCδ/P66shc蛋白表达的影响*
2021-12-08谢文杰李鹏飞安静芳
谢文杰, 周 刚, 李鹏飞, 杨 帆, 安静芳, 李 航
(湖南大学体育学院, 长沙 410082)
常规体育锻炼可以提高抗氧化能力进而促进心脏中抗氧化系统增强,减少氧化应激对心脏组织的损害[1,2],尤其在耐力运动训练中对心肌抗氧化酶水平的增加作用更为明显[3]。然而,过度运动也可导致心脏中活性氧(reactive oxygen species, ROS)的过量产生[4],这种氧化应激反应甚至导致心肌氧化损伤。运动产生的ROS在心肌组织中是促进氧化应激甚至是氧化损伤的产生,还是促进心肌组织中抗氧化酶活性的增加,与运动的方式、负荷强度及运动时间密切相关。
早在20世纪70年代末到80年代初,有关运动诱导ROS生成及其潜在作用首度引起关注[5]。从那以后,大量的研究试图揭示运动条件下细胞中ROS的来源。最初的一些研究普遍认为线粒体是ROS产生的主要部位,但随着研究的深入,发现线粒体外的一些酶也在运动导致的细胞内外ROS的增加中发挥重要作用[6]。如NADPH氧化酶(nicotinamide adenine dinucleotide phosphate oxidase,NOX)、黄嘌呤氧化酶(xanthine oxidase,XO)和一氧化氮合酶(NO synthase)等。最近的研究发现,心肌中一种衔接蛋白,P66Shc,在运动导致的心肌活性氧生成中起着关键作用。一项急性的大鼠游泳运动实验显示,3小时运动后即刻,大鼠心肌细胞中P66Shc磷酸化,进而促进ROS生成[7]。然而,对于长期的运动训练是否增加P66shc蛋白表达,以及运动激活p66shc的上游机制尚不清楚。
有研究表明,在H2O2刺激的COS-7细胞中可通过识别蛋白激酶Cδ(protein kinase Cδ,PKCδ)的Tyr332磷酸化位点并激活PKCδ,并且被激活的PKCδ与P66shc可形成复合物[8]。因此,PKCδ的激活,可能是调控心肌P66Shc蛋白的重要信号途径。据此,本研究通过对不同强度训练小鼠施加PKCδ抑制剂Rottlerin,揭示长期耐力训练是否通过激活PKCδ来增强P66Shc蛋白表达,进而促进ROS的生成。期待通过本研究的完成,深入了解运动训练介导的心肌氧化应激机制,为运动导致的心肌适应提供理论支持。
1 材料与方法
1.1 研究对象
初始体重在30~35 g的雄性昆明小鼠50只,购于:湖南斯莱克景达实验动物有限公司,动物许可证号SCXK(湘)2016-0002。小鼠自由进水、饮食,在20~25℃室温及40%~60%的环境湿度下饲养,光线:昼夜自然变化。
1.2 动物分组与运动方案
训练模型:小鼠饲养3 d后进行适应性游泳2 d,每日1次,每次10 min。2 d适应性游泳结束后,将小鼠随机分为:对照组(C组)、负重游泳组(E组)、负重游泳+药物组(ER组)、非负重游泳组(P组)、非负重游泳+药物组(PR组),10只/组。(1)C组笼内自由活动,无运动负荷施加。(2)E组、ER组进行4周游泳训练,第1周E组、ER组均为无负重游泳,前6日训练时间依次为:15 min、20 min、30 min、40 min、50 min、60 min、休息。第2周E组、ER组开始进行负重游泳,负重量是其体重的1%,运动时间、频率分别为:60 min/d,6次/周。第3周负重量增加到其体重的2%,运动时间、频率与第2周相同,运动中如发现小鼠有力竭表现(在水下10 s不能上游)捞出水面休息2 min,继续训练直至1 h。第4周负重量增加到其体重的3%,反复游泳至力竭,直至训练时间达到1 h,运动时间、频率与第2周相同。(3)P组、PR组进行无负重的游泳,第1周P组、PR组,在前6日训练时间依次为:15 min、20 min、30 min、40 min、50 min、60 min、休息。第2、3、4周运动时间、频率分别为:60 min/d,6次/周。E组、ER组、P组、PR组进行游泳训练的小鼠,游泳时间均在上午9:00—10:00。(4)ER组、PR组小鼠在最后2次运动前进行腹腔注射PKCδ抑制剂Rottlerin(0.3 mg/kg,购于上海圣克鲁斯生物技术公司)。C组、E组、P组进行腹腔注射同等剂量生理盐水。
1.3 样本的采集与处理
在末次运动结束24 h后,腹腔麻醉进行解剖取样。用30 mg/kg的水合氯醛腹腔麻醉后,迅速进行左心室取血,10 ml离心管封闭,静置3 h后离心取上清。取血结束后迅速取出心脏用0.9%的NaCl溶液清洗表面、剔除结缔组织,滤纸滤干后样品管封闭,放入液氮,然后转入-80℃冰箱保存,以备匀浆。后期将心脏纵向剪为三份,一份用生理盐水匀浆,用于ROS、MDA、SOD测定;一份用5 mmol/L PBS匀浆,用于Western blot分析;再一份用1%NP-40裂解液匀浆,用于Co-IP测定PKCδ和P66shc的结合。
1.4 测试指标与方法
ROS测定:采用荧光探针法(DCFH-DA)检测,试剂购于美国Sigma-aldrich公司。采用96孔板,检测孔每孔吸取20 μl心肌组织匀浆液(约含100 μg蛋白),每个样品添加4份,其中两孔添加生理盐水20 μl,另外两孔添加20 μl混合液(SOD 500 U/ml+catalase 1 000 U/ml)。最后加入DCF工作液60 μl(含10 mol/L DCF、100 μmol/L NADPH),混匀后避光孵育30 min(37℃)。多功能酶标仪测定OD值,激发波长485 nm,发射波长528 nm。超氧化物的生成量=(无抑制剂添加组-有抑制剂添加组)/蛋白浓度。
心肌SOD活性:采用黄嘌呤氧化酶法测定。试剂盒购于:南京建成生物工程研究所。
心肌MDA检测:倍比稀释TEP原液,取5种不同浓度TEP各100 μl放入标准管。配置混合液 0.375%TBA:5.6%TCA=2∶1,分别向样品管、空白管、标准管加入3 ml。2%BHT分别取40 μl加入样品管、空白管、标准管。空白管加入100 μl乙醇。每样品管中加入100 μl样品后立即混匀,水浴60 min(水温95℃),加入4 ml正丁醇混匀,离心15 min,取上清液测OD值,波长532 nm,光径1 cm。
血清MDA检测:方法同心肌组织MDA的检测,每管加样量100 μl血清。
BCA蛋白浓度测定法,定量心肌组织蛋白:试剂盒购于碧云天生物技术研究所,根据试剂盒说明操作。
小鼠心肌组织中PKCδ、P-PKCδ、P66shc、P-P66shc、Nox2、GADPH的测定采用蛋白免疫印迹法(western blot)检测,免疫共沉淀(Co-IP)实验测试PKCδ与P66shc是否形成复合物。CO-IP实验方法:(1)取小鼠心肌100 mg左右加入1%NP-40裂解液,10%浓度匀浆;(2)离心机12 000 r/min,4℃离心,25 min;(3)各样品取上清500 μl分别加入5 μl一抗,4℃旋转过夜;(4)每个样品分别加入20 μl protein A/G-beads,4℃旋转过夜;(5)裂解液清洗4次,每次需12 000 r/min、4℃离心,弃上清,沉淀用于blot分析;Western blot实验方法:(1)配置10%SDS-PAGE分离胶、封闭胶;(2)分别加入Marker和样品,120 V电泳1.5 h;(3)300 mA转膜1 h;(4)牛奶封闭30 min;(5)加一抗4℃下旋转过夜;(6)1%TBS-T洗膜;(7)加二抗,室温下孵育1 h;(8)1%TBS-T洗膜;(9)配置ECL荧光液到转移膜静置1 min;(10)洗片;(11)ImageJ软件分析灰度值,用 GAPDH 作为内参,蛋白表达水平=目标蛋白条带灰度值/GADPH条带灰度值。
PKCδ、P-PKCδ、P66shc、P-P66shc一抗购于圣克鲁斯生物技术公司, P-PKCδ测定Tyr311位点,P-P66shc测定36位点。Nox2一抗购于武汉博士德生物工程有限公司,二抗均购于武汉博士德生物工程有限公司。GADPH购于杭州贤至生物科技有限公司。
1.5 统计学处理

2 结果
2.1 不同强度游泳训练对小鼠心肌组织中ROS、血清与心肌MDA含量及SOD活性的影响
与C组相比,E组小鼠心肌组织中ROS水平显著增加(P<0.01);PR组小鼠ROS显著下降(P< 0.01)。与E组小鼠相比,ER组ROS水平显著下降(P<0.01),且P组ROS水平明显低于E组(P< 0.05)。PR组显著低于E组(P<0.01);与P组相比,PR组小鼠心肌ROS显著下降(P<0.01,表1)。
心肌组织中MDA浓度与C组相比,E组显著增加(P<0.01)。P组、PR组心肌MDA含量明显低于E组(P<0.01)。血清中MDA浓度变化与C组相比,E组显著增加(P<0.05,表1)。
与C组相比,E组小鼠心肌SOD活性显著降低(P<0.01),ER组显著性降低(P<0.05);P组、PR组与C组相比,SOD活性显著增加(P<0.05);与E组相比,P组、PR组SOD活性显著增加(P<0.01,表1)。
2.2 不同强度游泳训练对小鼠心肌组织中PKCδ、P66shc、P-PKCδTyr311、P-P66shcser36、NOX2蛋白表达的影响
在长期不同运动强度训练下,小鼠心肌组织PKCδ蛋白表达及其磷酸化变化如图1、表2所示。首先,PKCδ蛋白表达,与C组比较,E组、P组显著增加(P<0.01);与E组相比,ER组蛋白表达显著性降低(P<0.01),PR组显著低于E组(P<0.01);与P组相比,PR组显著降低(P<0.01)。其次,P-PKCδ的变化,与C组比较,E组、P组显著增加(P<0.01);与E组相比,ER组显著降低(P<0.01);PR组显著低于E组(P<0.01);与P组相比,PR组显著降低(P<0.01)。
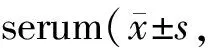
Tab. 1 Changes of ROS, SOD, MDA in mouse myocardium and MDA in mouse n=10)
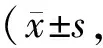
Tab. 2 Expressions of PKCδ, P66shc, P-PKCδTyr311, P-P66shcser36, NOX2 protein in mouse myocardial tissues n=10)
在长期不同运动强度训练下,小鼠心肌组织P66shc蛋白表达及其磷酸化如图2、表2所示。首先,不同强度下游泳训练小鼠心肌P66shc蛋白表达,与C组比较,E组较显著增加(P<0.01);与E组相比,ER组蛋白水平显著降低(P<0.05),P组显著低于E组(P<0.05),PR组显著降低(P<0.01)。其次,P-P66sh变化,与C组比较,E组、P组显著增加(P<0.01);与E组相比,ER组显著降低(P<0.01);与P组相比,PR组显著降低(P<0.01)。
在不同强度游泳训练下,小鼠心肌组织中NOX2蛋白表达如图3、表2所示。不同强度下游泳训练小鼠心肌NOX2蛋白表达,与C组相比较,E组显著增加(P<0.01),P组也显著增加(P<0.05)。与E组相比,ER组显著降低(P<0.05);与P组相比,PR组显著降低(P<0.05)。
2.3 小鼠心肌组织中,PKCδ-P66shc的免疫共沉淀(Co-IP)分析
通过Co-IP实验发现:如图4、表3所示,当P66shc沉淀时,PKCδ、P66shc的蛋白表达均可测到。在不同强度游泳训练下,小鼠心肌组织中PKCδ蛋白表达,与C组比较,E组显著性增加(P<0.01),ER组显著性降低(P<0.01);与E组相比,ER组、P组、PR组显著低于E组(P<0.01)。与P组相比,PR组显著降低(P<0.01)。P66shc蛋白表达,与C组比较,E组显著增加(P<0.01);同时,P组也显著增加(P<0.05);与E组相比,ER组、P组、PR组显著低于E组(P<0.01)。与P组相比,PR组显著降低(P<0.01)。

Fig. 1 Expressions of PKCδ and P-PKCδTyr311 in myocardial tissue

Fig. 2 Expressions of P66shc and P-P66shcser36 in myocardial tissue

Fig. 3 Expressions of NOX2 in myocardial tissue
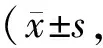
Tab. 3 Analysis of PKCδ-P66shc co-immunoprecipitation in myocardial tissue n=10)
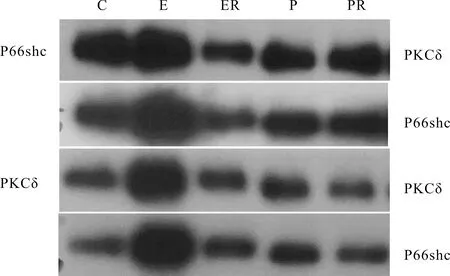
Fig. 4 The expressions of PKCδ and P66shc were detected by co-immunoprecipitation
当沉淀PKCδ时,如图4、表3所示,PKCδ、P66shc蛋白表达均可测到。小鼠心肌组织中PKCδ蛋白表达,与C组比较,E组、P组显著增加(P< 0.01),PR组显著降低(P<0.05)。与E组相比,ER组、P组、PR组显著降低(P<0.01);与P组相比,PR组显著降低(P<0.01)。小鼠心肌组织中P66shc蛋白表达,与C组比较,E组、ER组、P组显著增加(P<0.01)。与E组相比,ER组、P组、PR组显著降低(P<0.01)。与P组相比,PR组显著降低(P<0.05)。
3 讨论
P66Shc蛋白(Shc家族成员)是一种生长因子衔接蛋白,它的磷酸化可促进细胞氧化应激的产生。而PKCδ作为蛋白激酶C的一个关键成员,它可参与许多信号传导途径以调节下游蛋白的磷酸化,使其在细胞中发挥作用。本实验通过注射PKCδ抑制剂,从PKCδ/P66shc途径,探讨不同运动强度游泳训练对小鼠心肌ROS生成的影响。研究发现:长期游泳训练可导致小鼠心肌组织ROS生成显著增加,而采用抑制剂Rottlerin阻断PKCδ/P66shc信号通路后,小鼠心肌ROS生成显著降低。并且在此运动模型下,负重游泳训练组心肌组织中SOD活性低于对照组和非负重游泳训练组。
本实验结果表明,不同强度的游泳训练对小鼠心肌组织P66Shc的蛋白表达影响不同。在负重游泳训练下,心肌P66Shc的蛋白表达显著增加,而普通游泳组未见显著增加,但是P66Shc的磷酸化在两种强度训练均见明显增加。可见,长期的游泳训练可促进P66Shc的磷酸化,而P66Shc蛋白表达则与运动强度的大小有关。仅见少量急性运动对P66Shc蛋白影响的报道,一项急性的3 h游泳训练可显著增加大鼠心肌细胞P66Shc的磷酸化[7],另一项小鼠长时间跑台训练结果表明,急性运动会增加骨骼肌线粒体H2O2的产生,这与P66Shc和FOXO3a蛋白的上调有关,提示p66Shc和FOXO3a信号与运动诱导的H2O2产生的关联可能在急性运动过程中调节细胞氧化应激中发挥作用[9]。而长期的运动训练对P66Shc蛋白表达的影响,本研究应该是第一次报道。P66Shc可直接促进ROS的生成[10],P66Shc基因敲除的小鼠的研究显示,敲除P66Shc基因的小鼠细胞内氧化应激的标记物减少[11],小鼠寿命延长30%,且表现出更好的氧化应激处理能力[12]。本研究发现,两种强度的游泳训练均使心肌ROS增加,但负重游泳训练组的心肌ROS增加量显著高于非负重训练组,提示心肌ROS的增加与P66Shc磷酸化有关,而高强度训练导致的ROS大量生成与P66Shc表达增加有关。
PKCδ作为一种新型PKC家族成员,它不仅是调节许多细胞反应的信号激酶,而且在调节细胞反应的信号转导途径中也起到关键作用。已有研究表明,急性力竭运动导致PKCδ表达和磷酸化水平上调[13]。本实验通过给运动小鼠注射PKCδ的特异性阻断剂Rottlerin,检测PKCδ、P66shc蛋白表达及PKCδ的Tyr311位点与P66shc的ser36磷酸化位点,发现两种强度的游泳训练均可增加心肌细胞PKCδ蛋白的表达和磷酸化,在注射PKCδ抑制剂后,训练小鼠的PKCδ的蛋白表达及磷酸化均受到抑制;并且,前述两种强度训练引起的P66shc的蛋白表达与磷酸化均被抑制。为了验证游泳训练下小鼠心肌组织中PKCδ是否直接对P66shc产生作用,本研究进行了PKCδ/P66shc的共免疫沉淀实验(Co-IP)。结果表明,长期游泳可增加心肌PKCδ和P66shc蛋白结合,且负重游泳训练组PKCδ/P66shc显著性高于非负重游泳组。结果提示,长期的游泳训练使心肌PKCδ与P66shc结合形成复合物,前述运动获得的心肌P66shc蛋白的变化受PKCδ的调控,心肌细胞ROS的生成可通过PKCδ/P66shc途径产生。
PKCδ不仅对P66shc具有调节作用催化ROS的生成,而且也通过调节NOX促进ROS的生成。本研究通过在PKCδ抑制剂的干预下测定运动小鼠心肌组织中主要的NOX亚型NOX2,发现两种强度的训练组NOX2蛋白表达均显著增加,而在注射PKCδ抑制后,NOX2蛋白表达显著下降,说明运动训练条件下,PKCδ对NOX2有调控作用。我们此前的一项研究发现,力竭运动导致NOX2的催化亚基gp91phox与其结构亚基p47phox形成复合物[14],NOX2的激活是通过p47phox的磷酸化使其发挥作用。已有研究表明,通过消除PKCδ-p47phox信号途径可有效降低ROS的生成[15]。尤其重要的是,不仅PKCδ可间接作用于NOX2产生ROS,P66shc也可通过间接作用于NOX2产生ROS。P66shc在促进NADPH氧化酶产生ROS主要是在质膜上,P66Shc促进Rac-1活化并激活NADPH氧化酶以产生ROS[16,17]。
长期训练运动导致的细胞中ROS的生成,可能给细胞带来氧化损伤之弊或增强抗氧化能力之利,这可能与运动强度的大小有关。本研究结果表明,负重游泳训练组小鼠心肌组织中ROS、心肌MDA、血清MDA水平显著增加,SOD活性显著下降,说明高强度训练导致的过量ROS生成致心肌抗氧化能力下降;非负重游泳组小鼠心肌ROS增加程度明显低于负重游泳训练组,且心肌MDA、血清MDA水平与对照组相比无显著差异,但SOD活性显著增强。两种不同强度训练产生的氧化应激效应完全不一致,尤其是SOD的活性完全相反,推测与不同强度训练导致的PKCδ/P66shc途径ROS生成量有关。反复的超负荷训练,超过一定的阈值强度后,激活PKCδ/P66shc、NOX、XO等途径,导致ROS过量生成,使抗氧化酶激活并大量消耗,这可能是高强度训练使SOD相对减少的原因。相反,大量的研究表明,耐力训练可使细胞中的SOD活性提高20-112%[18]。在正常生理条件下,ROS通过改变基因表达介导一些生理应激的适应性过程,这些反应分子的信号传递似乎主要是通过蛋白质中特定残基的靶向修饰来实现的[19],运动训练导致的SOD活性增强可能与此有关。
综上所述,本研究第一次发现长期游泳训练,可导致小鼠心肌通过PKCδ/P66shc信号途径产生ROS。高强度游泳训练可显著增强PKCδ和P66shc蛋白表达及磷酸化水平,导致ROS大量生成,后续的氧化应激效应是抗氧化酶活性下降;低强度游泳训练也增强PKCδ蛋白表达及磷酸化水平,增强P66shc磷酸化,促进小鼠心肌抗氧化酶活性增强,对ROS清除能力的提高,产生运动适应。
