miR-133b靶向抑制SGTB对oxLDL诱导的血管内皮细胞损伤的影响*
2021-12-08陈九霖
陈 刚, 陈九霖, 吴 俊
(黔西南州人民医院心血管内科, 贵州 黔西南州 562400)
动脉粥样硬化是由多因素、多细胞参与的进行性血管性疾病,是心血管疾病的主要病理基础[1]。低密度脂蛋白(low density lipoprotein,LDL)水平的升高及其氧化修饰是动脉粥样硬化发生发展的始动因素。氧化低密度脂蛋白(oxidized low-density lipoprotein,oxLDL)可增加活性氧的产生,诱导血管内皮细胞氧化应激损伤和过度凋亡,破坏血管组织[2]。因此如何有效的抑制血管内皮细胞的氧化应激损伤和凋亡是遏制动脉粥样硬化进展的关键。微小RNA(microRNA,miRNAs)是一类短链内源性非编码RNA,在转录后水平调节基因表达。研究发现miR-133b在1甲基4苯基吡啶离子(1-methyl-4-phenylpyridinium,MPP+)诱导的帕金森病多巴胺能神经元细胞模型中下调表达,过表达miR-133b具有一定的神经保护作用[3]。miR-133b的表达下调还与甲基苯丙胺诱导的神经元毒性损伤有关[4]。此外,抑制大鼠心肌细胞miR-133b表达可诱导心肌细胞损伤和凋亡[5]。但miR-133b对oxLDL诱导的血管内皮细胞损伤的影响尚未可知。生物信息学分析显示富含谷氨酰胺三十四肽重复序列小蛋白质分子(small glutamine-rich tetratricopeptide repeat containing,SGTB)是miR-133b的候选靶基因。研究显示SGTB参与骨关节炎进展,高表达SGTB可促进软骨细胞凋亡[6]。但miR-133b能否靶向SGTB参与对oxLDL诱导的血管内皮细胞损伤的调控尚未见报道。因此,本研究旨在揭示miR-133b和SGTB在oxLDL诱导血管内皮细胞损伤中的作用,以期为防治动脉粥样硬化血管损伤提供理论参考。
1 材料与方法
1.1 实验材料
人脐静脉血管内皮细胞株EVC-304购于美国ATCC;DMEM培养基和胎牛血清购于美国Gibco公司;oxLDL购于美国Sigma公司;LipofectamineTM2000和TRIzol试剂盒购于美国Invitrogen公司;模拟物阴性对照(miR-NC)、miR-133b模拟物(miR-133b mimics)、小干扰RNA阴性对照(si-NC)、SGTB小干扰RNA(si-SGTB)、空载体(pcDNA)、过表达SGTB载体(pcDNA-SGTB)、野生型荧光素酶报告基因载体(WT-SGTB)、突变型荧光素酶报告基因载体(MUT-SGTB)由广州锐博生物公司提供;膜联蛋白V异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)细胞凋亡检测试剂盒购于上海贝博生物生物技术有限公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒、丙二醛(malondialdehyde,MDA)含量检测试剂盒、超氧化物岐化酶(superoxide dismutase,SOD)活性检测试剂盒购于北京索莱宝生物科技有限公司;谷胱甘肽过氧化物酶(glutathion peroxidase,GSH-Px)活性检测试剂盒购于南京建成生物工程研究所;兔源SGTB抗体、兔源B细胞淋巴瘤/白血病-2(B cell lymphoma/leukaemia -2,Bcl-2)抗体、兔源Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体、兔源磷酸甘油醛脱氢酶(phosphoglyceraldehyde dehydrogenase,GAPDH)抗体、以及山羊抗兔Ⅱ抗购于美国Abcam公司。
1.2 细胞培养和实验分组
将EVC-304细胞按照1×106cells/L接种到24孔板,随机分为以下几组。对照(control,Con)组为正常培养的EVC-304细胞;oxLDL组采用oxLDL浓度为100 μg/ml的细胞培养液培养EVC-304细胞24 h。细胞转染:将EVC-304按照2×105cells/well接种6孔板,细胞汇合度达到60%时进行转染。用50 μl的opti-MEM培养液稀释待转染物(转染细胞的终浓度为20 nmol/L),室温作用5 min,记为混合物A。用50 μl的opti-MEM培养液稀释1.0 μl的LipofectamineTM2000,室温作用5 min,记为混合物B。将混合物A和混合物B混合,室温作用20 min,记为混合物C。将含混合物C加入60%汇合的EVC-304细胞,6 h后更换为含血清MEM培养基,收集转染48 h细胞。oxLDL+miR-NC组、oxLDL+miR-133b组、oxLDL+si-NC组、oxLDL+si-SGTB组、oxLDL+miR-133b+pcDNA组、oxLDL+miR-133b +pcDNA-SGTB组为分别用含100 μg/ml oxLDL的细胞培养液处理转染转染miR-NC、转染miR-133b mimics、转染si-NC、转染si-SGTB、转染miR-133b与pcDNA、转染miR-133b与pcDNA-SGTB的EVC-304细胞24 h。仅转染miR-NC、转染miR-133b mimics、转染anti-miR-NC、转染anti-miR-133b的EVC-304细胞记为miR-NC组、miR-133b组、anti-miR-NC组、anti-miR-133b组。每组设置3个复孔,实验重复3次。
1.3 普通倒置显微镜观察细胞形态学特征
EVC-304细胞按照1.2分组进行培养,刺激结束后用倒置显微镜观察细胞形态学特征,并拍照。
1.4 qRT-PCR检测miR-133b和SGTB mRNA的表达
采用TRIzol试剂盒提取各组细胞总RNA,参照反转录试剂盒说明书合成cDNA。引物由上海生工公司合成,序列如下:miR-133b上游序列:5’-AAACCTGGCGGCCACGCTAC-3’,下游序列:5’-GACCGTGGTCCACTGCAGGC-3’;U6上游序列:5’-CTCGCTTCGGCAGCACA-3’,下游序列:5’-AACGCTTCACGAATTTGCGT-3’;SGTB上游引物序列:5’-CCGCTCAAAGCAAACTAA-3’,下游引物序列5’-TGTAACTGCCTCTTCAAAC-3’;GAPDH上游引物序列5’-TGATGACATCAAGAAGGTGGTGAAG-3’,下游引物序列5’-TCCTTGGAGGCCATGTGGGCCAT-3’。依照2-ΔΔCt法计算miR-133b和SGTB mRNA的表达水平。
1.5 流式细胞术检测细胞凋亡
收集按照上述分组进行干预的各组细胞,采用结合缓冲液调整细胞浓度为1×106cells/ml。取100 μl的细胞悬液,依次加入5 μl的Annexin V-FITC和5 μl的PI,混匀后避光孵育15 min,1 h内上流式细胞仪检测细胞凋亡。
1.6 Western blot检测SGTB、Bcl-2和Bax蛋白的表达
收集按照上述分组进行干预的各组细胞,加入4℃预冷的细胞裂解液冰上裂解细胞30 min,用BCA法测定每组细胞蛋白浓度。配制分离胶和浓缩胶,每孔上样30 μg细胞蛋白进行聚丙烯酰胺凝胶电泳。结束后,利用常规湿法转膜装置将细胞蛋白转移至硝酸纤维素膜。将膜置于5%的脱脂牛奶中封闭1 h,TBST洗膜后,将膜置于稀释的Ⅰ抗中4℃孵育过夜,TBST洗膜后,加入稀释的Ⅱ抗室温孵育1 h,TBST洗膜后,采用化学发光试剂进行显色,以GAPDH为内参,用图像分析软件ImageJ分析各目的条带的灰度值。
1.7 试剂盒检测MDA含量、SOD和GSH-Px活性
收集按照上述分组进行干预的各组细胞,离心后弃去上清,按照试剂盒操作步骤,破碎细胞并收集上清液,酶标仪检测各组样本的吸光度值,计算MDA含量、SOD和GSH-Px活性。
1.8 双荧光素酶报告基因实验验证miR-133b和SGTB的靶向关系
采用TargetScan预测miR-133b的靶基因显示,miR-133b与SGTB的3’-UTR区域存在部分连续互补结合位点,推测SGTB可能是miR-133b的靶基因并进行验证。将WT-SGTB和MUT-SGTB分别与miR-133b、miR-NC共转染至EVC-304细胞,转染48 h,双荧光素酶报告基因试剂盒测定各组细胞荧光素酶活性。
1.9 统计学处理

2 结果
2.1 miR-133b和SGTB在oxLDL诱导的血管内皮细胞损伤中的表达
oxLDL诱导后血管内皮细胞中miR-133b的表达显著降低,SGTB mRNA和SGTB蛋白的表达量显著升高(P<0.05,表1,图1)。正常的血管内皮细胞单层生长,呈铺路石样先前排列,边界清楚,分布均匀;经oxLDL刺激后细胞数目减少,圆形细胞增多,细胞收缩,胞膜皱缩,边界不清楚,部分脱落(图2)。

Fig. 1 SGTB protein expression
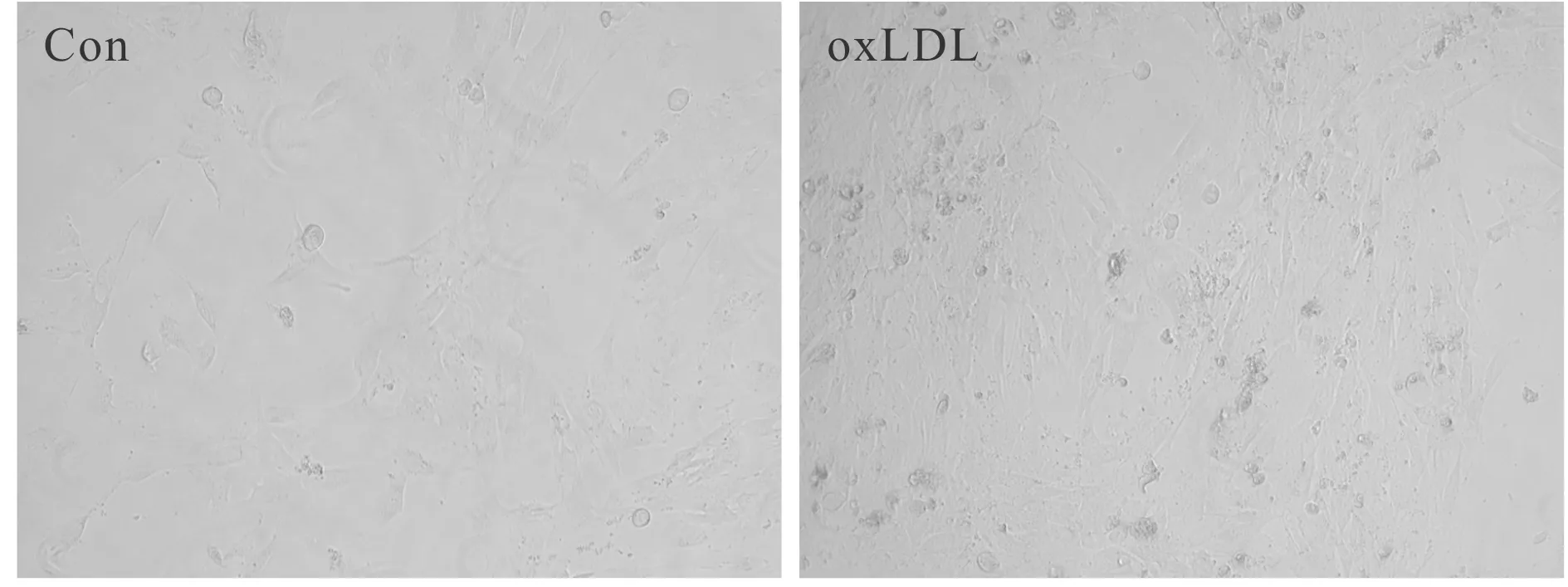
Fig. 2 Effects of oxLDL on the morphology of vascular endothelial cells
Tab. 1 Expressions of miR-133b and SGTB in oxLDL induced vascular endothelial cell n=9)
2.2 miR-133b过表达对oxLDL诱导的血管内皮细胞凋亡的影响
与Con组比较,oxLDL组血管内皮细胞胞体缩小、皱缩,核膜模糊,较多的细胞变圆脱落,miR-133b的表达显著降低,Bcl-2蛋白的表达显著降低,Bax蛋白的表达显著升高,细胞凋亡率显著升高;与oxLDL+miR-NC组比较,oxLDL+miR-133b组血管内皮细胞形态明显改善,皱缩和悬浮细胞明显减少,miR-133b的表达显著升高,Bcl-2蛋白的表达显著升高,Bax蛋白的表达显著降低,细胞凋亡率显著降低(P<0.05,表2,图3,图4)。
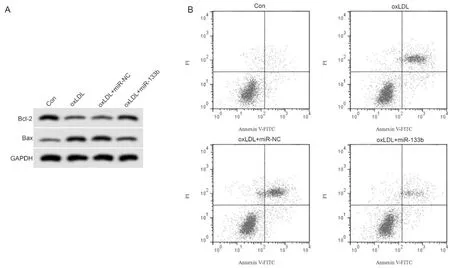
Fig. 3 Effect sof miR-133b overexpression on apoptosis of vascular endothelial cells induced by oxLDL
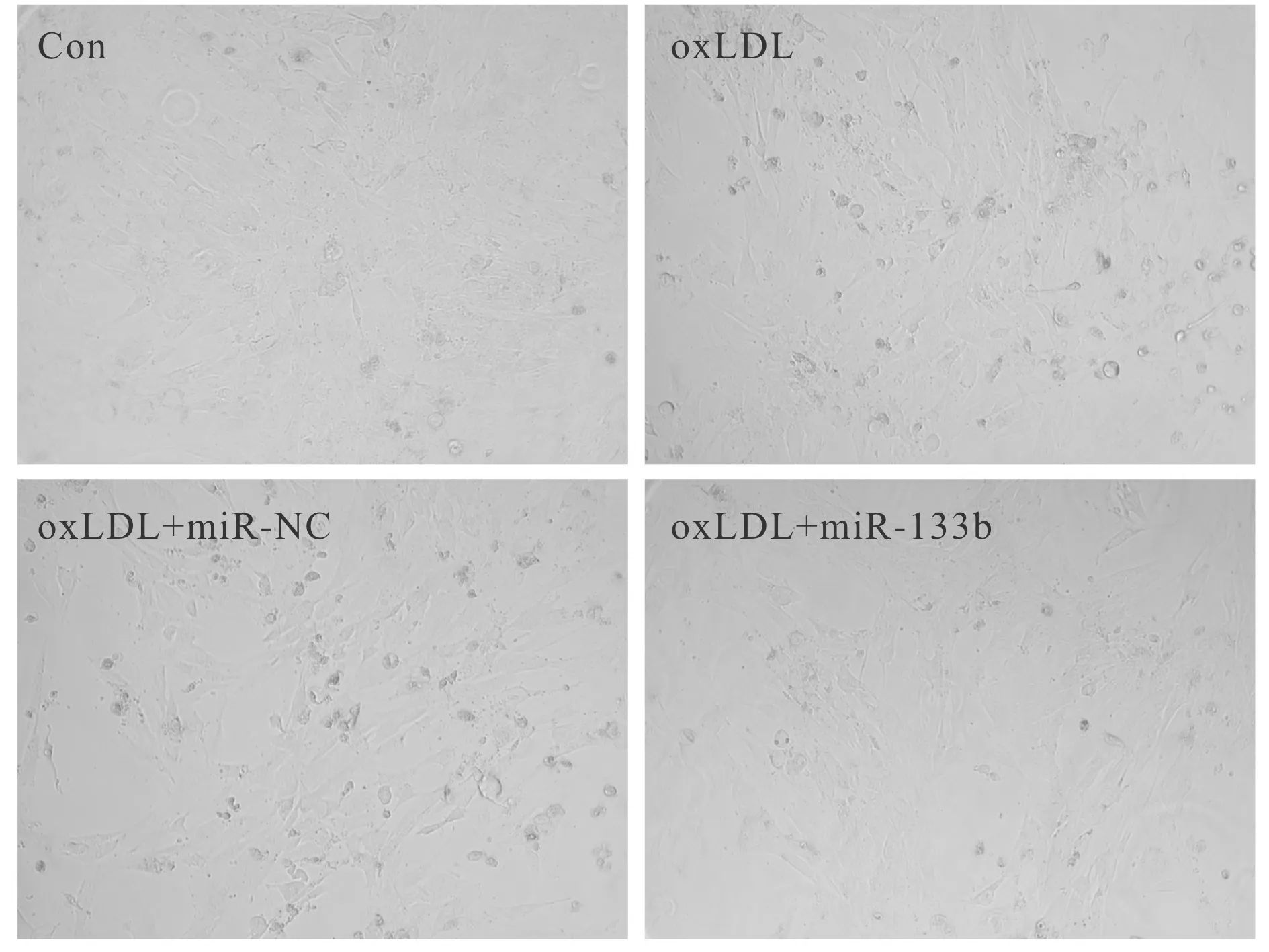
Fig. 4 Effects of miR-133b overexpression on the morphology of vascular endothelial cells induced by oxLDL
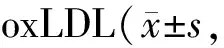
Tab. 2 Effects of miR-133b overexpression on apoptosis of vascular endothelial cells induced by n=9)
2.3 miR-133b过表达对oxLDL诱导的血管内皮细胞氧化应激的影响
与Con组比较,oxLDL组血管内皮细胞MDA的含量显著升高,SOD和GSH-Px的活性显著降低;与oxLDL+miR-NC组比较,oxLDL+miR-133b组血管内皮细胞MDA的含量显著降低,SOD和GSH-Px的活性显著升高(P<0.05,表3)。
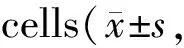
Tab. 3 Effect of miR-133b overexpression on oxidative stress induced by oxLDL in vascular endothelial n=9)
2.4 干扰SGTB表达对oxLDL诱导的血管内皮细胞损伤的影响
与Con组比较,oxLDL组血管内皮细胞胞体缩小、皱缩,核膜模糊,较多的细胞变圆脱落,SGTB和Bax蛋白的表达显著升高,Bcl-2蛋白的表达显著降低,MDA含量显著升高,SOD和GSH-Px活性显著降低,细胞凋亡率显著增加;与oxLDL+si-NC组比较,oxLDL+si-SGTB组血管内皮细胞形态明显改善,皱缩和悬浮细胞明显减少,SGTB和Bax蛋白的表达显著降低,Bcl-2蛋白的表达显著升高,MDA含量显著降低,SOD和GSH-Px活性显著升高,细胞凋亡率显著降低(P<0.05,图5,图6,表4)。
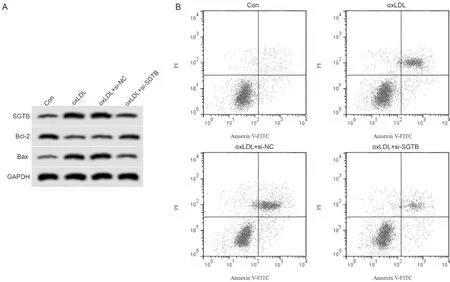
Fig. 5 Effects of interfering SGTB expression on OxLDL-induced vascular endothelial cell injury
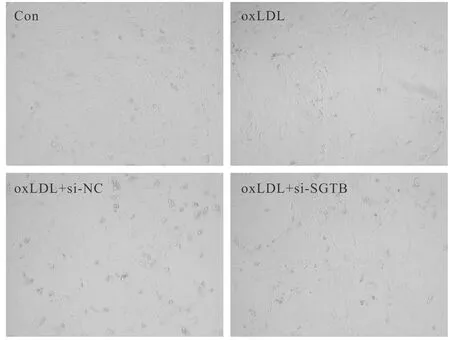
Fig. 6 Effects of interfering SGTB expression on the morphology of vascular endothelial cells
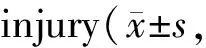
Tab. 4 Effects of interfering SGTB expression on OxLDL-induced vascular endothelial cell n=9)
2.5 miR-133b靶向调控SGTB的表达
通过靶基因预测网站TargetScan预测miR-133b的靶基因,结果显示miR-133b与SGTB的3’-UTR区域存在连续互补的结合位点见图7A。双荧光素酶报告实验显示见表5,与miR-NC和WT-SGTB共转染组比较,miR-133b mimics和WT-SGTB共转染组血管内皮细胞的荧光素酶活性显著降低(P< 0.05);与miR-NC和MUT-SGTB共转染组比较,miR-133b mimics和MUT-SGTB共转染组血管内皮细胞的荧光素酶活性无显著变化。Western blot检测显示,与miR-NC组(0.49±0.04)比较,miR-133b组血管内皮细胞SGTB蛋白的表达水平(0.22± 0.03)显著降低;与anti-miR-NC组(0.47±0.04)比较,anti-miR-133b组血管内皮细胞SGTB的表达水平(0.95±0.08)显著升高(P<0.05,图7B)。以上结果说明在血管内皮细胞中miR-133b靶向负性调控SGTB表达。

Fig. 7 miR-133b targeted and negatively regulated SGTB expression

Tab. 5 Double Luciferase report n=9)
2.6 SGTB过表达逆转了miR-133b过表达对oxLDL诱导的血管内皮细胞损伤的作用
与oxLDL+miR-NC组比较,oxLDL+miR-133b组血管内皮细胞形态明显改善,皱缩和悬浮细胞明显减少,SGTB和Bax蛋白的表达显著降低,Bcl-2蛋白的表达显著升高,MDA含量显著降低,SOD和GSH-Px活性显著升高,细胞凋亡率显著降低;与oxLDL+miR-133b+pcDNA组比较,oxLDL+miR-133b+ pcDNA-SGTB组血管内皮细胞胞体缩小、皱缩,核膜模糊,较多的细胞变圆脱落,SGTB和Bax蛋白的表达显著升高,Bcl-2蛋白的表达显著降低,MDA含量显著升高,SOD和GSH-Px活性显著降低,细胞凋亡率显著增加(P<0.05,图8,图9,表6)。
3 讨论
OxLDL介导的内皮细胞损伤是早期动脉粥样硬化内皮细胞功能障碍的关键。因此,本研究建立以OxLDL诱导的体外内皮细胞损伤模型,探讨与内皮细胞氧化损伤和凋亡有关的基因,为防治动脉粥样硬化血管损伤提供理论基础。

Fig. 8 SGTB overexpression reversed the effects of miR-133b overexpression on oxLDL-induced vascular endothelial cell damage

Fig. 9 SGTB overexpression reversed the effects of miR-133b overexpression on the morphology of vascular endothelial cells
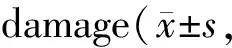
Tab. 6 SGTB overexpression reversed the effects of miR-133b overexpression on oxLDL-induced vascular endothelial cell n=9)
miR-133b在动脉粥样硬化兔血液和血管斑块组织中表达下调,过表达miR-133b通过抑制血管平滑肌细胞的增殖活性和迁移能力,诱导细胞凋亡[7]。miR-133b表达下调可抑制巨噬细胞的增殖和迁移,同时促进巨噬细胞的凋亡,从而减弱动脉粥样硬化中易损斑块的形成和血管重塑[8]。可见在不同细胞模型中,miR-133b发挥的功能相互矛盾,而miR-133b在OxLDL诱导的血管内皮细胞损伤中的作用尚不清楚。本研究显示OxLDL诱导后血管内皮细胞胞体缩小、皱缩,核膜模糊,较多的细胞变圆脱落,miR-133b的表达显著降低,Bcl-2蛋白的表达显著降低,Bax蛋白的表达显著增加,细胞凋亡率显著升高。Bcl-2是一种抗凋亡蛋白,可抑制线粒体依赖的caspase途径诱导的细胞凋亡,而Bax则发挥相反的作用,研究报道miR-133b可减弱MPP+诱导的Bax和Bcl-2表达改变,改善MPP+诱导的神经轴突变性[9,10]。本研究显示过表达miR-133b可改善细胞形态,减少皱缩和悬浮细胞数量,逆转Bcl-2表达降低和Bax表达增加,减轻OxLDL诱导后血管内皮细胞凋亡,这与徐瑞等[3]和程洁等[5]报道的miR-133b保护神经细胞和心肌损伤的作用相吻合。进一步研究显示OxLDL诱导后血管内皮细胞中MDA的含量显著增加,SOD和GSH-Px的活性显著降低。氧自由基作用于不饱和脂肪酸产生脂质过氧化终产物MDA,MDA含量是反应机体过氧化程度和间接反应细胞损伤程度的重要指标,SOD和GSH-Px是清除氧自由基的抗氧化物质,可减轻氧自由基对细胞的损伤[11-13]。本研究显示过表达miR-133b后可降低血管内皮细胞MDA的含量,升高SOD和GSH-Px活性。以上结果提示过表达miR-133b可减轻OxLDL诱导的血管内皮细胞氧化损伤和凋亡。
SGTB是含肽重复结构域(tetratricopeptide repeat,TRP)基序家族成员之一,研究显示SGTB在肝癌组织中表达显著下调,与肿瘤的组织学分级显著相关,SGTB表达降低是肝癌患者不良预后的独立指标[14]。miR-365b通过下调SGTB促进肝癌细胞迁移和侵袭[15]。此外,SGTB高表达参与脂多糖诱导的神经元细胞的凋亡[16]。但目前尚无SGTB在心血管疾病中的相关研究。本研究显示OxLDL诱导后血管内皮细胞中SGTB的表达显著升高,干扰SGTB表达可抑制OxLDL诱导的血管内皮细胞氧化损伤、凋亡和形态学改变,并通过双荧光素酶报告基因实验和Western blot证实miR-133b靶向负性调控SGTB表达。进一步研究显示过表达SGTB可逆转过表达miR-133b对OxLDL诱导的血管内皮细胞凋亡和氧化应激水平的影响。以上结果提示miR-133b通过抑制SGTB表达对OxLDL诱导的血管内皮细胞损伤具有保护作用。
综上所述,在OxLDL诱导的血管内皮细胞miR-133b表达下调,SGTB表达上调。过表达miR-133b通过靶向SGTB抑制OxLDL诱导的血管内皮细胞氧化损伤和凋亡,为防治动脉粥样硬化血管损伤提供了新的方向。
