盐酸罗哌卡因对骨肉瘤细胞增殖、侵袭、凋亡的影响及其机制*
2021-12-08尹天翔罗彩云
于 鹏, 尹天翔, 罗彩云, 曾 萍
(宜昌市中心人民医院麻醉科, 湖北 宜昌 443008)
骨肉瘤是一种常见的恶性骨肿瘤,术后结合化疗是骨肉瘤的重要治疗方式,其显著改善了患者生存率和预后,但化疗的毒副反应和多药耐药的产生是局部复发、远处转移及治疗失败的重要原因[1, 2]。因此研究骨肉瘤化疗的耐药机制,逆转其耐药对临床治疗有重要意义。近年来研究发现,部分麻醉药通过影响肿瘤细胞的凋亡、增殖、转移而发挥抗肿瘤作用[3]。对肿瘤术后化疗患者进行麻醉处理对治疗有一定的辅助作用[4]。盐酸罗哌卡因是一种新型长效酰胺类局麻药,其可抑制胃癌细胞AGS和HG-27的增殖[5]。罗哌卡因能抑制结肠癌细胞增殖和结肠癌皮下瘤的生长[6]。罗哌卡因能够以剂量和时间依赖性的方式抑制肝癌细胞的增殖并促进其凋亡[7]。Livin是凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)家族成员,骨肉瘤组织Livin高表达与肿瘤浸润、转移密切相关,提示预后不良,可作为骨肉瘤的潜在治疗靶点及判断预后的分子指标[8]。RNA干扰下调Livin基因表达可有效促进耐药MG-63骨肉瘤细胞的凋亡,从而增加其对化疗药物的敏感性[9]。然而盐酸罗哌卡因对骨肉瘤及其是否通过调控Livin对骨肉瘤的影响鲜有研究报道。本实验通过建立骨肉瘤多柔比星耐药细胞,研究盐酸罗哌卡因对其增殖、侵袭、凋亡及化疗敏感性的影响及其是否与Livin有关,以期为临床应用提供实验资料。
1 材料与方法
1.1 材料
骨肉瘤细胞U2OS购自上海柯雷生物科技有限公司;盐酸罗哌卡因(国药准字H20173027)购自河北一品制药股份有限公司;多柔比星(国药准字H33021980)购自海正辉瑞制药有限公司;胎牛血清(货号:SH30071.03,美国Hyclone公司);RPMI-1640培养基(货号31800022:,美国Gibco公司);LipofectamineTM2000转染试剂(货号:11668019,美国Invitrogen公司);四甲基偶氮唑盐比色法(MTT)试剂盒(货号:JKSJ-1812,德国IBL公司)、二辛可宁酸(bicinchoninic acid,BCA)试剂盒(货号:40200080-4,美国Bio-world);SYBR Green荧光定量PCR试剂盒(货号:218073,德国Qiagen);膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙锭(PI)试剂盒(货号:120148,北京凯基生物技术股份有限公司)。P21(货号:251259,美国Abbiotec)、Cleaved Caspase-3(货号:abx012079,英国Abbexa)、E-cadherin(货号:200134,美国Abbiotec)、MMP-2(货号:250752,美国Abbiotec)、Livin(货号:251257,美国Abbiotec)、GAPDH(货号:251330,美国Abbiotec);山羊抗兔-HRP(货号:656120,美国Invitrogen公司)。
1.2 骨肉瘤多柔比星耐药细胞株的建立
骨肉瘤细胞U2OS置于含有10 %胎牛血清的RPMI-1640培养液中,然后于37℃含有5% CO2的培养箱中进行培养,多柔比星是蒽环类抗生素的原型化合物,临床常用的肿瘤化疗药物,也是骨肉瘤常用化疗药物,本实验以多柔比星(Doxorubicin,DOX)为诱导剂,采用逐步增加药物剂量诱导耐药细胞,最开始用加入0.1 μg/ml的多柔比星培养基,48 h后筛选存活细胞继续培养,培养3代后取稳定存活细胞继续用加入高浓度的多柔比星培养,添加的多柔比星浓度依次为0.1、1、10、100、200 μg/ml,每种药物48 h选择存活细胞继续培养,均培养3代稳定药性,最后在浓度为200 μg/ml的多柔比星下仍能生长的细胞即为耐药细胞,命名为U2OS/DOX。
1.3 细胞处理与分组
取对数生长期U2OS/DOX细胞,用浓度分别为0、20、50、100 μg/ml的盐酸罗哌卡因处理U2OS/DOX细胞,作为不同浓度盐酸罗哌卡因处理组;分别将0.5 μg的pcDNA3.1质粒载体和pcDNA3.1-Livin质粒载体用50 μl的培养液稀释,然后将其和50 μl用培养液稀释的LipofectamineTM2000转染试剂混合,室温静置20 min,将上述混合液加至500 μl含有U2OS/DOX细胞(5×105cells/ml)的培养板中,转染6 h后再用浓度为100 μg/ml的盐酸罗哌卡因处理24 h,记为盐酸罗哌卡因100 μg/ml+pcDNA3.1组、盐酸罗哌卡因100 μg/ml+pcDNA3.1-Livin组。
1.4 MTT检测细胞增殖抑制率及细胞半数抑制浓度(IC50)
用浓度为0.1、1、10、100、200 μg/ml多柔比星处理U2OS和U2OS/DOX细胞,培养48 h后,分别加入MTT试剂反应,然后检测波长为490 nm的光密度(OD)值。细胞增殖抑制率(%)=(1-实验组OD值/空白对照组OD值)×100%。实验重复3次。绘制抑制率曲线,计算药物对细胞的半数抑制浓度(IC50)。计算耐药指数(RI)=IC50(U2OS/DOX)/IC50(U2OS)[10]。
不同浓度盐酸罗哌卡因处理组、盐酸罗哌卡因100 μg/ml+pcDNA3.1组、盐酸罗哌卡因100 μg/ml+pcDNA3.1-Livin组细胞培养48 h后也按上述方法检测细胞增殖抑制率。
1.5 蛋白质印迹(Western blot)法检测P21、Caspase-3、E-cadherin、MMP-2、Livin、t-Livin蛋白表达
收集各组细胞,加入RIPA蛋白裂解液提取细胞蛋白,用BCA方法进行定量,然后取40 μg蛋白样品进行SDS-PAGE凝胶(10%)电泳,转膜后加入一抗、二抗孵育,然后显影成像,用Quantity One凝胶软件检测各条带灰度值,蛋白表达水平=目的条带灰度值/GAPDH条带灰度值。每个蛋白样品设3个重复。
1.6 克隆形成实验检测细胞克隆形成数
各组细胞制成1×104cells/ml的悬液,以每孔100个细胞接种于六孔板中,每组设3个复孔,培养14 d,出现肉眼可见克隆时终止培养,甲醇固定后吉姆萨染色,在显微镜下计数>50个细胞的集落。
1.7 流式细胞术检测细胞凋亡
收集细胞,用预冷的PBS漂洗2次,与500 μl的结合缓冲液混匀。先加入10 μl的Annexin V-FITC,再加入5 μl的PI,混匀后避光孵育10 min。用流式细胞仪检测细胞凋亡率。每组设3个复孔,实验重复3次。
1.8 Transwell检测细胞迁移和侵袭
取200 μl细胞悬液接种在Transwell小室上室中,下室加入培养液,培养24 h,多聚甲醛固定,结晶紫染色后在显微镜下观察,并随机选择5个视野计数,取其平均数即是细胞迁移数;用基质胶将Transwell小室包被后再按照细胞迁移实验步骤操作即是细胞侵袭数。
1.9 实时荧光定量PCR(RT-qPCR)检测Livin mRNA表达水平
不同浓度盐酸罗哌卡因处理组细胞培养48 h后提取总RNA,取2 μl RNA反转录成cDNA,Livin以β-actin为内参进行定量PCR扩增,循环条件为95℃变性15 s,60℃退火30 s;72℃延伸30 s,共40个循环。相对表达量采用2-△△Ct法计算。Livin mRNA相对表达量=2-△△Ct,△△Ct=(CtLivin-Ct内参)-(Ct对照-Ct内参)。Livin上游引物序列:5'-GTCAGTTCCTGCTCCGGTCAA-3',下游引物序列:5'-GGCTGCGTCTTCCGGTTCTT-3';β-actin上游引物序列:5'-CTTAGTTGCGTTACACCCTTTCTTG-3',下游引物序列:5'-CTGTCACCTTCACCGTTCCAGTTT-3'。
1.10 统计学处理

2 结果
2.1 骨肉瘤细胞U2OS及骨肉瘤耐药细胞U2OS/DOX对化疗药物多柔比星IC50和耐药指数
多柔比星浓度大于1 μg/ml时,骨肉瘤细胞U2OS增殖抑制率显著升高,且具有剂量依赖性(P<0.05);多柔比星浓度大于10 μg/ml时,骨肉瘤细胞骨肉瘤耐药细胞U2OS/DOX增殖抑制率显著升高,且具有剂量依赖性(P<0.05,图1)。U2OS和U2OS/DOX细胞的半数抑制浓度分别是1.49± 0.03,119.96±0.11;耐药指数为80.51±5.65;U2OS/DOX细胞较U2OS细胞耐药,说明U2OS/DOX为骨肉瘤耐药细胞。
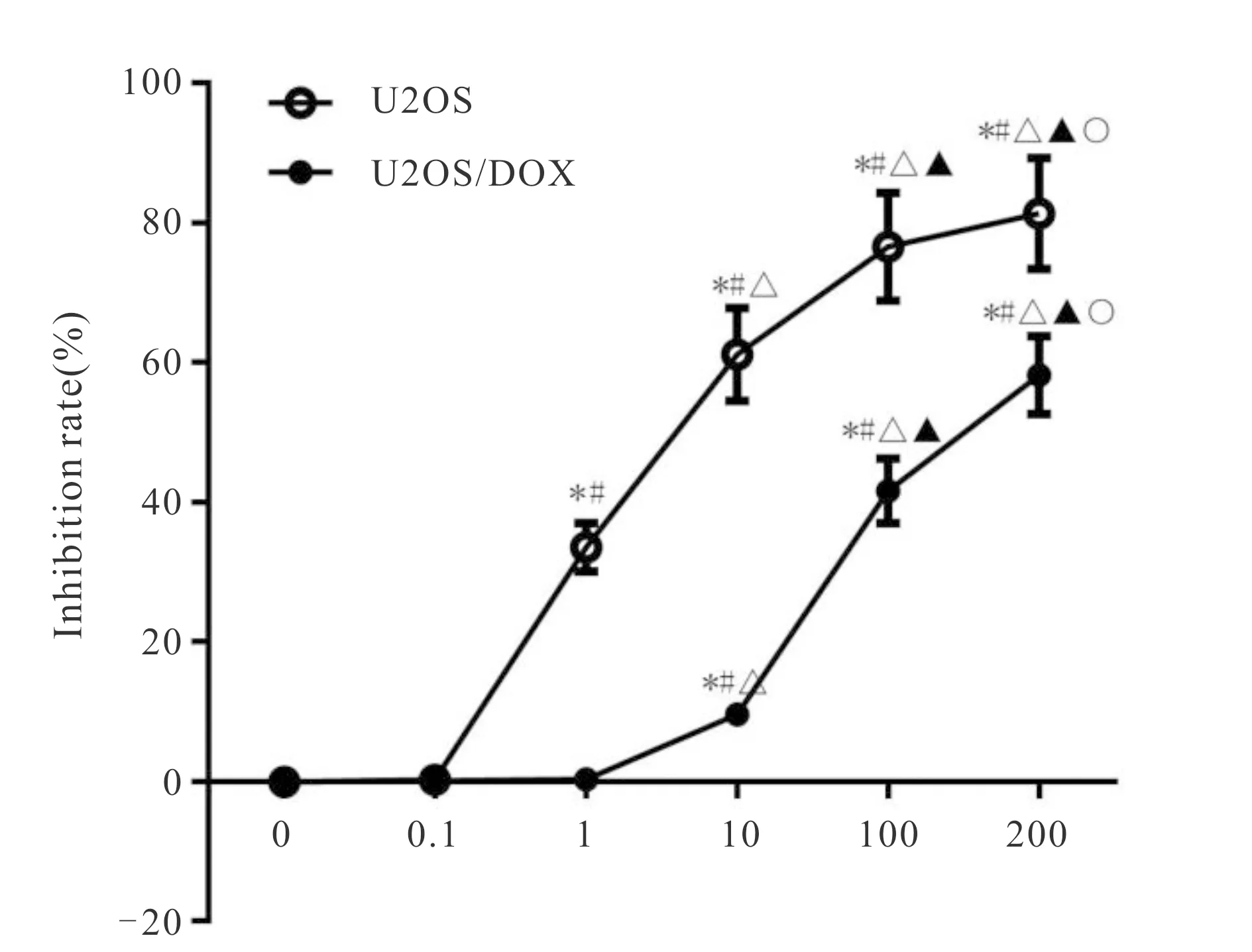
Fig. 1 Effects of doxorubicin on the inhibition rate of U2OS and U2OS / DOX cells
2.2 盐酸罗哌卡因对细胞U2OS/DOX增殖、凋亡的影响
不同浓度盐酸罗哌卡因处理的U2OS/DOX细胞中,P21、Cleaved Caspase-3表达水平显著升高,细胞增殖抑制率显著升高,克隆形成数显著降低,细胞凋亡率显著升高,且呈浓度依赖性(P<0.05,图2,表1)。

Fig. 2 Effects ofropivacaine hydrochloride on U2OS/DOX clone formation, apoptosis and expression of P21 and Cleaved Caspase-3 proteins
2.3 盐酸罗哌卡因对细胞U2OS/DOX迁移、侵袭的影响
不同浓度盐酸罗哌卡因处理的U2OS/DOX细胞中,E-cadherin表达水平显著升高,MMP-2表达水平显著降低,细胞迁移、侵袭数显著降低,且呈浓度依赖性(P<0.05,图3,表2)。
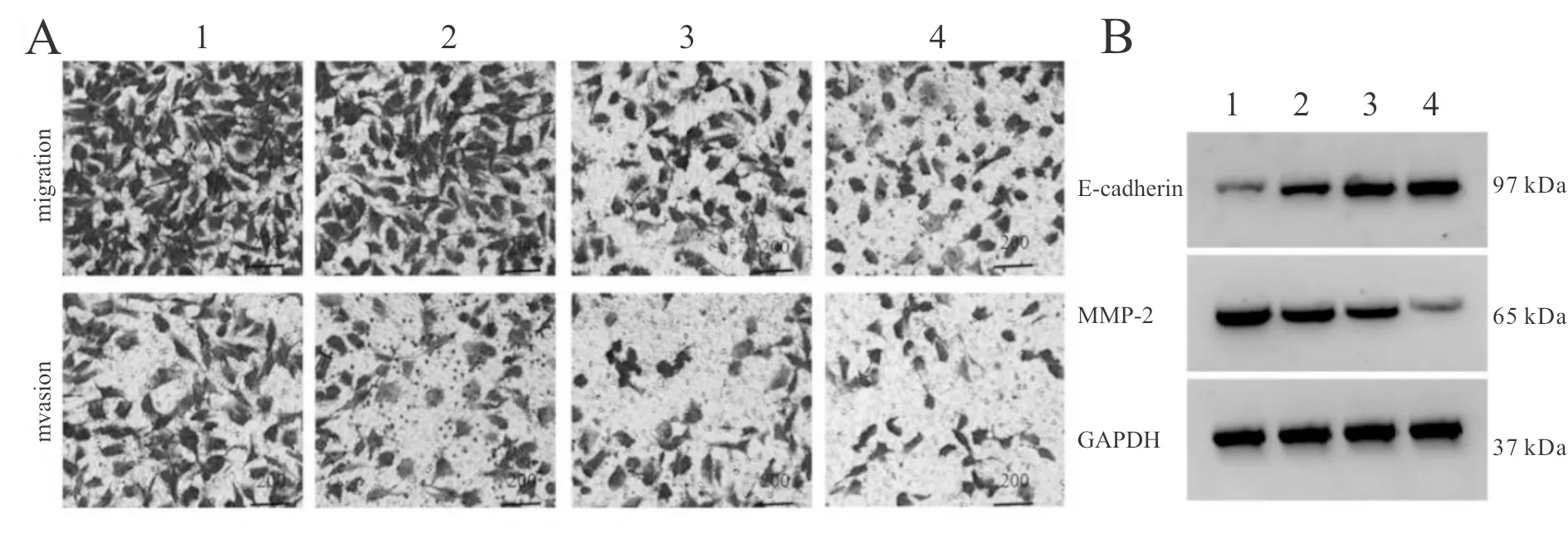
Fig. 3 Effects ofropivacaine hydrochloride on the expression of E-cadherin and MMP-2 proteins and number of migration and invasion cells in U2OS / DOX cells treated with doxorubicin
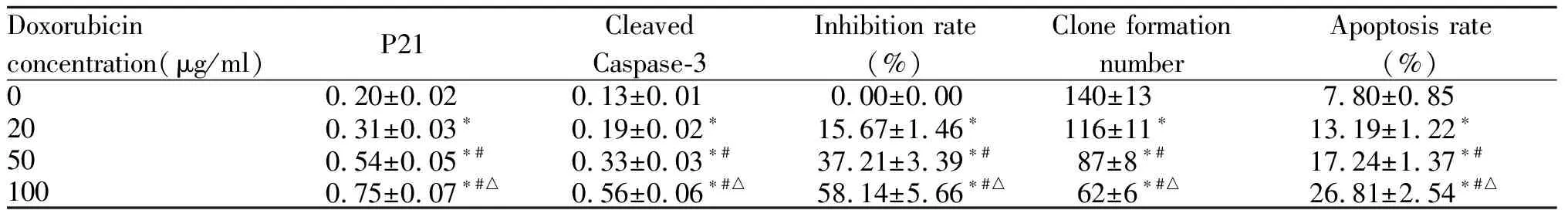
Tab. 1 Effects ofropivacaine hydrochloride on U2OS / DOX proliferation and apoptosis

Tab. 2 Effects ofropivacaine hydrochloride on the migration and invasion of U2OS / DOX in cells treated with doxorubicin
2.4 盐酸罗哌卡因对细胞U2OS/DOX中Livin表达的影响
不同浓度盐酸罗哌卡因处理的U2OS/DOX细胞中Livin蛋白表达水平显著降低,t-Livin表达水平显著升高,且呈浓度依赖性(P<0.05,图4,表3)。
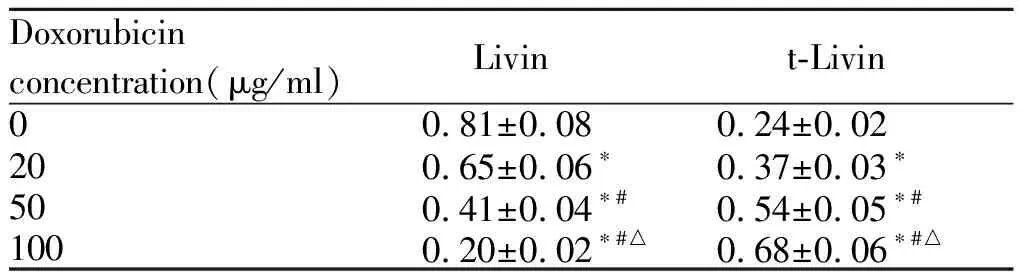
Tab. 3 Effect ofropivacaine hydrochloride on the mRNA expression of Livin in U2OS / DOX cells treated by doxorubicin

Fig. 4 Livin protein expression
2.5 过表达Livin能逆转盐酸罗哌卡因对细胞U2OS/DOX增殖的抑制作用及凋亡的促进作用
与盐酸罗哌卡因100 μg/ml+pcDNA3.1组相比,盐酸罗哌卡因100 μg/ml+pcDNA3.1-Livin组U2OS/DOX细胞中P21、Cleaved Caspase-3表达水平显著降低,细胞抑制率显著降低,细胞克隆形成数显著升高,细胞凋亡率显著降低(P<0.05,图5,表4)。
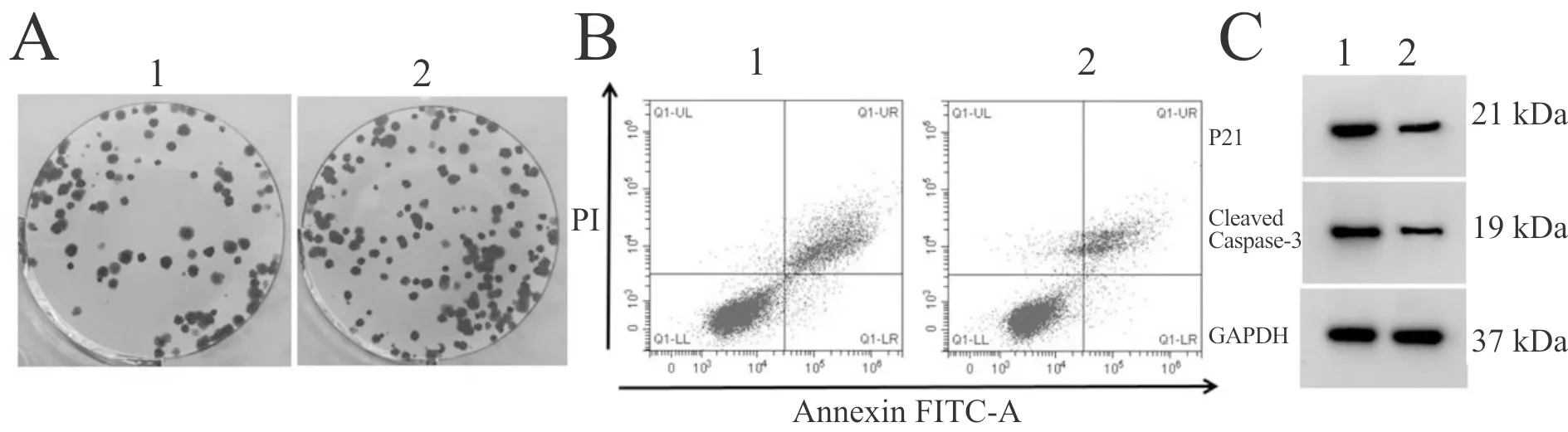
Fig. 5 Overexpression ofLivin can reverse the effects of ropivacaine hydrochloride on U2OS / DOX clone formation, apoptosis and the effects of P21 and Cleaved Caspase-3 protein expression
2.6 过表达Livin能逆转盐酸罗哌卡因对细胞U2OS/DOX迁移、侵袭的抑制作用
与盐酸罗哌卡因100 μg/ml+pcDNA3.1组相比,盐酸罗哌卡因100 μg/ml+pcDNA3.1-Livin组U2OS/DOX细胞中Livin表达水平显著升高,t-Livin表达水平显著降低,E-cadherin表达水平显著降低,MMP-2表达水平显著升高,细胞迁移、侵袭数显著升高(P<0.05,图6,表5)。
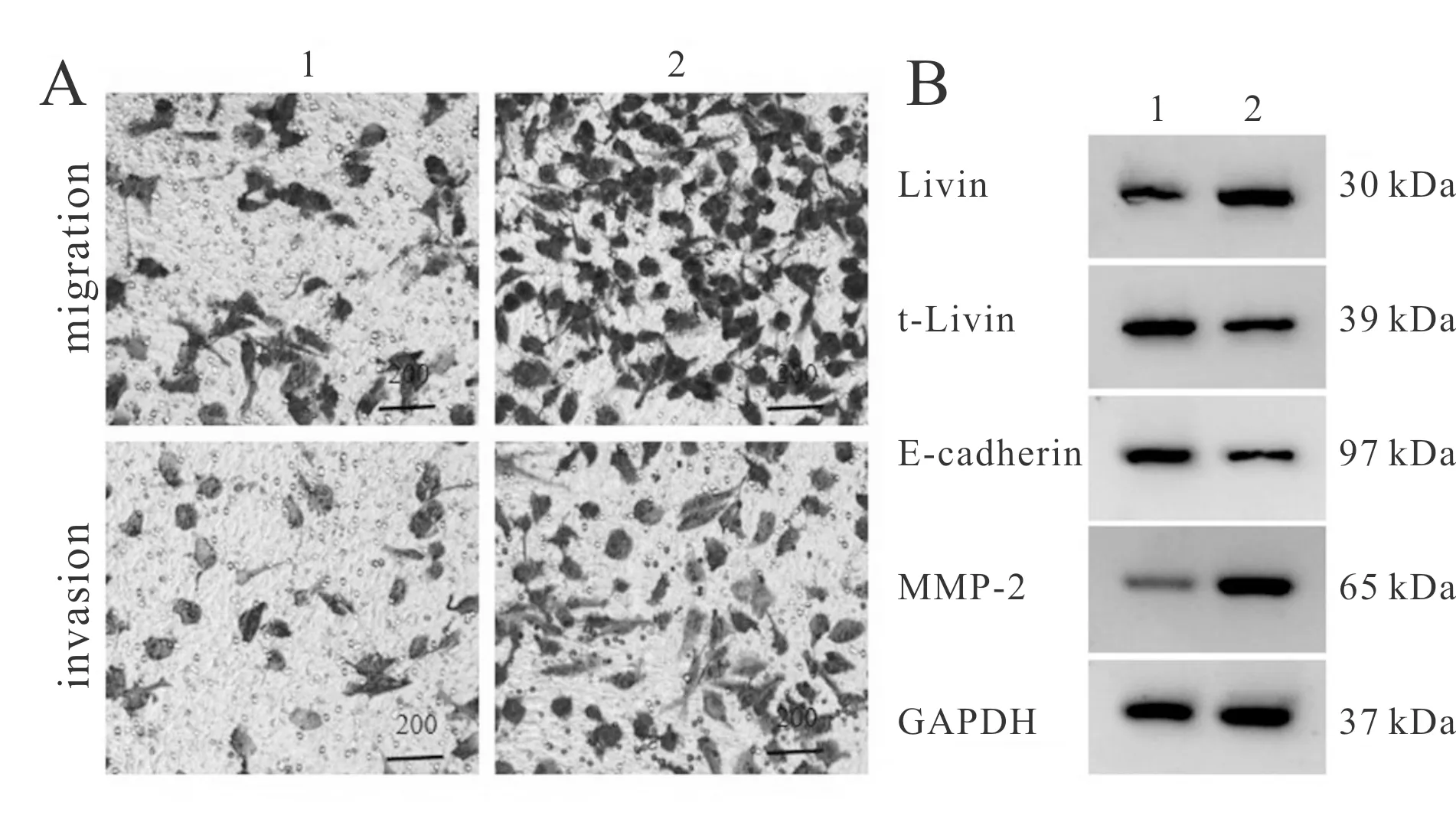
Fig. 6 Expressions of related proteins and detection of migration and invasion cells
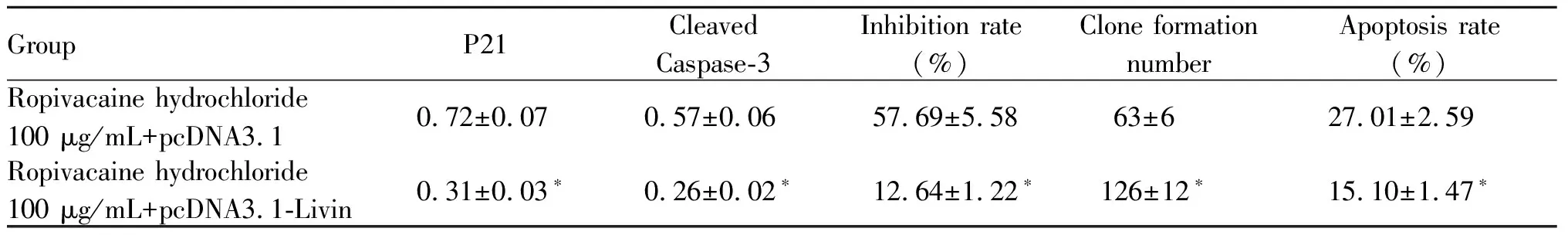
Tab. 4 Overexpression of Livin can reverse the inhibitory effect of ropivacaine hydrochloride on cell U2OS / DOX proliferation and promote apoptosis
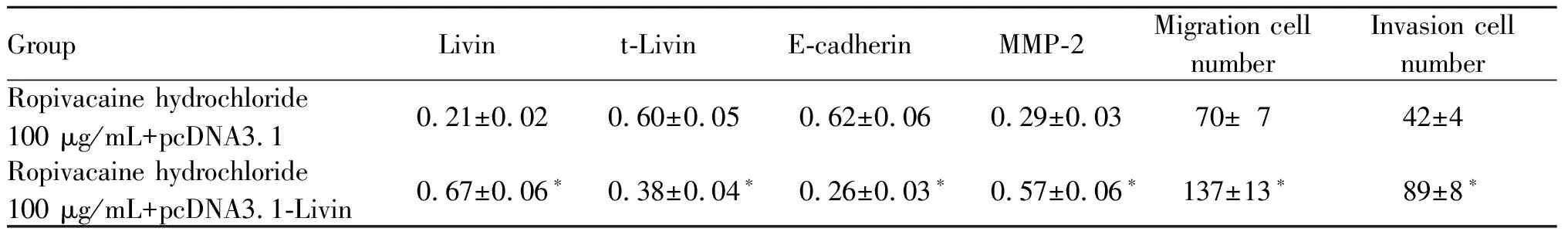
Tab. 5 Overexpression of Livin can reverse the inhibitory effects of ropivacaine hydrochloride on cell U2OS / DOX migration and invasion
3 讨论
骨肉瘤是常见的骨原发恶性肿瘤,随着化疗等治疗方式的进步,明显改善了骨肉瘤患者预后,但化疗耐药是如今骨肉瘤化疗治疗的一大问题,逆转其化疗耐药性是提高其疗效的关键[11]。以往研究发现,麻醉药物可影响肿瘤患者免疫功能及肿瘤患者术后转移和复发[12]。据报道,罗哌卡因可抑制人甲状腺癌细胞增殖,诱导其凋亡,且呈剂量依赖性[13]。高浓度的罗哌卡因对结肠癌和胰腺癌细胞具有体外抗增殖作用[14]。罗哌卡因可显著降低结肠癌细胞SW480和SW620的活力[15]。他莫昔芬通过增加人骨肉瘤细胞MG-63对化疗药物多柔比星的敏感性而抑制细胞增殖[16]。本实验建立骨肉瘤耐药细胞U2OS/DOX后用不同浓度的盐酸罗哌卡因处理,细胞增殖抑制率及凋亡率显著升高,克隆形成数及迁移、侵袭数显著减少; P21、Cleaved Caspase-3、E-cadherin的表达水平显著升高, MMP-2表达水平显著下降,呈浓度依赖性。P21是细胞周期相关蛋白,其高表达可阻滞细胞周期,抑制细胞增殖;而Cleaved Caspase-3是凋亡相关蛋白,其高表达表明细胞凋亡增多;E-cadherin是细胞间质相关蛋白,MMP-2是基质金属蛋白酶,其均影响细胞迁移侵袭;因此,本实验结果说明,盐酸罗哌卡因可剂量依赖性的抑制U2OS/DOX细胞增殖、迁移、侵袭,并促进细胞凋亡,其可能与调控相关蛋白表达有关;即盐酸罗哌卡因增加了骨肉瘤细胞对多柔比星的敏感性;与在其他肿瘤中相似,也具有抗癌作用。
Livin在骨肉瘤中高表达,与骨肉瘤的Enncking分期与肿瘤大小显著相关,是骨肉瘤患者的独立预后因素[17]。敲除Livin可以显著降低U2OS细胞的细胞增殖,集落形成及侵袭和迁移能力,并增强人骨肉瘤细胞对顺铂的化学敏感性[18]。沉默Livin通过调节细胞凋亡和自噬,提高了结肠癌细胞对5-氟尿嘧啶的敏感性[19]。敲低Livin诱导头颈部鳞状细胞癌细胞凋亡,并增强了顺铂,5-氟尿嘧啶和多西他赛化疗诱导的细胞凋亡[20]。以上研究表明,Livin参与调控包括骨肉瘤在内的多种肿瘤的进展及药物敏感性。Livin是细胞凋亡抑制剂蛋白家族的成员,该家族抑制多种刺激触发的细胞凋亡;半胱天冬酶可以裂解Livin产生截短的蛋白t-Livin;当Livin水平降低时,t-Livin水平便相对升高[21]。本实验结果显示,盐酸罗哌卡因处理的U2OS/DOX细胞中Livin表达水平显著降低,t-Livin表达水平升高。提示盐酸罗哌卡因抗体可调控U2OS/DOX细胞中Livin的表达。此外,本实验还发现,过表达Livin逆了转盐酸罗哌卡因对细胞U2OS/DOX恶性生物学行为的影响。提示,盐酸罗哌卡因可能通过调控Livin表达影响U2OS/DOX细胞的增殖、迁移、侵袭和凋亡。
综上所述,盐酸罗哌卡因能明显抑制对多柔比星具有耐药性的骨肉瘤细胞的增殖,迁移和侵袭,明显促进骨瘤细胞凋亡,其机制可能与Livin有关。
