头面部血管肉瘤7例临床组织病理分析并文献回顾
2021-12-08陈永国常建民
杨 慧,陈永国,崔 静,宋 英,常建民
血管肉瘤(angiosarcoma,AS)又名恶性血管内皮细胞瘤,由Perez-Atayde等[1]于1986 年首次报道为血管源性肿瘤的上皮样亚型,后逐渐被认识和了解。该病可发生于任何部位,约60%发生于皮肤或浅表软组织。皮肤AS临床上可分为原发型和继发型两种,老年人头面部AS为最常见的原发性AS。笔者总结7例原发于头面部的AS患者的临床资料、组织病理表现、治疗及转归,并结合文献对其临床和组织病理特点、鉴别诊断及最新治疗方法进行探讨及归纳,以期为临床医生提供参考和借鉴。
1 资料与方法
分析2014—2019年北京医院及航天中心医院诊治的7例AS患者组织病理和临床资料。所有活检标本均经10%甲醛固定、石蜡包埋后切片。常规苏木精-伊红(HE)染色,并行相关免疫组化染色,包括CD31、CD34抗体的免疫组化标志,所有标本CD31和CD34胞质和胞膜均为阳性。
2 结果
2.1 临床特征
7例AS患者中男5例,女2例,平均发病年龄68.8岁(61~74岁)。6例患者发病前无明显诱因,1例6个月前皮损局部有外伤史。7例患者皮损均在头顶部及额头,主要表现为多发的紫黑色结节或稍隆起于皮肤的肿块,大小不等,颜色不均匀,界限不清楚,表面伴有溃疡和出血。病灶区皮肤呈暗红色、紫黑色或褐色,散在的黑色斑点,也可表现为大片紫色斑片(图1)。结节或斑块质地柔软,触碰易出血。7例患者就诊时均无局部自觉症状,从发现皮损到就诊平均用时2.7个月(0.3~6个月)。临床初诊时诊断分别为皮肤感染(1例)、Kaposi肉瘤(2例)、良性皮肤血管瘤(1例)、皮肤外伤(3例)。7例患者初诊科室为皮肤科(3例)、神经外科(2例)、普通外科(2例)。

图1 血管肉瘤患者头面部典型皮损展示
2.2 治疗方法
7例患者中单纯放疗1例,单纯手术治疗1例,综合治疗5例。综合治疗患者中手术+放疗+化疗4例,手术+放疗+化疗+生物治疗1例,放疗和(或)化疗及生物治疗均在术后执行。经历手术治疗的6例患者手术治疗方案均为局部广泛切除+植皮(图2a),5例手术治疗1次,1例手术治疗2次。化疗方案为阿霉素+异环磷酰胺+达卡巴嗪联合化疗。生物治疗方案为贝伐珠单抗(bevacizumab)分子靶向治疗。
2.3 组织病理学特征及免疫组化染色结果
AS组织病理表现为表皮轻度萎缩或大致正常,真皮中大量大小不等的腔隙形成,肿瘤侵犯整个真皮网状层甚至直到皮下组织,从小的裂隙到大的扩张明显如囊腔样的管腔,腔隙中见多少不等的红细胞,并相互融合成网状;管壁大都由一层内皮细胞组成,少数管壁由多层内皮细胞组成,细胞体积大,胞质丰富,核异形明显;间质血管及胶原纤维较少(图3)。7例患者免疫组化染色结果示CD31、CD34、D2-40、ERG均为阳性(图4)。

图3 血管肉瘤患者皮损组织病理(HE染色 )

图4 血管肉瘤患者皮损组织病理免疫组化(SP法×100 )
2.4 复发和转移
所有患者皮损均出现复发或转移,转移发生在起病6~14个月,中位时间为9.8个月。7例患者均出现局部复发(图2b),远处转移5例,转移部位依次为肺4例,肺部合并肝脏1例。
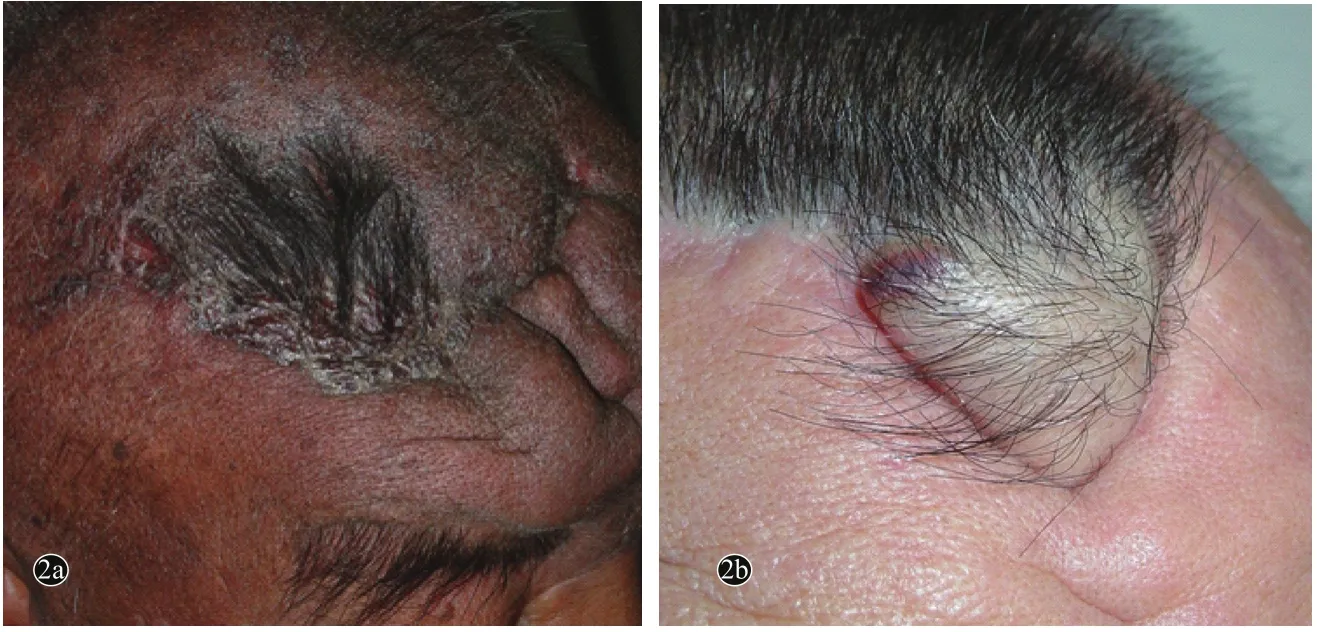
图2 血管肉瘤患者(例1)头面部术后及复发临床表现
2.5 预后
随访期为15个月,随访期结束所有患者均已死亡。单纯放疗的患者7个月后死亡,单纯手术治疗患者11个月后死亡,死因分别为呼吸困难、肺部和肝脏转移后胸腹水感染。单次手术+放疗+化疗患者平均13.2个月后死亡,两次手术+放疗+化疗+生物治疗患者15个月死亡,死因为肺部转移后呼吸困难、肺出血合并感染、胃肠道出血等(表1)。

表1 7例血管肉瘤患者临床资料
3 讨论
血管肉瘤又名恶性血管内皮细胞瘤(malignant angioendothelioma),约占所有软组织肉瘤的1%,约有1/4来源于血管内皮及淋巴管[2]。目前病因不明,可能与放射线接触和长期日光暴露有关。有研究表明,AS的发生与多基因突变相关,最常见的相关发病基因是TP53,KRAS,PTPRB和PLCG[3]。负责抑制肿瘤蛋白p53合成的TP53基因突变见于50%左右的AS患者[4]。编辑血管生长的人蛋白酪氨酸磷酸酶受体 B(PTPRB)和磷脂酶 γ-1(PLCG1)的基因在激活异常血管生成中起重要作用,并且最可能是启动AS的环节之一[5]。Shimozono等[5]在一项针对25例AS患者的研究中发现其中9例患者存在新的融合基因NUP160-SCL43A3,并认为该基因可能在调节其他基因突变中起到一定作用。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路中的多发突变在细胞培养实验中被证实与AS发生相关[6]。
AS临床表现无特异性,初期为紫红色斑片,境界不清,形态不规则,后发展为暗红色、紫黑色或褐色的斑块和结节,质地不等,单发或多发,可伴有溃疡和出血。AS发病年龄多在60岁以上,男性多于女性,发生于头面部的血管肉瘤比例约为50%[7]。本次研究中,7例AS患者平均年龄为68.8岁,皮损均出现在头面部,以头顶及额头为主,临床表现符合AS描述,确诊前临床疑诊外伤出血、皮肤良性肿瘤、Kaposi肉瘤等,误诊率为100%。临床上应与基底细胞癌、鳞状细胞癌、Kaposi肉瘤、深部真菌病等鉴别。由于AS初期临床表现缺乏特异性,故多不能于初诊时正确诊断,需行组织病理学检查以明确诊断。值得注意的是,即使患者行组织病理学检查后,仍存在较高的误诊率。AS在组织病理学上有多种不同的表现,这也是导致组织病理误诊的主要原因之一。高分化病变是由多数不规则相互吻合的血管腔隙组成,血管腔隙穿插在胶原纤维束之间,可侵犯皮下组织,甚至骨骼肌和骨旁组织,血管腔衬覆不同程度多形性的、深染的内皮细胞,内皮细胞常为多层,并形成乳头状结构,可见部分异常的核分裂像。中分化病变不易看出血管腔隙,瘤细胞呈梭形,排列成较紧密的束状形态。而低分化的病变以实性为主,瘤细胞形成实性团块,细胞多边形上皮样,异形性明显,无典型血管结构。有报道称部分AS可见透明细胞、泡沫细胞、印戒细胞,表皮可有乳头瘤样增生[8,9]。AS分化越差,其形态越多样化,常规HE染色诊断与鉴别诊断均较为困难。
免疫组化染色对诊断血管肉瘤具有重要意义。CD31、CD34和FⅧ 是常用的内皮细胞标志抗原,但特异性较差。来源于EST家族的核免疫组化标志物EGR和FLI1对AS的诊断敏感性较高[10]。此外,部分AS中表达D2-40、VEGFR-3,提示肿瘤可能有淋巴管来源[11]。陈柳青等[12]对于9例血管肉瘤组织病理表现进行分析时指出,CD31、CD34、FⅧ 3种标志在有管腔或裂隙形成的内皮细胞中均强表达,实体瘤区域表达弱甚至阴性,因此推断AS的肿瘤细胞会出现不同程度失标志现象。仅标记一种抗体可能会造成漏诊或误诊,对可疑患者需多种标志物同时应用。有研究表明,AS患者血清p53抗体浓度较健康对照组高,且治疗后明显下降,认为该检查可作为诊断及观察AS治疗效果的指标[13]。
AS目前无统一的治疗方案,因该病几乎均有肉眼不可见的卫星灶,单纯手术很难彻底清除病灶,即使切缘组织病理显示阴性,仍无法避免复发,因此以手术为主的综合治疗为该病的首选治疗方案[14]。有研究表明,手术联合放疗及化疗可提高远期生存率[15]。手术需局部扩大切除1~3 cm。化疗目前无统一方案,最常用的化疗药物有阿霉素、异环磷酰胺、紫杉醇、达卡巴嗪等。有文献报道应用紫杉醇联合γ-白细胞介素Ⅱ局部动脉灌注或应用阿霉素局部动脉灌注联合病灶内注射γ-干扰素可使肿瘤完全消失[16,17]。也有研究认为单纯应用紫杉醇对部分无法手术或有转移病灶的患者可作为首选[18]。贝伐珠单抗作为一种血管内皮生长因子受体抑制剂,可单独或联合应用于AS患者。有研究表明其单独应用于AS患者中位进展期为26周[19],可作为AS的二线治疗方案。目前有研究应用帕唑帕尼治疗AS,总生存期为9.9个月,但其长期疗效仍有待随访考证[20]。
AS预后较差,1篇Meta分析指出,AS平均5年生存率为33.5%[15]。有回顾性研究表明,AS中位生存时间为23个月,其中患者年龄、肿瘤部位、手术切缘阳性、肿瘤形态及范围为影响该病预后的独立危险因素。年龄>70岁,肿瘤面积>5 cm,发生于头部、多发溃疡的血管肉瘤预后更差[21-23]。本研究中7例患者的生存期低于国外研究的中位生存时间,笔者认为其原因主要有以下两点:①就诊不及时。血管肉瘤为恶性内皮细胞肿瘤,发展及转移速度快,但其发病时几乎无局部不适自觉症状,故患者常不重视而延误就诊。②误诊率高[24]。因血管肉瘤临床相对罕见,部分临床医生对该病认识不足,本文7例患者于初诊时均出现误诊。值得深思的是,部分患者行组织病理检查后,仍有2例患者被诊断为Kaposi肉瘤,故除常规组织病理检查外,还需结合多种免疫组化检查,以便做出正确诊断。
