魔芋茎腐病发病程度对其根际微生物群落结构的影响
2021-12-08赵兴丽罗林丽周罗娜贺圣凌周玉锋
赵兴丽, 张 莉, 罗林丽, 周罗娜, 贺圣凌, 张 欣, 周玉锋
(1.贵州省农业科学院 生物技术研究所, 贵州 贵阳 550006; 2.贵州省农业科学院 草业研究所, 贵州 贵阳 550006; 3.贵州省农业科学院 茶叶研究所,贵州 贵阳 550006)
0 引言
【研究意义】魔芋经济价值很高,其块茎含有丰富的葡甘聚糖,具有良好的营养和保健特性[1-3];可以食用或酿酒,具有降血脂、血清胆脂及消肿攻毒之功效[4],还具有抗糖尿病的作用[5-8],对人体皮肤也具有益处[9],同时还是重要的添加剂和化工原料[10]。魔芋具有较好的市场需求,现实却供不应求,原因是魔芋土传病害(软腐病、根/茎腐病、白娟病等)是制约其扩大种植规模的重要原因之一。魔芋茎腐病是由镰刀菌(Fusariumspp.)侵染引起的一种真菌性病害,主要危害地下块茎,发病初期为褐色水浸渍病斑,根部、块茎腐烂变黑,植株生长矮小,叶片发黄,后期叶柄枯萎,严重时整个植株死亡[11]。镰刀菌(Fusariumspp.)是土壤习居菌,既可以在病残体上生存,也可单独在土壤中以休眠态存活多年[12],待温湿度条件满足时,病菌便侵染魔芋根系和块茎致使植株发病。病原菌在长期进化和生存竞争中,可与根际土壤中有益微生物形成互生、共生、寄生、竞争、拮抗及吞食等关系[13];其中有益微生物通过养分竞争、拮抗作用、诱导系统抗性和重寄生作用等机制抑制土壤中的病菌、促进植物生长[14];而病原菌的大量积累将导致植株死亡[15]。了解魔芋茎腐病不同发病程度下根际土壤微生物(尤其是有益微生物)的变化,不仅可为魔芋-土壤-微生物的互作关系提供理论依据,且对指导魔芋土传病害防治具有现实意义。【前人研究进展】影响魔芋根际土壤微生物群落结构的因素较多,如海拔、种植年限及种植模式等[16-18]。研究表明,随着海拔高度的增加,魔芋根际土壤中细菌、真菌、放线菌和微生物总量均相应增加[19];长期连作魔芋根际土壤细菌数量增多、真菌和放线菌数量却减少[20];魔芋与不同作物或林木套种后发现,林下魔芋土壤微环境优于大田。进一步研究还发现,施用有益微生物也会引起魔芋根际土壤微生物群落结构的变化[21-22]。【研究切入点】随着土壤微生物群落研究的发展,传统的分子生物学方法因费力、昂贵、耗时,并且分辨率较低等特点[23],逐渐被高通量测序技术(Illumina Mi Seq)等新测序技术所代替。虽然,前人已采用高通量测序技术对魔芋不同海拔、连作、套种以及施用有益微生物等条件下根际微生物群落结构和多样性进行研究,但有关魔芋茎腐病发病程度下根际微生物群落结构和多样性的研究还未见报道。【拟解决的关键问题】以魔芋茎腐病为对象,利用高通量测序技术测定轻度发病、中度发病、重度发病情况下根际微生物群落结构和多样性;比较不同发病程度下魔芋根际土壤中有益微生物的变化,探析魔芋茎腐病发病程度对其根际有益微生物的影响,以期为利用土壤微生物多样性和有益微生物防控魔芋茎腐病提供理论依据。
1 材料与方法
1.1 材料
1.1.1 土样 土样采自贵州省独山县苗泥村(东经107.61°、纬度25.86°)魔芋种植地,品种为花魔芋。参照软腐病的分级标准[24]将魔芋茎腐病发病程度分为轻度、中度和重度3个等级,每个等级各选择3株植株,去掉其根际表层土壤后,取魔芋块茎周围的土壤,混匀,无菌自封袋保存,带回实验室备用。
1.1.2 试剂 引物[真菌ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)、细菌338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)、古细菌524F10extF(5′-TGYCAGCCGCCGCGGTAA-3′)和Arch958RmodR(5′-YCCGGCGTTGAVTCCAATT-3′)]以及试剂(10×Buffer、2.5 mM dNTPs、rTaq Polymerase、BSA、Template DNA),均由上海美吉生物医药科技有限公司提供。
1.1.3 仪器设备 pH计(梅特勒-托利多仪器有限公司),TU-1901紫外可见分光光度计(北京普析通用仪器有限责任公司),TAS-990F原子吸收分光光度计(北京普析通用仪器有限责任公司),Optima 8000电子耦合等离子体发射光谱仪(Perkin Elmer)。
1.2 方法
1.2.1 魔芋根际土壤含水量、pH及养分含量测定 称取一定量的土样置于60℃的烘箱中烘干,通过土壤鲜重和干重统计土壤的含水量;取5 g土壤加入到装有45 mL无菌水的锥形瓶中,150 r/min震荡30 min,使土壤完全溶解于水中,pH计检测土壤悬液的pH。采用酸式滴定管测定土壤全氮,采用紫外可见分光光度计测定土壤中磷的含量,采用原子吸收分光光度计测定土壤中钾和有效磷的含量,采用电子耦合等离子体发射光谱仪测定土壤中速效钾的含量。3次重复,取平均值。
1.2.2 魔芋根际土壤高通量测序 分析天平称取0.5 g魔芋根际土壤样品,提取土壤总DNA,使用引物ITS1F和ITS2R、338F和806R以及524F10extF和Arch958RmodR分别扩增真菌ITS1F-ITS2R区域、细菌338F-806R区域以及古细菌524F10extF-Arch958RmodR区域的基因片段。PCR体系(20 μL):10×Buffer,2 μL;2.5 mM dNTPs,2 μL;上游引物0.8 μL;下游引物 0.8 μL;rTaq Polymerase 0.2 μL;BSA 0.2 μL;Template DNA 10 ng,补水至20 μL。PCR反应程序:真菌和古细菌(95℃预变形3 min,95℃变性30 s,55℃退火30 s,72℃延伸45 s,循环35次,72℃延伸10 min,10℃保存);细菌(95℃预变形3 min,95℃变性30s,55℃退火30s,72℃延伸45s,循环27次,72℃延伸10 min,10℃保存)。PCR产物经2%琼脂糖凝胶电泳检测后,采用Quanti FluorTM-ST(Promega,USA)系统定量检测PCR产物浓度,依托上海美吉生物医药科技有限公司使用Illumina Miseq 300平台对样品进行高通量测序。最终数据利用云平台(https://www.i-sanger.com)进行OTU聚类分析和物种分类学分析。为了得到每个OTU对应的物种分类信息,采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,并分别在Domain(域),kingdom(界),Phylum(门),Class(纲),Order(目),Family(科),Genus(属),Species(种)等水平统计各样本的群落物种组成。组间显著性差异检验根据得到的群落丰度数据,运用Kruskal-Wallis秩和检验(Kruskal-Wallis H test)方法,对不同组微生物群落之间的物种进行假设检验,评估物种丰度差异的显著性水平,获得组间显著性差异物种。
1.3 数据统计与分析
采用WPS 2007及DPS 7.05对土壤养分及根际微生物属水平上各类真菌、细菌以及古细菌的相对丰度以及多样性进行分析。细菌和古菌16S rRNA采用Silva数据库(Release132 http://www.arb-silva.de)进行比对;真菌ITS采用Unite数据库(Release 7.2 http://unite.ut.ee/index.php)进行比对。
2 结果与分析
2.1 魔芋根际土壤的含水量、pH及养分含量
从表1看出,魔芋不同发病程度其土壤含水量为79.28~84.61%,表现为中度>重度>轻度,其中,中度发病土壤的含水量显著高于轻度发病土壤,其余发病程度土壤间无显著差异。魔芋不同发病程度其土壤pH为5.11~5.22,表现为轻度>中度>重度,各发病程度土壤间差异显著。魔芋不同发病程度土壤中氮的含量存在明显差异,表现为中度>重度>轻度,中度发病土壤的氮含量显著高于轻度发病土壤,其余发病程度土壤间无显著差异;魔芋不同发病程度其土壤中磷、钾、有效磷以及速效钾的含量均无显著性差异,其中钾和有效磷的含量均表现为轻度>中度>重度,速效钾的含量表现为重度>轻度>中度。
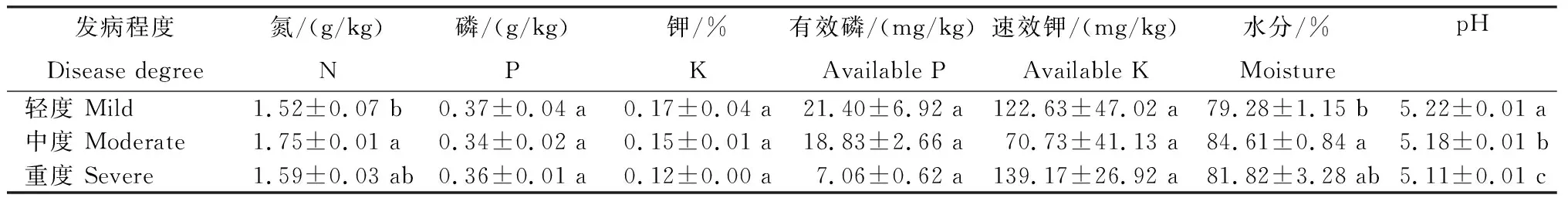
表 1 魔芋根际土壤的含水量、pH及养分含量
2.2 不同发病程度魔芋根际土壤微生物的多样性
2.2.1 魔芋根际土壤总DNA的PCR扩增效果 从图1看出,序号1~9的基因片段经PCR扩增均在250~500 bp获得相应的条带,序号10~18的基因片段均在500~750 bp获得相应的条带,序号19~27的基因片段均在500 bp左右获得相应的条带,其中,除序号1~9的条带有点拖尾和CK无条带外,其余条带都很明亮,说明提取获得的DNA量能满足后续测序所需。
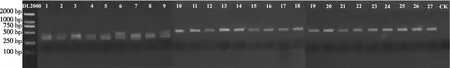
注:1~9,扩增ITS基因序列所得产物的凝胶电泳条带;10~18,扩增16S rRNA片段获得产物的凝胶电泳条带;19~27,扩增524F10extF-Arch958RmodR片段获得产物的凝胶电泳条带;1~3、10~12及19~21,轻度发病;4~6、13~15及22~24,中度发病;7~9、16~18及25~27,重度发病。
2.2.2 不同发病程度魔芋根际土壤微生物的群落结构 从图2看出,在属的分类水平下,不同发病程度魔芋根际土壤中富含多个属类微生物,其中优势真菌包括被孢霉属(Mortierellaspp.)、绿核菌属(Ustilaginoideaspp.)、毛壳菌属(Chaetomiaceaespp.)和假单胞菌属(Pseudeurotiuspp.)等;优势细菌包括酸杆菌属(Acidobacterspp.)、黄色杆菌属(Xanthobacteraceaespp.)、念珠菌属(Candidatusspp.)、病毒杆菌(Vicinamibacteralesspp.)和缓生根瘤菌属(Bradyrhizobiumspp.)等;优势古细菌包括水生古细菌(Bathyarchaeotaspp.)、亚硝基球菌属(Nitrococcusspp.)、甲烷胞菌属(Methanocellaspp.)、甲烷八叠球菌属(Methanosarcinaspp.)等。各微生物在魔芋根际土壤中的含量存在一定的差异性。
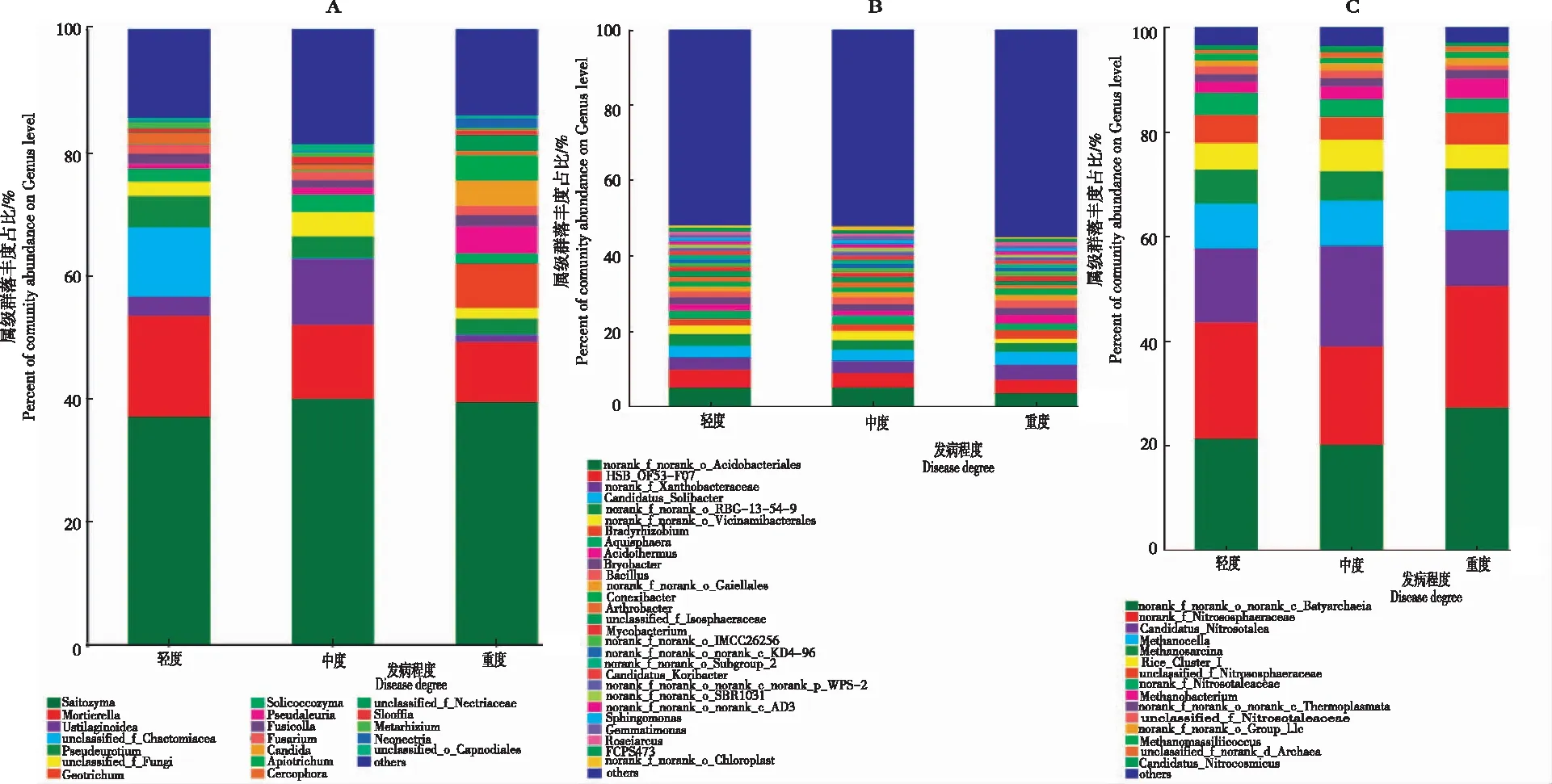
注:A,不同发病程度下魔芋根际土壤真菌群落组成;B,不同发病程度下魔芋根际土壤细菌群落组成;C,不同发病程度下魔芋根际土壤古细菌群落组成。
2.2.3 不同发病程度魔芋根际土壤的微生物多样性 从表2看出,魔芋根际土壤中真菌、细菌以及古细菌的覆盖率均大于97.00%,其中,古细菌类群覆盖率均为100%,真菌覆盖率均大于99%,细菌类群覆盖率为97.00%~98.00%,基本涵盖了各处理魔芋根际土壤中所有真菌、细菌、古细菌类群。丰富度指数中Sobs指数、Ace指数及Chao 1指数均呈细菌>真菌>古细菌,真菌的3个指数均呈重度>轻度>中度,细菌和古细菌的3个指数均呈轻度>中度>重度;发病程度越高,根际土壤中细菌和古细菌的丰富度越低。多样性指数中香农指数呈细菌>真菌>古细菌,真菌的香农指数均呈重度>中度>轻度,细菌的香农指数呈中度>轻度>重度,古细菌的香农指数呈中度=重度>轻度;辛普森指数呈古细菌>细菌>真菌,真菌的辛普森指数均呈轻度>重度=中度,细菌的辛普森指数呈重度>轻度>中度,古细菌的辛普森指数呈重度>中度=轻度。发病程度对魔芋根际土壤的微生物多样性具有一定的影响,发病程度越高,魔芋根际土壤真菌的多样性越高。重度发病区土壤中丛赤壳属(Nectriaspp.)、芽孢杆菌属和短根瘤菌属(Bradyrhizobiumspp.)的数量分别是轻度发病区的1.22~32.57倍。
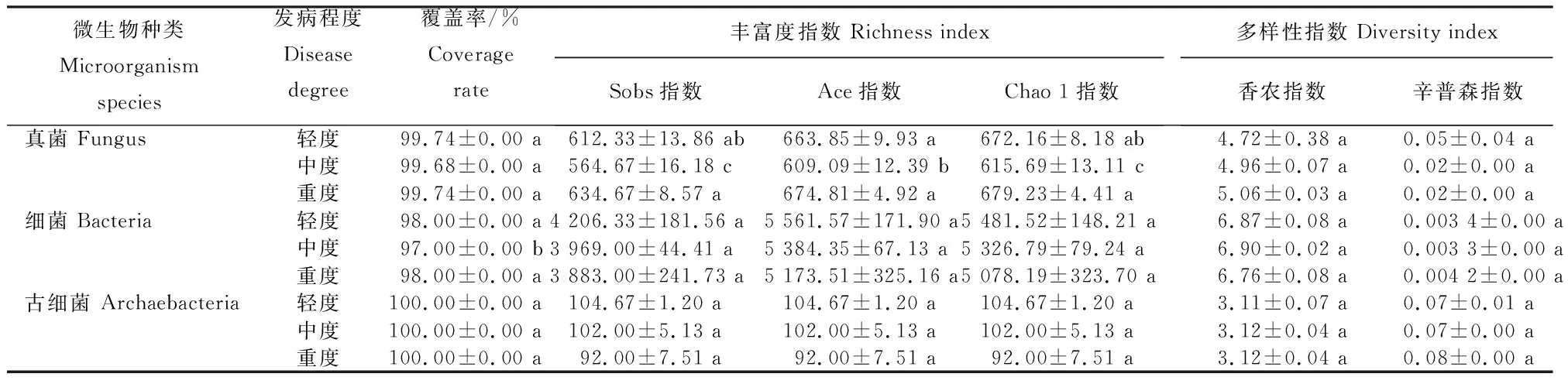
表 2 不同发病程度魔芋根际土壤微生物的丰富度指数与多样性指数
2.2.4 不同发病程度魔芋根际土壤微生物的数量和种类 从图3看出,不同发病程度魔芋根际土壤中获得微生物的碱基数和序列数、微生物总量和种类均存在一定的差异。1) 碱基数和序列数。碱基数为15.14×106~15.80×106bp,呈中度>轻度>重度;序列数为71.12×103~72.93×103条,呈轻度>中度>重度;碱基数和序列数各发病程度土壤间无显著差异。2) 微生物总量。发病程度越高土壤中真菌的数量越多,中度发病区(71.40×103OTUs)、重度发病区(72.33×103OTUs)较轻度发病区土壤中真菌数量(70.49×103OTUs)分别增加2.61%、1.29%;3个发病程度间无显著差异。细菌数量呈轻度>重度>中度,轻度显著高于中度,其余处理间差异不显著。古细菌数量呈中度>轻度>重度,各处理间差异不显著。3) 微生物种类。古细菌种类为9~14种,发病程度越高土壤中特有古细菌的种类越少,呈轻度>中度>重度;魔芋土壤特有真菌的种类以中等发病区最多,为114种,分别较轻度发病区(37种)和重度发病区(53种)多208.11%和115.09%;魔芋土壤特有细菌的种类以重度发病区最多,为98种,分别较轻度发病区(72种)和重度发病区(59种)多36.11%和66.10%。
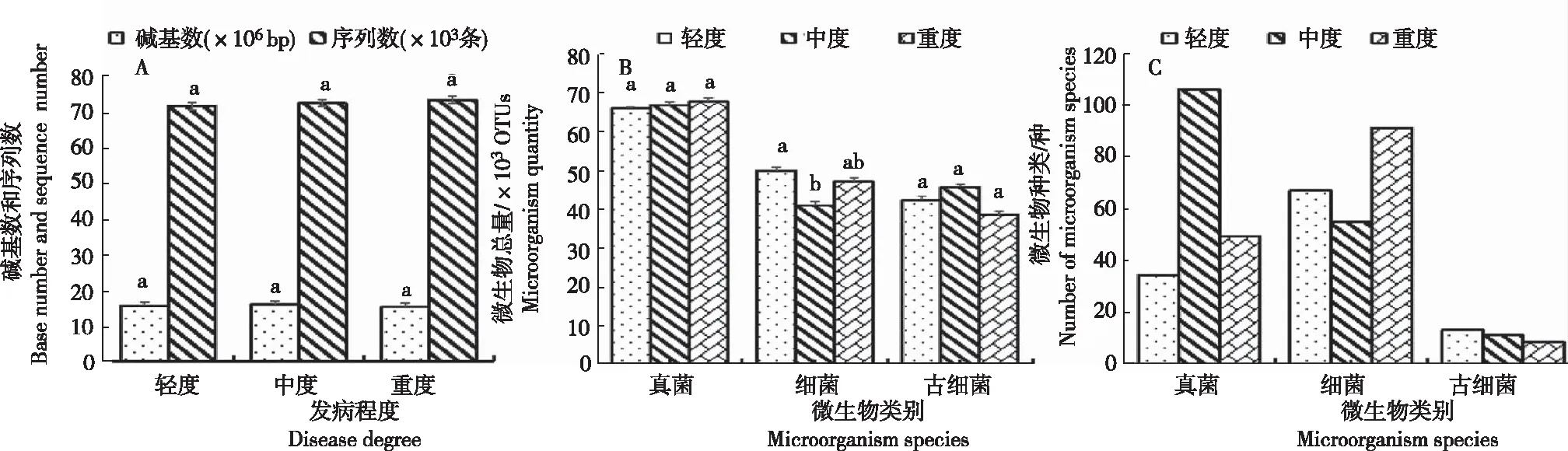
注:A,所有微生物的碱基数和序列数;B,微生物总量;C,特有微生物的种类。
2.2.5 不同发病程度魔芋根际土壤有益微生物的差异 从图4看出,不同发病程度魔芋根际土壤中微生物所占的比例不同,有益微生物和有害微生物在土壤微生物中的比例随病害程度的变化而变化,魔芋根际土壤中有益真菌包括被孢霉属(Mortierellaspp.)和丛赤壳属(Nectriaspp.);有益细菌包括能促进植物生长或抑制病原菌生长的芽孢杆菌属(Bacillusspp.)、具有固氮作用的短根瘤菌属(Bradyrhizobiumspp.)和芽单胞菌属(Gemmatimonasspp.)以及能产生抑制病原菌生长的次生代谢物的放线菌门内的Gaiellalesspp.;有害微生物包括镰刀菌属(Fusariumspp.)等。随发病程度加深,有益微生物Gaiellalesspp.和芽孢杆菌属(Bacillusspp.)数量呈递增趋势;且重度发病区土壤中丛赤壳属(Nectriaspp.)数量是轻度发病区的32.57倍,芽孢杆菌属数量是轻度发病区的1.22倍,短根瘤菌属(Bradyrhizobiumspp.)数量是轻度发病区的1.31倍。
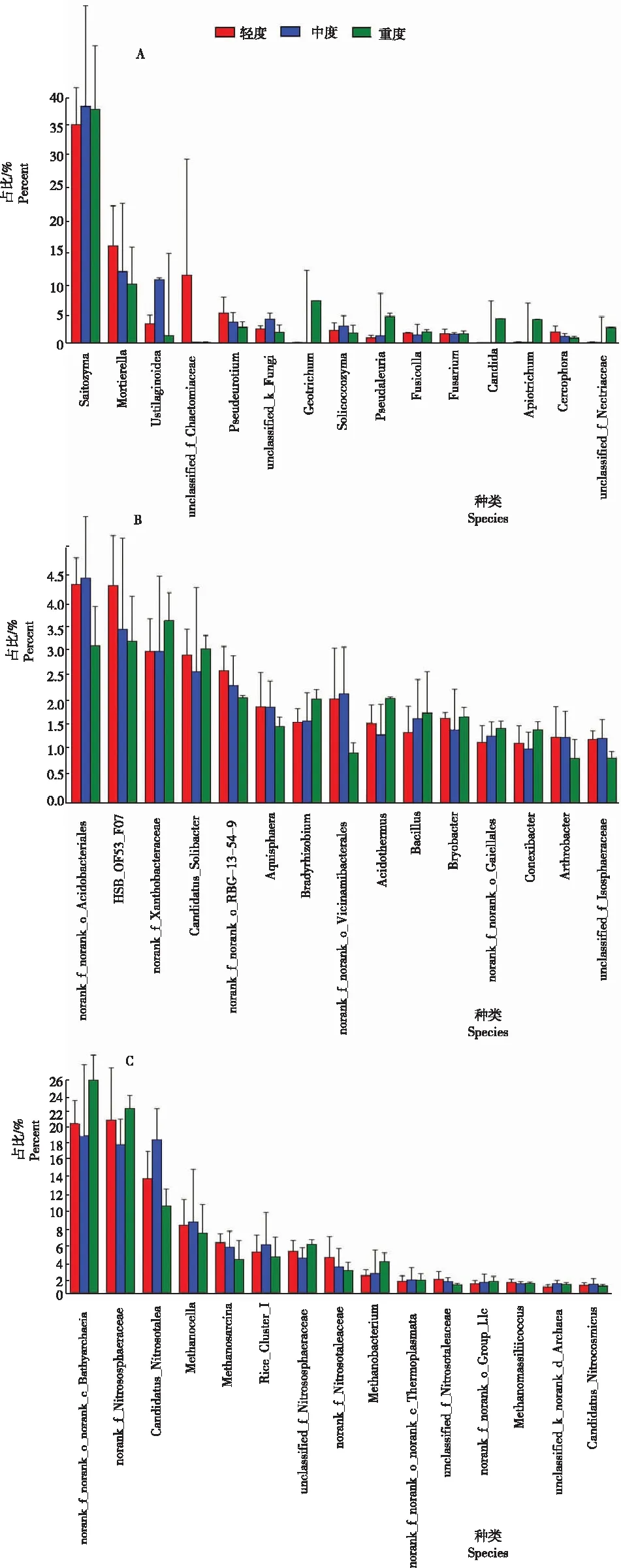
注:A,真菌组间差异;B,细菌组间差异;C,古细菌组间差异。
3 讨论
自2017年以来,魔芋市场需求旺盛,价格飞涨,加工企业对原材料需求量陡增,但魔芋生产基地发展滞后,魔芋加工原料十分短缺,无法满足企业的基本生产需求[25]。之后的几年,魔芋市场仍供不应求,因制约魔芋产业发展的重要因素即土传病害一直未得到有效解决[26]。随着土壤微生态逐渐被人们所了解,越来越多的研究从单纯的拮抗药剂或拮抗微生物的筛选转向通过作物根际土壤微生物群落结构变化的角度摸索土传病害的防治方法,并取得一定的研究成果。研究发现,选择健康优质的土地进行种植,可减少有害菌数量[27],种植期间通过改变种植方式(套种、间种、林下种植及轮作等)调节作物根际土壤微生物群落结构和组成,使土壤中有益菌群保持相对平衡,进而减少土传病害的发生[28];还可通过减少种植年限,不重茬种植,减少土壤中尖孢镰刀菌数量以及致病菌所占土壤根际微生物总量的比例,达到减少病害发生的概率[29]。研究还发现,植物在生长过程中常常将许多营养物质分配至根部,并通过其根系向周围环境释放大量的单糖、多糖、有机酸、氨基酸、酚类化合物、蛋白质等营养和能源物质,吸引大量微生物聚集[30-32],这些微生物可通过抗生或诱导植物防御等作用抵御病原菌的侵染[33-34],对植物起到保护作用。研究表明,魔芋根际微生态对土传病害的发生有一定的影响,同时魔芋根系也会分泌一定的物质招募大量微生物抵御病原菌的侵染,具体的互作机理尚不清楚。TRIVEDI等[35]研究发现,柑橘黄龙病菌(Candidatusliberbacterasiaticus)侵染柑橘后会改变柑橘根际土壤微生物群落结构和组成,并增加放线菌的聚集。该研究发现,随着魔芋茎腐病发病程度加深,魔芋根际土壤中有益微生物Gaiellalesspp.和芽孢杆菌属数量也随之增加。与TRIVEDI等[35]的研究结果相似。在该研究中,有益微生物Gaiellalesspp.和芽孢杆菌属的数量受魔芋茎腐病发病程度的影响,是魔芋根系还是镰刀菌分泌的某种物质吸引其聚集,还是其他不可知的原因,还需深入研究。且魔芋植株遭到病害侵袭时上述有益微生物是否协助防御,并通过有益微生物调控魔芋根际微生物区系,减轻魔芋茎腐病的发生等也需进一步深入研究。
4 结论
魔芋茎腐病发病程度对其土壤pH和养分含量存在一定的差异;魔芋发病程度对其根际土壤微生物群落结构和多样性具有一定的影响,其中细菌和古细菌的丰富度表现为轻度>中度>重度,真菌多样性表现为轻度<中度<重度;魔芋发病程度对其根际土壤中获得微生物的碱基数和序列数、微生物总量和种类也存在一定的影响作用,发病程度越高获得的序列数以及特有的古细菌数越少;魔芋发病程度对其根际有益微生物的种类和数量也存在一定的影响,其中有益微生物Gaiellalesspp.和芽孢杆菌属(Bacillusspp.)数量随发病程度加重呈递增趋势。土壤中丛赤壳属、芽孢杆菌属和短根瘤菌属的数量重度发病区为轻度发病区的1.22~32.57倍。
