基于增强CT影像组学评分和临床分期的列线图预测胃癌脉管浸润的价值
2021-12-08范晓东陈小凤廖玉婷范伟雄陈湘光朱志强杨志企
范晓东 陈小凤 廖玉婷 范伟雄 陈湘光 朱志强 杨志企
脉管浸润(lymphovascular invasion,LVI)包括淋巴浸润和血管浸润,与胃癌淋巴结转移、术后复发/转移密切相关,是胃癌重要预后因子之一,同时它还是术后是否需要行辅助化疗的重要依据之一[1-2],因此了解术前LVI状态对病人个体化治疗的选择和预后预判具有重要的临床意义。与常规大血管侵犯不同,胃癌LVI难以在常规影像上被发现,只能依靠术后组织病理学检查,因此术前预测LVI具有一定的挑战性。虽然目前组织病理学是诊断LVI的金标准,但其属有创性检查,且结果具有一定的滞后性,不利于病人个体化治疗方案的选择和预后的预判。影像组学能从肿瘤影像中提取海量的定量特征,在肿瘤诊断、鉴别诊断、疗效评估及预后预测方面发挥重要的作用,为个体化精准医疗创造了新途径[3-4]。本研究旨在探讨基于联合治疗前增强CT影像组学评分和TMN分期的列线图预测胃癌LVI的价值,为临床术前预测LVI提供准确依据。
1 资料与方法
1.1 一般资料 回顾性收集2015年8月—2018年11月在梅州市人民医院行术后胃癌LVI状态评估的病人160例,其中男109例,女51例,年龄29~87岁,平均(62.23±10.74)岁;LVI阴性者92例,阳性者68例。纳入标准:①术前行上腹部增强CT检查;②术后病理确诊为胃腺癌。排除标准:①术前行新辅助化疗;②残胃癌;③高分化胃癌;④CT影像质量不能满足诊断要求。将160例病人按照7∶3比例随机分为训练集(112例)和测试集(48例),训练集中LVI阴性者60例、阳性者52例,测试集中LVI阴性者32例、阳性者16例。
1.2 设备与方法 采用GE Discovery HD 750 CT扫描设备。病人取仰卧位,扫描范围自膈顶至髂前上棘水平。检查前病人饮水800~1 000 mL。扫描参数:管电压120 kV,自动管电流,层厚1.25 mm,层间距1.25 mm,矩阵512×512,FOV 350 mm×350 mm,旋转时间0.8 s/r,螺距0.984,准直器宽度40.0 mm。平扫后经肘静脉注射碘帕醇(含碘370 mg/mL,博莱科公司),剂量1.5 mL/kg体质量,注射流率3.0~3.5 mL/s。对比剂追踪触发监测点为第二肝门水平的腹主动脉内,CT阈值为100 HU,触发后30 s、60 s分别采集动脉期、门静脉期影像。
1.3 临床病理特征及LVI状态评估标准 由2名病理科副主任医师对术后组织标本进行分析,意见不一致时则由另1名病理科主任医师进行核对。记录病人性别、年龄、肿瘤直径、TNM分期、AJCC分期、肿瘤分化程度及癌胚抗原(CEA)、糖类抗原199(CA199)。AJCC分期采用第8版美国癌症分期联合委员会(AJCC)胃癌分期标准。LVI阳性定义为显微镜下发现肿瘤细胞侵犯淋巴管或血管[2]。
1.4 影像组学模型构建
1.4.1 肿瘤分割 将静脉期薄层影像像导入ITKSNAP软件(Version 3.6.0,https://itk.org/)内,由1名主治医师对肿瘤进行逐层手动勾画三维兴趣区(VOI),同时由1名副主任医师核对肿瘤VOI勾画范围,标记时应尽量避免超出肿瘤的边界。再由另外1名主治医师随机选取30例病人也进行肿瘤VOI的勾画,并与上述主治医师勾画肿瘤VOI所提取的影像组学特征进行组间一致性分析,筛选一致性系数阈值≥0.75的稳定特征进行后续分析。
1.4.2 影像组学特征提取 采用AK软件(Art ificial Intelligence Kit V3.0.0.R,GE)自动提取VOI的5大类特征(包括直方图特征、灰度共生矩阵、灰度大小区域矩阵、游程矩阵、形态学参数)。特征提取遵循影像生物标志物标准化倡议标准,每例病人提取180个特征。
1.4.3 特征筛选和影像组学模型的建立 首先行组间一致性分析,选取一致性系数阈值≥0.75的特征[2](共剔除41个特征),其次采用Spearman相关分析剔除阈值≥0.90的特征(共剔除109个特征),然后采用最小绝对值收敛和选择算子(10折交叉验证)算法对剩余特征进行降维(共剔除26个特征),最终剩余4个特征,包括最大灰度值、长游程低灰度补偿_angle135_offset1、最大三维直径和面积体积比,对上述4个特征采用多因素logistic回归分析构建影像组学模型,同时计算每例病人的影像组学评分(Radscore),计算公式为其中b为常数项,Xi为选择的特征值,Ci为特征的回归系数。
1.5 构建临床影像联合模型并绘制列线图 比较LVI阳性组和阴性组间病人性别、年龄、肿瘤直径、TNM分期、AJCC分期、组织分化程度及CEA、CA199的差异,然后将差异有统计学意义的临床病理指标和影像组学标签纳入多因素logistic回归构建临床影像联合模型。基于训练集中的数据绘制临床影像联合模型的列线图,然后分别基于训练集及测试集中的数据绘制校准曲线对联合模型的列线图进行验证。
1.6 统计学方法 采用R软件(3.6.0版本)进行数据分析和绘制模型的列线图及校准曲线。符合正态分布的计量资料以均数±标准差()表示,2组间比较采用t检验;非正态分布的计量资料以中位数和四分位距[M(P25,P75)]表示,2组间比较采用Mann-Whitney U检验。计数资料以例(%)表示,2组间比较采用χ2检验或Kruskal-Wallis H检验。采用受试者操作特征(ROC)曲线评估影像组学模型和临床影像联合模型的预测效能,并计算其准确度、特异度、敏感度和ROC曲线下面积(AUC)。应用决策曲线评估列线图的临床净获益。P<0.05为差异有统计学意义。
2 结果
2.1 LVI阳性与阴性组间临床病理特征比较 2组间T分期、N分期和AJCC分期差异均有统计学意义(均P<0.05),而病人性别、年龄,肿瘤直径,组织分化程度,CEA和CA199的差异均无统计学意义(均P>0.05),见表1。
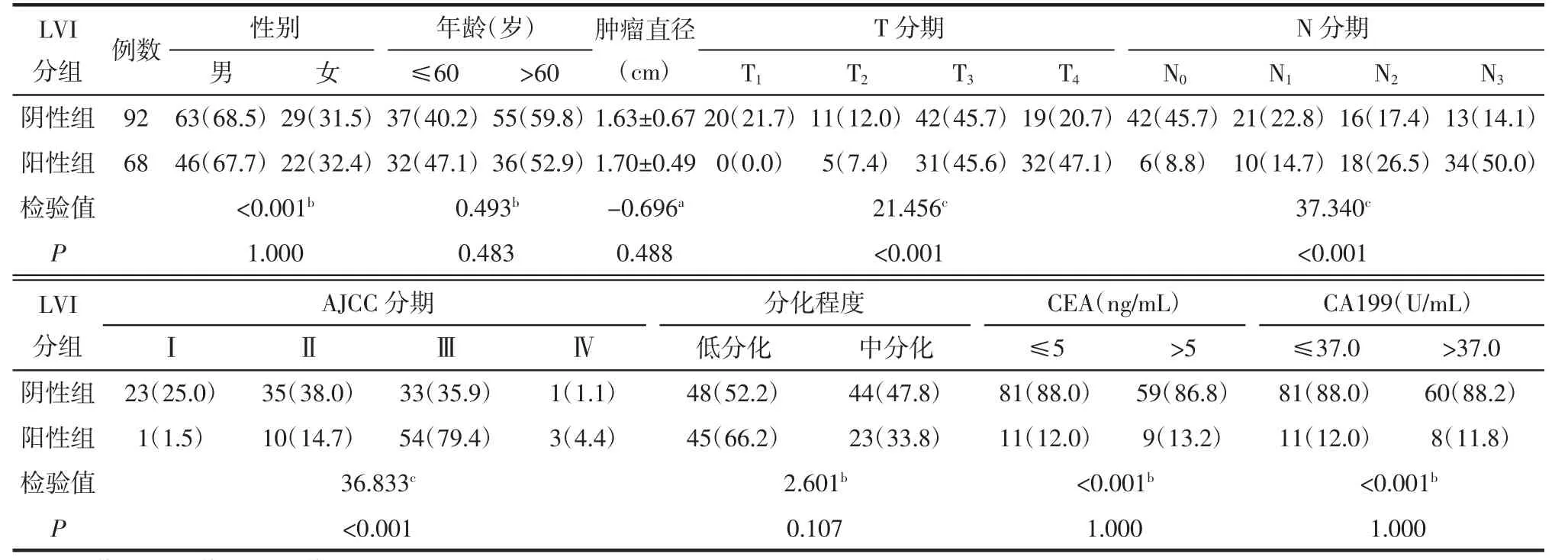
表1 LVI阳性与阴性组间临床病理特征比较 例(%)
2.2 LVI阳性与阴性组间影像组学评分比较 LVI阳性组的Radscore[0.2(-2.9,6.1)]高于阴性组[-0.2(-26.5,2.1)](Z=3.78,P<0.001)。
2.3 影像组学模型和联合模型的诊断效能比较 在测试集中,联合模型预测LVI的AUC值、准确度和特异度均高于影像组学模型,分别提高了大约8.2%、18.2%和21.9%(表2)。决策曲线分析显示应用联合模型的临床净获益优于影像组学模型(图1)。

图1 影像组学模型与临床影像联合模型的决策曲线

表2 影像组学模型及临床影像联合模型预测LVI的效能
2.4 联合模型的列线图和校准曲线分析 基于T分期、N分期、AJCC分期和Radscore构建联合模型的列线图,结果显示Radscore得分最高,其次是AJCC分期,最后是N分期和T分期(图2)。训练集和测试集的校准曲线均显示列线图的预测结果与真实结果具有较好的一致性(图3)。

图2 临床影像联合模型列线图。首先从评分标尺上找到T分期、N分期、AJCC分期和Radscore所对应的得分并累加得到总评分,然后在总评分标尺上找到总评分对应的预测概率标尺的值,该值即为该病人的预测概率。

图3 临床影像联合模型的校准曲线。A、B图分别为训练集和测试集。纵坐标为实际概率,横坐标为预测概率,实线越接近对角虚线说明模型预测的结果与实际结果的一致性就越好。
3 讨论
LVI是胃癌重要预后因子之一,阳性病人的预后明显差于阴性病人,且LVI的发生与肿瘤大小、分化程度、TNM分期密切相关[5-6]。本研究结果显示,LVI阳性组与阴性组间T分期、N分期和AJCC分期差异具有统计学意义,这与Chen等[2]研究结果相同。其原因是由于肿瘤T分期与浸润深度密切相关,通常T分期越晚,肿瘤浸润肌层深度越深,浆膜面破坏概率就越大,发生LVI概率也越高。另有研究[5-7]发现,淋巴结转移者的LVI发生率高于无淋巴结转移者;同样TMN分期越高的肿瘤发生LVI、淋巴转移风险亦高于TNM分期低者,表明淋巴结转移、TMN分期与LVI亦密切相关。因此,LVI的发生与肿瘤进展密切相关,肿瘤恶性程度越高,肌层浸润深度越深,临床分期就越晚,发生LVI的概率就越大。虽然本研究中LVI阳性组和阴性组间组织分化程度的差异无统计学意义,但仍显示低分化者的LVI发生率较中分化者高,这与低分化者恶性程度较中分化者高,进而导致LVI发生率增高有关。
与Ma等[5]采用动态增强CT定量及定性特征预测胃癌LVI研究不同,本研究尝试利用增强CT影像组学特征预测胃癌LVI,结果显示180个影像组学特征经过筛选后最终剩余4个特征,包括形态学特征参数(最大三维直径和面积体积比)、直方图特征参数(最大灰度值)和灰度游程矩阵特征参数(长游程低灰度补偿_angle135_offset1),基于上述特征建立的影像组学模型能够较好地预测LVI。最大三维直径与肿瘤直径相关,其越大提示肿瘤的直径就越大,进而发生LVI的风险就越高,这与Liu等[8]利用增强CT预测肝细胞癌微血管浸润中的研究结果一致。面积体积比是基于病灶形状的形态学特征,其值越小提示肿瘤形态越不规则,其侵袭性就越高,发生LVI的概率就越大。最大灰度值、长游程低灰度补偿是描述图像灰度分布均匀性的参数,数值跨度越大,图像中不同像素灰度分布更不均匀,进而提示肿瘤内部密度/信号越不均匀,瘤内异质性就越明显,这与Liu等[6]利用增强CT影像组学特征预测胃癌分化程度、分型和血管侵犯的研究结果相似,即异质性越明显的肿瘤,其侵袭性就越高,发生LVI的风险就越高。此外,LVI阳性组的Radscore高于阴性组也同时验证了Radscore越高的肿瘤,其异质性就越明显,这与Chen等[2]研究结果相同。
增强CT检查在胃癌的诊断、鉴别诊断及术前评估、术后随访中发挥着重要作用。本研究利用基于增强CT影像组学模型预测胃癌LVI,其结果显示该模型具有较好的预测胃癌LVI的价值,其在训练集和测试集中预测的AUC值分别为0.735、0.709,这与Zhao等[9]利用增强CT影像组学模型预测胃癌LVI的研究结果相似。由于单一参数预测效能相对较低,多参数联合将可能提高模型的预测效能、准确度和特异度[2,10-12]。因此,本研究在训练集中纳入临床特征T分期、N分期、AJCC分期后,临床影像联合模型预测LVI的AUC值、准确度和特异度较单纯影像组学模型分别提高了大约8.2%、18.2%和21.9%。此外,在联合模型的列线图中,Radscore得分最高,其相应预测LVI概率就越高,其次是AJCC分期,最后是N分期和T分期;另外,在训练集和测试集的校准曲线中,应用联合模型列线图预测LVI的结果与真实结果具有较好的一致性,且决策分析曲线显示应用联合模型的临床净获益优于单一的影像组学模型,上述结果与Chen等[2]利用联合临床特征和影像组学特征预测胃癌LVI的研究结果相符。
综上所述,联合T分期、N分期、AJCC分期和Rodscore构建的联合模型的列线图能够成功预测胃癌LVI。本研究尚存在一些不足:一是本研究为单中心研究,研究结果存在一定的局限性;二是未将增强CT定量、定性特征纳入研究,因此需要后续多中心研究进一步验证和细化。
