动态增强MRI影像组学模型术前预测乳腺癌前哨淋巴结转移
2021-12-08朱娅娣郁义星杨玲
朱娅娣 郁义星 杨玲
乳腺癌是全球女性癌症死亡的主要原因,其发病率逐年上升,每年大约新增170万例,严重威胁女性的身体健康及生活质量[1]。是否发生腋窝淋巴结转移对乳腺癌分期、治疗及病人预后有重要意义,也是术后放化疗的重要参考指标之一[2-3]。术前预测和明确腋窝淋巴结状态及分期,对于选择安全有效的治疗方法,减少术后并发症的发生至关重要[4]。目前临床上评估乳腺癌腋窝淋巴结转移多采用腋窝淋巴结清扫(axil lary lymph node dissection,ALN D)或前哨淋巴结活检术(sentinel lymph node biopsy,SLN B),但ALND可导致淋巴水肿、腋窝神经与ALND相比,损伤以及肩关节运动功能障碍等短期和长期并发症[5-6],降低病人的生活质量。SLNB是一种较ALND相对微创的方法,可用于评估淋巴结受累程度。前哨淋巴结(sentinel lymph node,SLN)作为淋巴结转移的第一站,当其未受累时其他淋巴结发生转移的可能性则很小,故SLNB已成为一项乳腺癌手术的推荐性操作。然而,由于放射性药物、注射及取材部位、操作人员的经验水平等不同,SLNB又被视为一项有争议的操作[7-8]。另有研究[9]显示,目前临床上SLNB的假阴性率较2005年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)指南中报道的SLNB假阴性率(<5%)大约增高了7%[10],因此临床上需要一种准确、高效和普适性的诊断方法来预测腋窝淋巴结转移。动态增强M RI(D CEMR I)软组织分辨力高,可清晰显示病灶的形态、内部结构、数量、强化方式以及瘤周浸润情况等,是检测乳腺癌的敏感方法。影像组学可以将数字医学图像转换为高维、可利用和定量提取的影像特征,这些特征可以表征肿瘤内异质性,通过提取定量特征对肿块进行全面分析,可为临床决策提供潜在的无创性生物标志物。因此,本研究尝试应用基于DCEMRI的影像组学模型对乳腺癌病人SLN转移(SLN metastasis,SLNM)进行术前预测,并比较支持向量机(support vector machine,SVM)、逻辑回归(Logistic regression,LR)及决策树3种机器学习模型的诊断效能,以期获得一种准确、无创且便利的术前预测SLN的方法。
1 资料与方法
1.1 一般资料 回顾性收集2015年1月—2020年11月在苏州大学附属第一医院经手术或活检病理证实的128例乳腺癌女性病人的临床、病理及MRI资料。病人年龄24~72岁,平均(45.94±10.08)岁。纳入标准:①术前接受DCE-MRI检查;②接受SLNB或ALND。排除标准:①既往有乳腺放疗、化疗或激素治疗史;②临床或病理资料不全;③影像质量差无法评估。依据SLN病理结果将病人划分为SLN阳性组61例,阴性组67例。
1.2 设备与方法 采用GE 750W 3.0 T超导MR扫描设备,乳腺专用8通道线圈。病人取俯卧位,双侧乳腺自然悬垂并适当固定于线圈中。横断面DCE-MRI扫描参数:TR 4.32 ms,TE 2.10 ms,层厚1.4 mm,层间距-0.7 mm(即内插0.7 mm),翻转角14°,矩阵512×512,视野(FOV)35 cm×35 cm。采用高压注射器经手背静脉团注对比剂钆喷酸葡胺(Gd-DTPA,浓度0.5 mmol/mL,拜耳公司),注射剂量0.2 mmol/kg体质量,流率2.6 mL/s;再以同样的流率注射15 mL生理盐水。动态增强扫描共扫描6个期相,第1期相为平扫;注射对比剂后开始增强扫描,共扫描5个期相。分析第2期相(61~122 s)影像数据。由于层间距为-0.7 mm,影像之间存在重叠,利用GE MR后处理工作站将病灶影像整体重建为层厚5 mm的影像。
1.3 临床病理特征及病理学评估标准 由2位具有10年以上工作经验的病理学专家独立分析病理结果,意见不一致时协商确定。分析病人年龄、组织学类型(浸润性导管癌和其他)、浸润性癌分级(根据Nottinham组织学分级评分[11]判定:Ⅰ级,低度恶性,3~5分;Ⅱ级,中度恶性,6~7分;Ⅲ级,高度恶性,8~9分)、分子亚型等临床和组织病理学资料。根据2013年St.Gallen国际乳腺会议[12],将乳腺癌分为4种不同的分子亚型:①Luminal A型:ER(+)和/或PR(+)、HER-2(-)、Ki-67<14%;②Luminal B型:HER-2(-)、ER(+)和/或PR(+)、Ki-67≥14%,HER-2(+)、ER(+)和/或PR(+)、任意状态的Ki-67;③HER-2过表达型:ER(-)、PR(-)、HER-2(+);④三阴型:ER(-)、PR(-)、HER-2(-)。
1.4 影像组学模型构建
1.4.1 靶区勾画 将第2期相原始DICOM图像导入后处理平台(达尔文科研平台,医准智能有限公司),然后由1名放射科主治医师于病灶所在层面沿病变边缘逐层手动勾画兴趣区(ROI),当病灶多发时选取最大病灶,勾画时尽量避开肿瘤坏死及瘤周水肿区域。待平台自动生成病灶的三维体积兴趣区(vol ume of interest,V OI),再由另1名放射科主任医师复核勾画结果。如存在意见不同的靶区勾画部分,2人协商后确定。勾画结果如图1所示。
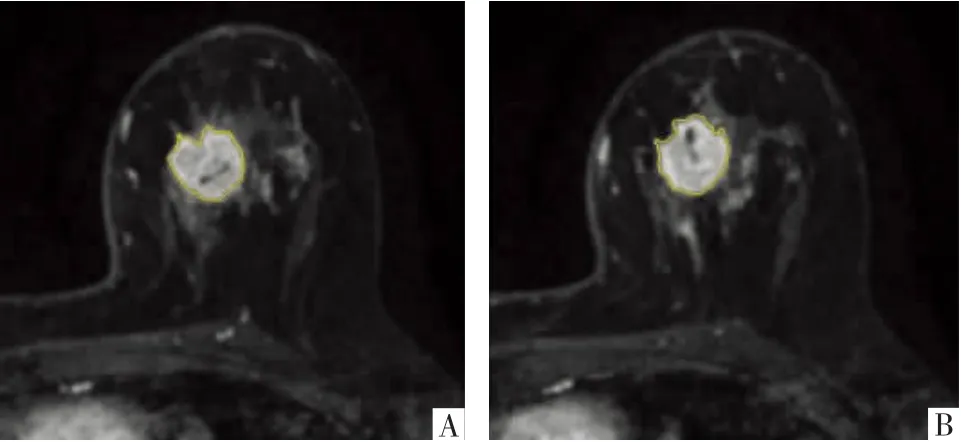
图1 病人女,70岁,浸润性导管癌Ⅲ级。A、B图分别为DCE-MRI第2期相横断面影像上不同层面靶区勾画示例。
1.4.2 特征提取及数据预处理 由平台自动提取VOI上的影像组学特征,共计提取1 316个特征,包括一阶统计特征、形状特征及纹理特征等。采用最大最小值归一化算法将所提取的1 316个特征的数值线性拉伸到[0,1]的区间内,对特征进行归一化处理。
1.4.3 特征筛选 采用最优特征筛选器,通过对多变量中的每一个特征变量进行方差分析,计算每个特征的F值,从大到小排序后,决定出与类别标签最相关的特征,最终从原始特征中筛选出10%最相关特征,共132个;然后采用最小绝对值收敛和选择算子(least absolute shrinkage and selection operator,LASSO)算法-Logistic回归分析从上述特征中筛选出最优特征子集,最终得出与预测SLNM最相关的7个特征,分别为1个一阶统计特征(均匀性)、3个形状特征(球形度、最短轴线长度、面积体积比)和3个纹理特征(dependence non uniformity normalized、imc1、run entropy)
1.4.4 预测模型构建 应用SVM、LR及决策树3种机器学习算法对最优特征子集进行模型构建。采用随机分层抽样法,将128例病人按照7∶3的比例分为训练集(89例)和验证集(39例)。在训练集中进行机器学习模型训练,训练过程中对3种机器学习模型均使用10折交叉验证以避免过拟合,并采用人工少数类过采样法来避免数据不平衡,从而获得最佳模型性能,并在验证集中进行模型性能验证。
1.5 统计学方法 采用SPSS 26.0软件分析数据。符合正态分布的计量资料以均数±标准差(±s)表示,2组间比较采用独立样本t检验。计数资料以例表示,2组间比较采用χ2检验或Fisher确切概率检验。采用受试者操作特征(ROC)曲线评估模型在训练集和验证集中的预测效能,并计算曲线下面积(AUC)、准确度、敏感度及特异度。P<0.05为差异有统计学意义。
2 结果
2.1 SLN阳性组与SLN阴性组临床病理资料比较 2组间病人年龄、组织学类型、组织学分级及分子分型的差异均无统计学意义(均P>0.05),见表1。
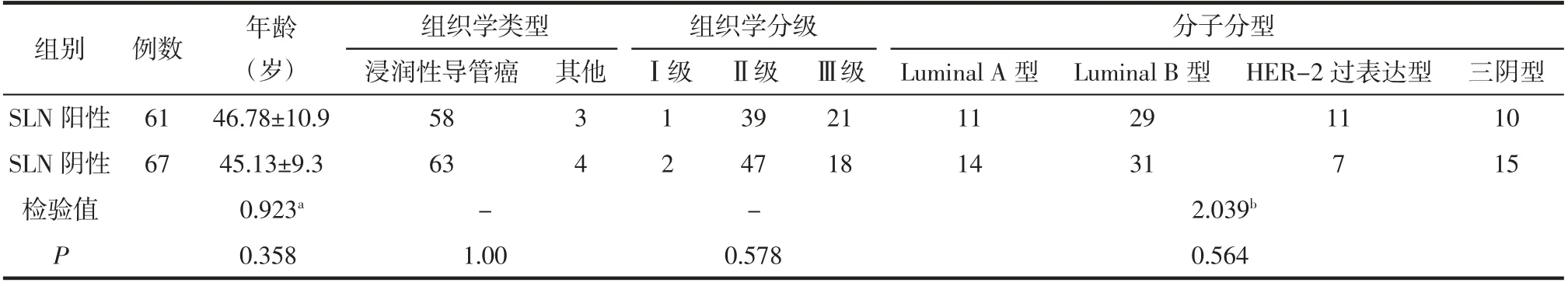
表1 SLN阳性组与SLN阴性组病人的临床病理资料比较 例
2.2 训练集与验证集临床病理资料比较 2组间病人年龄、淋巴结状态、组织学类型、组织学分级及分子分型的差异均无统计学意义(均P>0.05),见表2。

表2 训练集与验证集病人的临床病理资料比较 例
2.3 3种机器学习模型对SLNM的预测效能 3种机器学习模型中,决策树模型在训练集与验证集中的AUC均最高(分别为1.00和0.90),其次为LR模型和SVM模型;决策树模型在训练集与验证集中的敏感度也最高(分别为100.00%和89.50%);训练集中决策树模型的准确度最高(100.00%),其次为LR模型和SVM模型;验证集中3种模型的准确度相等(89.74%),详见表3。3种机器学习模型预测SLNM的ROC曲线见图2。

图2 3种机器学习模型预测SLN转移的ROC曲线。A图为训练集,B图为验证集。

表3 3种机器学习模型对SLN转移的预测效能
3 讨论
近年来,随着人工智能的飞速发展,影像组学在多项研究中显示了其对肿瘤分子表达、淋巴结转移以及疗效预测等方面的潜在效能[13-17]。影像组学通过提取高通量的定量特征,将医学图像转换为可分析的高维数据,随后对这些特征进行分析、建模以为临床决策提供潜在的无创性生物标志物。
本研究旨在通过影像组学模型预测术前SLNM,提供一个潜在的SLN状态的无创性生物标志物,用于指导乳腺癌进一步的治疗计划,帮助临床减少不必要的腋窝淋巴结清扫,避免过度SLN活检及相关的严重并发症。本研究进行了SLN阳性组和阴性组、训练集和验证集间的临床及病理资料的比较,结果显示SLN阳性组和阴性组间的年龄、组织学类型、组织学分级及分子分型等临床及病理资料差异均无统计学意义,可能是由于样本量较小的原因。通过随机分层抽样法将样本分至训练集和验证集,使2组内的SLN阳性样本及SLN阴性样本比例类似,组间的临床及病理资料差异也无统计学意义。SLN阳性组和SLN阴性组、训练集和验证集组间病人的临床和病理资料差异均无统计学意义,表明各临床和病理特征组间分布的均衡性,排除了上述的临床和病理资料在影像组学预测模型中的潜在干扰因素。最终应用最优影像组学特征子集共建立了SVM、LR和决策树3种机器学习模型用于乳腺癌SLNM的术前预测,其中决策树预测模型的诊断效能最优,训练集AUC高达1.00,验证集AUC高达0.90。以往Liu等[18]应用DCE-MRI提取的影像组学特征建立了SVM、LR和Xgboost 3种机器学习模型,其中SVM的预测效能最好,验证集AUC高达0.83。本研究验证集中SVM的AUC为0.84,与其结果相似。这一结果表明原发肿瘤DCE-MRI提取的影像组学特征与腋窝SLNM相关,可能反映了肿瘤的生物学行为。
影像组学特征通常难以被直观地解释和分析,但它们却能够反映肿瘤微环境的异质性和复杂性,以结果中筛选得出的特征为例,球形度是衡量肿瘤区域的圆度,值越大表明越接近一个完美的球体;dependence non uniformity normalized指测量整个图像相邻体素的相似度,值越低表明相邻体素之间的同质性越高;run entropy测量运行长度和灰度的随机性,值越高则肿块异质性越强。ime1是量化纹理的复杂性,值越高表明纹理越复杂;均匀性是对图像阵列均匀性的度量,值越大意味着均匀性越大[19]。虽然这些特征难以被肉眼所识别,但却能通过影像组学被充分利用,并为疾病的诊断和预测提供可观的信息。
有研究[20-21]表明,病人年龄、肿瘤大小、位置、淋巴管及血管侵犯、组织病理类型、组织分级等临床病理特征与SLNM相关,甚至可以成为独立的预测因子;与此同时,超声、钼靶、CT及MRI等影像学检查对乳腺癌SLNM的检查更为直观,起着不可替代的作用,其中MRI因其优越的时间及空间分辨力,已成为乳腺癌最常用的检查方法之一;然而,目前传统的影像医学对乳腺癌术前淋巴结转移状态常常难以进行精确评估。Zheng等[22]采用腋窝超声对584例乳腺癌病人腋窝淋巴结是否转移进行评估,其准确度、敏感度及特异度分别为0.635、0.721及0.573,诊断效能相对较低。为了探索更为精确的乳腺癌淋巴结转移预测方法,有研究者[23-24]应用影像组学特征联合临床病理特征进行了腋窝淋巴结转移的研究,其中Yu等[23]应用增强T1WI、T2WI及DWI-定量测量表观扩散系数成像(D WI-ADC)所筛选提取的影像组学特征,结合临床病理特征建立的临床-影像组学模型得到的AUC为0.90,相较于单纯的临床病理因素所建立的模型或传统影像评估,其预测效能大大提高,该研究使用了多序列联合建模,并加入了临床病理因素构建模型,方法较为复杂。本研究试图简化模型,鉴于DCE扫描时第2期相影像中病灶与背景的对比度最大,故仅以DCEMRI第2期相提取的影像组学特征进行建模,最终也得到了较高的预测能力,为临床提供一种简单而容易获得的预测模型。Dong等[25]结合T2WI抑脂和DWI序列的影像组学特征预测乳腺癌SLNM,验证集AUC为0.805,预测效能低于本研究的3种预测模型,从另一方面反映DCE影像可能较DWI及T2WI影像更利于提供肿瘤的微观信息,显示瘤内异质性。此外,还有研究者[26]结合了肿瘤内和瘤周区域的DCE-MRI特征来预测腋窝淋巴结转移,而腋窝淋巴结与原发肿瘤部位之间的肿瘤微环境存在着显著差异,故瘤周特征的应用仍需进一步的研究及验证。
本研究还存在一些局限性:①本研究为单中心的小样本回顾性研究,结果的稳健性和临床适用性需要进一步的验证;②肿瘤分割均为放射科医生手动勾画,可能存在一定的偏差。
综上所述,本研究建立的DCE-MRI的影像组学模型为术前预测SLNM提供了一种无创而简便的新方法,提供了潜在的无创性生物标志物。基于定量影像组学特征的预测模型有助于精准医疗,可帮助临床获得更准确的诊断和分期。
