基于MRI的机器学习模型预测PI-RADS 3病变的良恶性及侵袭性
2021-12-08李天平骆训容罗明芳张涵谢海柱王培源
李天平 骆训容 罗明芳 张涵 谢海柱 王培源
前列腺癌(prostate cancer,PCa)是中老年男性最常见的泌尿生殖系统肿瘤,在全球男性的肿瘤发病率及死亡率中位居前五[1]。2019年发布的前列腺影像报告数据系统2.1版(Prostate Imaging-Reporting and Data System version 2.1,PI-RADS v2.1)[2]将前列腺病变分为5类,其中PI-RADS 3前列腺病变包括良性病变以及侵袭性不同的恶性病变,但PI-RADS v2.1并未明确PI-RADS 3病变是否需要活检。有研究[3]在292例PI-RADS 3病人的穿刺活检结果中发现32%(92/292)为PCa,其中23%(69/292)为临床有意义PCa(clinically significant PCa,csPCa),提示并非所有病人都需要进行活检。因而,准确判断病变的良恶性,有助于减少病人非必要活检带来的痛苦。此外,PI-RADS 3病变会向恶性或更高级别的病变转变,随诊研究显示4%的病变可转为更高级别的肿瘤[4]。因此,明确肿瘤的侵袭性并及时检测和识别高级别肿瘤,进而对病人及时治疗,可延缓肿瘤进展,延长病人的生命。病理学Gleason评分(Gleason score,GS)是判断PCa侵袭性最主要的独立预测因素,PI-RADS v2.1将GS≥7(3+4)定义为csPCa,即侵袭性PCa;GS≤6定义为临床无意义PCa(clinically insignificant PCa,ci PCa),即非侵袭性PCa。
影像组学可对影像数据进行定量分析,从而无创性地评估肿瘤生物学行为,已经广泛应用于PCa的诊断、侵袭性评估及临床决策等方面[5]。影像组学方法用于PCa良恶性的诊断及GS评分已表现出良好的预测效能[6]。目前尚未见采用影像组学机器学习模型对PI-RADS 3前列腺病变的良恶性鉴别和侵袭性评估的研究,本研究拟探讨机器学习预测模型预测PI-RADS 3前列腺病变的良恶性及PCa侵袭性的预测价值。
1 资料与方法
1.1 研究对象 回顾性分析2015年1月—2020年7月于烟台毓璜顶医院进行前列腺MRI扫描的296例PI-RADS 3病人资料,年龄47~91岁,平均(70.44±7.68)岁。其中,PCa病人141例,非PCa病人155例。纳入标准:①进行前列腺3.0 T MRI检查后的2个月内完成手术治疗或行MR-超声融合靶向穿刺活检;②经放射科医生诊断为PI-RADS 3病变;③MRI上可见单一病灶。排除标准:①既往有前列腺手术、穿刺、放化疗或内分泌治疗史;②影像信息不全,影像质量差无法进行评估者;③病变较小(体积<0.5 cm3)或无法确定病变边界者。记录病人的病理结果、血清前列腺特异性抗原(prostate specific antigen,PSA)浓度。根据GS评分判断病灶的侵袭性,将PCa病人分为csPCa[GS≥7(3+4)]和ciPCa(GS<7)。
1.2 设备与方法 采用GE 750W 3.0 T MR扫描设备,8通道相阵控腹部线圈,扫描范围从骶髂关节至耻骨联合水平。扫描序列及参数:①T2WI抑脂序列,FOV 200 mm×200 mm,TR 3 500 ms,TE 90 ms,矩阵240×220,层厚为3 mm,层间距为0;②DCE-T1WI序列,TR 4.0 ms,TE 1.5 ms,经肘静脉注射钆螯合物对比剂(钆双胺,浓度0.5 mmol/mL,GE Healthcare,Ireland)0.1 mmol/kg体质量,注射流率3.0 mL/s,共扫描15个时相;③DWI序列,FOV 220 mm×220 mm,矩阵128×130,b值为0、100、800、1 000 s/mm2。
1.3 病灶勾画与特征提取 由2名不知晓病理和临床检验结果的放射科医师(分别具有5年和10年腹部MRI诊断经验)使用3D Slicer(Version 4.10.0)软件中的“Segment Editor”模块分别在T2WI、DCET1WI、DWI横断面影像上逐层手动勾画病变的兴趣区(ROI),尽可能大地包括病变区域,避开病变边缘、囊变、尿道、射精管及钙化的区域(图1)。DCE序列选择第1时相影像,DWI选择b值为1 000 s/mm2的影像。在3D Slicer的“Radiomics”模块中对ROI进行特征提取,自动提取出灰度相关矩阵、灰度共生矩阵、形状、一阶、灰度游程长度矩阵、灰度大小区域矩阵、邻域灰度差异矩阵及小波共8类影像组学特征。其中,随机选择30例病人的病灶来评估病灶勾画的稳定性。由上述2名医师分别勾画ROI并分析提取的特征值,随后由其中的有5年工作经验的医师间隔1周再次进行勾画及特征提取。记录以上前后2次提取的特征值,计算观察者内和观察者间的组内相关系数(intra-class correlation coefficients,ICC)。ICC>0.75则认为可重复性较好;若存在ICC≤0.75的特征,则剔除所有病灶中提取的该类特征。

图1 PI-RADS 3病变ROI勾画示意图。A图为T2WI横断面影像;B图为DWI横断面影像;C图为DCE-T1WI横断面影像。
1.4 特征筛选及模型构建 采用Python(Version 3.9.0)软件进行特征筛选及模型构建。将296个病灶按7∶3的比例随机划分为训练集(70%,207个)和独立验证集(30%,89个)。对训练集数据采用t检验进行特征筛选,选取特征标签间差异具有统计学意义的特征;然后采用适合高维数据的最小绝对值收敛和选择算子(least absolute shrinkage and selection operator,LASSO)算法对特征进一步筛选,挑选出系数不为零的特征。使用支持向量机(support vector machine,SVM)算法构建机器学习模型,使用10折交叉验证法确定模型的最佳核函数及超参数。在PCa的侵袭性预测中,模型的预测效能会受到训练集数据分类不平衡的影响,所以采用合成少数类过采样技术(synthetic minority oversampling technique,SMOTE)对训练集数据进行分类平衡。为评估模型的鲁棒性,采用Bootstrap方法分别在训练集及验证集中进行1 000次有放回抽样,每次抽取500个样本,计算模型在训练集及独立验证集的置信区间。
1.5 统计学方法 采用Python(Version 3.9.0)软件进行数据分析。计数资料以例表示。符合正态分布的计量资料采用均数±标准差()表示,组间比较采用t检验。非正态分布的计量资料采用中位数(四分位间距)[M(P25,P75)]表示,组间比较采用Mann-Whitney U检验。采用受试者操作特征(ROC)曲线分析评价模型在训练组和验证组中的预测效能,并计算曲线下面积(AUC)、准确度、敏感度及特异度。P<0.05为差异有统计学意义。
2 结果
2.1 病人一般资料分析 PCa病人的平均年龄[(71.57±8.04)岁]高于非PCa病人[(69.41±7.21)岁](t=2.44,P=0.015),PSA水平[18.63(11.95,35.8)ng/mL]也高于非PCa病人[10.28(5.77,17.76)ng/mL](Z=6 673.5,P<0.001)。141例PCa病人中有csPCa 100例。其PSA水平为[22.06(12.42,39.64)ng/mL]且高于41例ciPCa病人[12.77(8.46,23.97)ng/mL](Z=1 479.5,P=0.004)。
2.2 病灶特征提取与筛选 共分析296个病灶,每个病灶均提取2 553个特征(每个序列上的ROI均提取851个特征)。观察者间(ICC为0.81)和观察者内(ICC为0.84)均具有很好的一致性。对全部PIRADS 3病变进行良恶性鉴别,经t检验筛选后剩余313个特征,经LASSO回归模型最终筛选出14个特征(9个来自DWI,3个来自T2WI,2个来自DCE)(图2)。对141个PI-RADS 3病变进行PCa侵袭性预测,经t检验筛选出106个特征,经LASSO回归模型最终筛选出12个特征(4个来自T2WI,5个来自DWI,3个来自DCE)(图3)。

图2 预测PI-RADS 3病变良恶性的特征筛选。A图为LASSO回归模型中,最佳参数λ(黑色垂直线)对应的特征系数;B图为筛选出的14个特征及其所对应的系数。
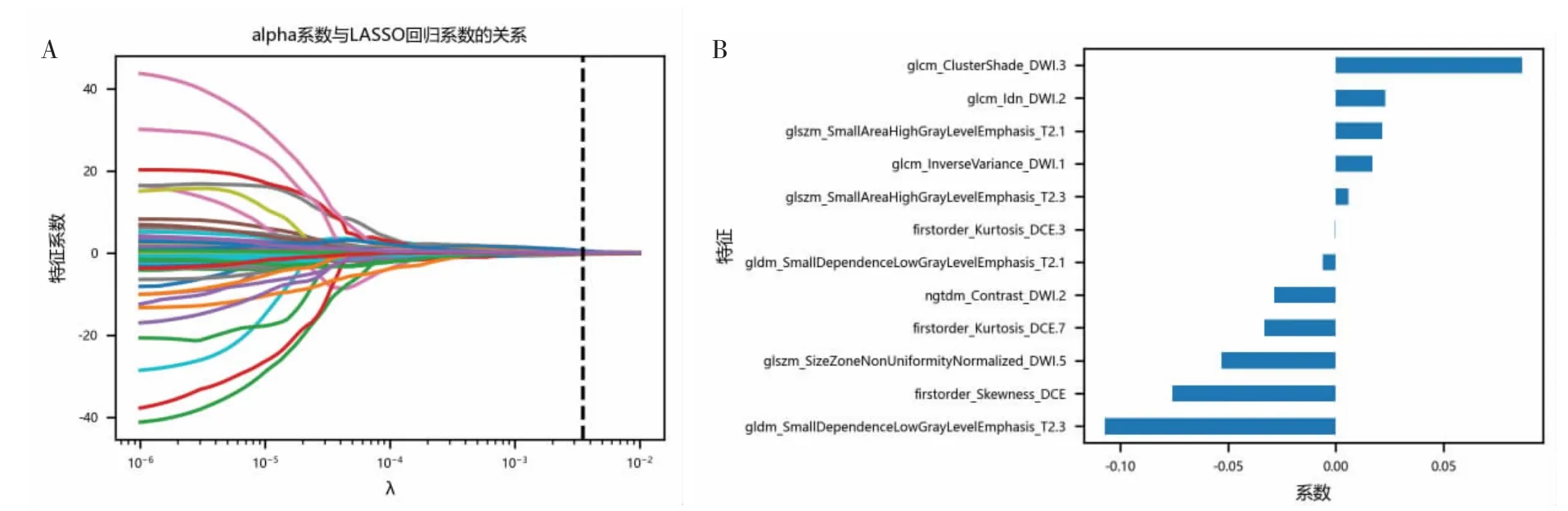
图3 预测PI-RADS 3 PCa侵袭性的特征筛选。A图为LASSO回归模型中,最佳参数λ(垂直黑线)对应的特征系
2.3 机器学习模型预测效能评估 在良恶性预测中,训练集中共207个病灶(104个为PCa,103个为非PCa),验证集中共89个病灶(37个为PCa,52个为非PCa)。在侵袭性预测中,训练集中共98个病灶(67个为csPCa,31个为ciPCa),验证集中共43个病灶(33个为csPCa,10个为ciPCa)。机器学习模型在训练集及验证集对PI-RADS 3病变的良恶性鉴别和侵袭性预测中均表现出较好的诊断效能(表1,图4、5)。在良恶性的鉴别中,训练集和验证集中的AUC分别为0.93(95%CI:0.91~0.95)、0.89(95%CI:0.86~0.92);在侵袭性预测中,训练集和验证集中的AUC分别为0.92(95%CI:0.89~0.94)、0.85(95%CI:0.81~0.89)。

图4 机器学习模型预测PI-RADS 3病变良恶性的ROC曲线

表1 2个数据集基于机器学习模型对PI-RADS 3病变的良恶性鉴别和侵袭性预测效能
3 讨论
影像组学利用高通量方法对肿瘤影像内的信息进行定量、定性分析,从而无创性地评估肿瘤异质性[7]。本研究采用影像组学机器学习方法对PIRADS 3前列腺病变的MRI影像进行定量分析,实现病变良恶性及侵袭性的预测分析,可为该类前列腺病变病人的诊断提供一种新的方法,为临床治疗、管理提供指导意见。
本研究发现,PCa组的年龄和PSA水平明显高于非PCa,且GS评分高的PCa的PSA水平较高,提示年龄较大和高PSA水平的人群宜进行MRI检查明确诊断。在本研究中,为减小穿刺活检空间采样误差,提高PCa的检出率及确保穿刺病灶与ROI的一一对应,本研究采用前列腺MR-超声融合靶向活检作为穿刺活检结果。
在PI-RADS 3病变的PCa侵袭性预测中,由于训练集中csPCa与ciPCa分类不平衡,将会影响训练模型的预测效能,使模型预测结果更偏向于多数类。本研究使用SMOTE算法对训练集中的数据进行分类平衡,该算法旨在对少数类样本进行分析和模拟,并将人工模拟的新样本添加到数据集中,进而使原始数据中的分类不再严重失衡。Fehr等[8]比较了使用与不使用样本扩增方法及使用不同样本扩增方法后的预测模型的表现,结果发现使用SMOTE样本扩增方法后模型的预测效能最高。
本研究中影像组学的特征筛选采用t检验和LASSO算法,此方法可以快速剔除冗余的特征,降低模型的计算复杂程度,避免模型过度拟合[9-10]。本研究结果发现,筛选后特征中基于DWI序列的特征占比最大,与Litjens等[11]的研究结果一致。原因可能为肿瘤组织内的细胞数目较密集、体积较大、排列紧密等特点,且高级别肿瘤细胞异型性大、排列杂乱,而DWI能敏感地检测出这些变化[12]。Bonekama等[13]发现ADC能够提高前列腺良恶性病变的鉴别效率,且ADC对于csPCa的评估比PIRADS更准确。本研究未能探究ADC在PCa诊断中的作用,有待将来纳入ADC以进一步研究。

图5 机器学习模型预测PI-RADS 3 PCa侵袭性的ROC曲线
本研究构建的机器学习模型对PI-RADS 3前列腺病变的良恶性(训练集AUC:0.93,验证集AUC:0.89)及侵袭性预测(训练集AUC:0.92,验证集AUC:0.85)中取得良好的诊断效能。Sidhu等[14]通过联合ADC峰度特征与DCE-T1WI熵特征对移行带PCa进行预测,其在测试集中的预测效能(AUC=0.86)低于本研究(AUC=0.89),可能是由于该研究将整个前列腺移行带的特征进行分析,其中一些冗余的特征降低了模型的诊断效能。Li等[15]构建的基于T2WI、ADC的MRI影像组学模型能够提高csPCa的诊断,其在验证集中的效能(AUC=0.98)高于本研究(AUC=0.85),其原因可能是Li等的研究纳入了ADC和临床风险因子。Chen等[16]也构建了影像组学模型,在对PCa的鉴别和侵袭性评估中发现,影像组学模型较PI-RADS v2评估具有更好的预测效能;在PCa的鉴别中,模型在验证集中AUC为0.999,评估侵袭性的AUC为0.93。本研究中的效果较其略低,可能是本研究只对PI-RADS 3类的病变进行分析。另外,Nketiah等[17]将T2WI提取的纹理特征、定量ADC值和DCE药代动力学参数联合,用于预测PCa的GS分级,其预测效能(AUC=0.91)与本研究(AUC=0.92)相当,但其纳入的病人数量(23例)较小,且没有独立验证集。
本研究存在以下局限性:①使用了手动分割方法对病变进行分割,尽管观察者内与观察者间ICC较高,但分割结果可能仍存在一定的主观偏差。②研究中的部分病理结果是基于穿刺活检,尽管采用了前列腺MR-超声融合靶向活检以减少采样误差,但仍可能与前列腺全切结果存在偏差。③样本量较小,且为单中心回顾性研究,故需进行多中心前瞻性研究进行验证。
综上所述,本研究构建的机器学习预测模型能对PI-RADS 3前列腺病变进行无创性地评估,能够有效地预测其良恶性及侵袭性。
