柔肝化纤颗粒联合骨髓间充质干细胞移植术治疗肝硬化失代偿期的临床疗效及其对血清炎性因子水平和免疫功能及氧化应激反应的影响
2021-12-07吕艳杭吴姗姗王振常叶学劲符燕青段桂姣苏晓文农小欣
吕艳杭,吴姗姗,王振常,叶学劲,符燕青,段桂姣,苏晓文,农小欣
肝硬化指由一种或多种病因长期、反复刺激肝脏而造成的肝弥漫性损伤,肝硬化进展至一定程度、超出肝脏代偿能力时称之为肝硬化失代偿期。肝硬化失代偿期主要临床表现为肝功能减退和门静脉高压,发病率和致死率极高[1]。原位肝移植(OLT)是肝硬化失代偿期等终末期肝病的理想治疗方法,但由于肝脏供体紧缺、费用高、免疫排斥反应高等限制了其在临床上的广泛应用[2-3]。骨髓间充质干细胞(BMSCs)是一种多功能干细胞,可在体内分化为正常肝细胞及胆管上皮细胞,并可通过分泌多种促进肝脏生长的因子而逆转肝纤维化或肝硬化进程[4-6]。
研究表明,炎性因子在肝硬化发生和发展过程中具有重要作用,肿瘤坏死因子α(TNF-α)、干扰素γ(IFN-γ)、白介素(IL)-2、IL-10、IL-12等参与肝脏炎症的发展,而促炎/抗炎因子失衡可加速肝硬化进程[7-9];Th1/Th2失衡也与肝纤维化、肝硬化有关[10],其中Th1类细胞因子可抑制胶原蛋白合成及肝星状细胞增殖,而Th2类细胞因子可促进胶原蛋白合成及肝星状细胞增殖并抑制二者降解,进而导致细胞外基质沉积及纤维化[11];氧化应激反应过程中形成的氧自由基可参与肝星状细胞由上皮型转化为间质型,引起机体氧化/抗氧化系统失衡,加快肝纤维化进展为肝硬化的速度[12]。本研究旨在探讨柔肝化纤颗粒联合BMSCs移植术治疗肝硬化失代偿期的临床疗效及其对血清炎性因子水平、免疫功能、氧化应激反应的影响。
1 资料与方法
1.1 一般资料 选取广西中医药大学第一附属医院肝病区及广西国际壮医医院脾胃肝病区2016年5月—2019年5月收治的肝硬化失代偿期患者120例,采用随机数字表法分为A组、B组和C组,每组40例。A组中男28例,女12例;年龄32~65岁,平均年龄(56.7±5.3)岁;病程6~13年,平均病程(9.2±3.2)年。B组中男26例,女14例;年龄34~68岁,平均年龄(58.4±5.3)岁;病程7~11年,平均病程(9.0±4.2)年。C组中男29例,女11例;年龄35~67岁,平均年龄(58.5±5.6)岁;病程7~12年,平均病程(9.2±3.6)年。三组患者性别(χ2=1.43,P=0.26)、年龄(F=1.26,P=0.35)、病程(F=0.96,P=0.58)比较,差异无统计学意义,具有可比性。本研究经广西中医药大学第一附属医院和广西国际壮医医院医学伦理委员会审核批准,所有患者签署知情同意书。
1.2 诊断标准 肝硬化失代偿期西医诊断标准参照2015年《慢性乙型肝炎防治指南》[13]:(1)影像学、实验室检查结果提示肝细胞合成障碍、门静脉高压、脾大及食管-胃底静脉曲张等;(2)临床表现为蜘蛛痣、肝掌、腹腔积液、黄疸、男性乳房发育甚至肝性脑病等。肝硬化失代偿期中医诊断标准参照《中药新药临床研究指导原则》中鼓胀、黄疸的诊断标准,主症为腹部胀满、皮肤紧绷,甚至腹大如鼓,扣之有鼓音伴移动性浊音、纳差、神疲乏力、胁痛及便溏等[14]。
1.3 纳入与排除标准 纳入标准:符合肝硬化失代偿期的中、西医诊断标准。排除标准:(1)原发性或转移性肝癌;(2)临床资料不完整;(3)对造影剂过敏;(4)慢性肾功能不全(血肌酐>300 μmol/L);(5)妊娠或哺乳期女性;(6)严重心血管、肺、肾、脑疾病,内分泌、造血系统等疾病,精神疾病。
1.4 剔除与脱落标准 剔除标准:(1)不符合纳入与排除标准;(2)因临床资料不完整而影响研究结果;(3)因研究数据不全而不能判断临床疗效。脱落标准:(1)患者中途退出研究;(2)不按照规定进行治疗;(3)未完成整个临床试验。中止试验是指临床试验尚未按预定方案完成但由于出现严重并发症等中止或停止全部试验。
1.5 治疗方法
1.5.1 A组 A组患者采用内科综合治疗,具体如下:(1)一般支持治疗:卧床休息,减少体力消耗,减轻肝脏负担,高蛋白、低脂肪、适量糖类饮食(进食不足者可通过静脉通路补充热量及维生素),补充白蛋白或新鲜血浆以纠正低白蛋白血症,并酌情补充凝血因子,注意纠正水、电解质紊乱及消毒隔离,加强口腔护理,预防院内感染。(2)针对病毒复制活跃期患者,可考虑给予抗病毒治疗;采用乳果糖酸化肠道以减少肠道细菌异位;采用抗氧化剂还原型谷胱甘肽等进行保肝治疗;行促进肝细胞生长治疗以减少肝细胞坏死、促进肝细胞再生;行免疫调节治疗以调节肝衰竭患者免疫功能、减少感染等并发症的发生,可酌情使用胸腺素α1等免疫调节剂。(3)防治肝性脑病、脑细胞水肿、肝肾综合征等并发症。经内科综合治疗无效者需尽早考虑人工肝支持治疗甚至肝脏移植。
1.5.2 B组 B组患者在内科综合治疗基础上进行1次BMSCs移植术,术后给予抗病毒治疗1年。BMSCs移植方案:(1)移植前骨髓动员:动员剂为重组人粒细胞集落刺激因子注射液(商品名:欣粒生,厦门特宝生物工程股份有限公司生产,国药准字S19990040),剂量为150 mg/次,使用频率为1次/d,疗程为5 d。注意每次使用动员剂前常规复查血常规和凝血功能,白细胞计数≤20×109/L且凝血功能无明显异常者继续使用;白细胞计数>20×109/L或凝血功能明显异常者则暂停使用,隔日复查后根据情况继续应用动员剂。(2)BMSCs的制备:在百级洁净手术室环境下,严格按照外科无菌操作要求对患者进行局部麻醉、消毒,之后通过穿刺患者髂骨抽取抗凝骨髓血约200 ml,采用细胞分离试剂盒(宁夏中联达生物有限公司生产,生产批号:160920)、负收集混合法分离BMSCs,并抽取适量标本送检验科进行合格性检验;最后采用0.9%氯化钠溶液调节细胞密度并在37 ℃恒温条件下保存于无菌瓶内,4 h内行BMSCs移植术。(3)BMSCs的鉴定:采用流式细胞仪检测细胞表面抗原并进行鉴别,以从成人骨髓中分离培养的BMSCs稳定表达CD73、CD105、CD166而不表达CD34、CD45为合格BMSCs。(4)BMSCs移植术主要操作步骤:术前常规备皮、禁食6 h,在数字减影血管造影(DSA)引导、局部麻醉下采用Seldinger技术穿刺右侧股动脉并置入5 F动脉鞘,引入5 F RH肝动脉导管并置于肝固有动脉;结合DSA显示的血管分布情况在肝内局部缓慢注入分离好的BMSCs悬液,注入完毕后拔出动脉鞘,加压包扎穿刺部位,嘱患者卧床休息24 h并进行常规对症处理。
本研究背景:
肝硬化是严重危害人们健康的重大疾病之一,而其治疗仍是目前医学界难题之一。骨髓间充质干细胞(BMSCs)移植术为肝硬化患者带来了希望,但BMSCs在骨髓中含量极少且归巢能力有限,导致其临床应用受限。采用中医药招募内源性干细胞的动员方案可促进BMSCs归巢肝脏,对充分发挥中医药维持或改善机体正常再生修复作用具有重要意义。
本研究创新点:
国际上对干细胞的研究多着眼于移植和克隆,而通过药物激活内源性干细胞从而改善再生反应与从外部植入干细胞是全然不同的新思路。在移植干细胞数量不足以恢复肝功能且内源性干细胞自身遭破坏、修复能力有限的情况下,采用中医药招募内源性干细胞的动员方案虽不能替代干细胞移植,但可以促进BMSCs、体内干细胞归巢肝脏并分化为肝细胞,从而使残留肝细胞群扩展至足够数量并提高其质量。
本研究价值:
本研究采用先进的实验研究技术系统地从促BMSCs修复受损肝脏、促进肝功能恢复、改善机体免疫功能、调节炎性因子及氧化应激反应等方面探讨了中医药联合 BMSCs移植术对肝硬化失代偿期的协同增效作用,并用现代化语言阐释了名老中医学术理论,同时重视利用中医药调控机体再生修复机制以减少或防止机体再生病变、减少对移植干细胞数量的需求及培养扩增等繁琐操作,为干细胞动员提供了新的思路。
1.5.3 C组 C组患者在内科综合治疗基础上采用柔肝化纤颗粒联合BMSCs移植术,即在内科综合治疗基础上进行1次BMSCs移植术,术后长期抗病毒治疗同时给予柔肝化纤颗粒治疗。柔肝化纤颗粒由黄芪45 g、牡蛎30 g、黄精20 g、枸杞20 g、薏苡仁45 g、橘红10 g、泽兰30 g、鸡内金15 g、鳖甲30 g、虎杖20 g、丹皮12 g、黑枣15 g组成,中药材购自江苏天阴天江药业有限公司,由广西中医药大学附属国际壮医医院药学部严格按照1 g:6 g比例进行颗粒配方;服用方法:药品制成颗粒后装袋(49 g/袋),温开水冲服,1袋/次,早、中、晚各1次,合1剂/d;疗程为1年。
1.6 观察指标
1.6.1 临床疗效 比较三组患者临床疗效。临床疗效判定标准:治疗后患者临床症状明显改善,体征消失或明显减轻,肝功能指标和凝血酶原时间(PT)均恢复正常为显效;治疗后患者临床症状和体征好转或无明显改善,肝功能指标和PT较治疗前下降>50%为有效;治疗后患者临床症状和体征无明显改善或出现加重,肝功能指标和PT较治疗前下降≤50%或病情出现恶化为无效。
1.6.2 主要中医证候评分 比较三组患者治疗前后主要中医证候评分,包括胁痛、纳差、神疲乏力、黄疸,分别按照无、轻、中、重计 0、1、2、3 分[14]。
1.6.3 肝功能指标及PT 分别于治疗前后采集三组患者清晨空腹外周静脉血5 ml并置于抗凝管,采用低温冷冻离心机(上海卢湘仪离心机仪器有限公司生产,TD4)以3 000 r/min的速率在室温条件下离心10 min,离心半径为30 cm;取上清液,采用Olympus-Au640型全自动生化仪检测肝功能指标,包括丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBiL);采用STAGO血凝仪检测PT。
1.6.4 血清炎性因子水平 分别于治疗前后采集三组患者清晨空腹外周静脉血5 ml并置于抗凝管,如上离心后取上清液,采用酶联免疫吸附试验(ELLSA)检测TNF-α、IFN-γ、IL-2、IL-10、IL-12水平,试剂盒均购自上海拜力生物科技有限公司(生产批号分别为20170721、20171113、20180408、20181006)。
1.6.5 体液及细胞免疫功能指标 分别于治疗前后采集三组患者清晨空腹外周静脉血5 ml并置于抗凝管,如上离心后取上清液,采用免疫比浊法检测血清免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白G(IgG)、免疫球蛋白E(IgE)水平,试剂盒购自艾森生物杭州有限公司(生产批号分别为181121、181009、180206、170820);采用流式细胞仪检测T淋巴细胞亚群,包括CD3+、CD4+、CD8+细胞分数及CD4+/CD8+细胞比值。
1.6.6 氧化应激反应指标 分别于治疗前后采集三组患者清晨空腹外周静脉血5 ml并置于抗凝管,如上离心后取上清液,严格按照试剂盒说明书要求、采用ELLSA测定血清超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)水平,试剂盒购自上海拜力生物科技有限公司(生产批号分别为20170918、20181206、20170324)。
1.6.7 不良反应和/或并发症发生情况 记录患者三组患者治疗期间不良反应和/或并发症发生情况。
1.7 统计学方法 采用SPSS 21.0统计学软件进行数据分析。符合正态分布的计量资料以(±s)表示,三组间比较采用单因素方差分析,两两比较采用q检验,组内治疗前后比较采用配对t检验;计数资料以相对数表示,组间比较采用χ2检验;等级资料分析采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效 治疗期间A组2例患者脱落,B组1例患者脱落,最终A组、B组分别纳入38、39例患者。三组患者临床疗效比较,差异有统计学意义(H=11.59,P=0.021);C组患者临床疗效优于A组(u=11.43,P=0.003)、B组(u=4.92,P=0.045),差异有统计学意义(见表1)。
2.2 主要中医证候评分 三组患者治疗前胁痛、纳差、神疲乏力、黄疸评分比较,差异无统计学意义(P>0.05)。三组患者治疗后胁痛、纳差、神疲乏力、黄疸评分比较,差异有统计学意义(P<0.05);C组患者治疗后胁痛、纳差、神疲乏力、黄疸评分低于A组、B组,B组患者治疗后胁痛、纳差、神疲乏力、黄疸评分低于A组,差异有统计学意义(P<0.05,见表2)。
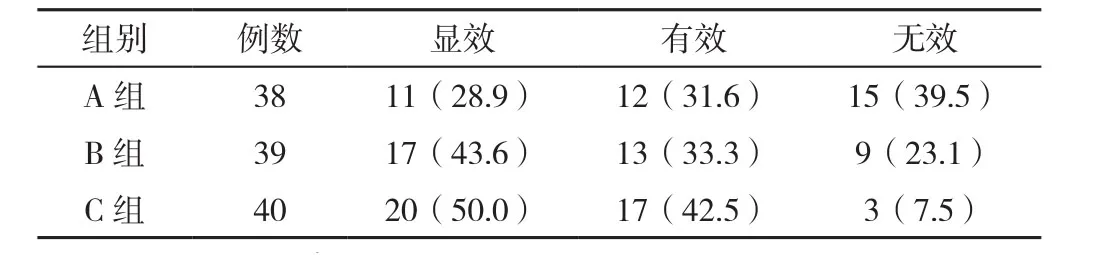
表1 三组患者临床疗效比较〔n(%)〕Table 1 Comparison of clinical responses in the three groups
2.3 肝功能指标及PT 三组患者治疗前血清ALT、AST、TBiL水平及PT比较,差异无统计学意义(P>0.05)。三组患者治疗后血清ALT、AST、TBiL水平及PT比较,差异有统计学意义(P<0.05);C组患者治疗后血清ALT、AST、TBiL水平低于A组、B组,PT短于A组、B组,差异有统计学意义(P<0.05);B组患者治疗后血清ALT、AST、TBiL水平低于A组,PT短于A组,差异有统计学意义(P<0.05,见表3)。
2.4 血清炎性因子水平 三组治疗前血清TNF-α、IFN-γ、IL-2、IL-10、IL-12水平比较,差异无统计学意义(P>0.05)。三组患者治疗后血清TNF-α、IFN-γ、IL-2、IL-10、IL-12水平比较,差异有统计学意义(P<0.05);C组患者治疗后血清TNF-α、IL-2、IL-12水平低于A组、B组,血清IFN-γ、IL-10水平高于A组、B组,差异有统计学意义(P<0.05);B组患者治疗后血清TNF-α、IL-2、IL-12水平低于A组,血清IFN-γ、IL-10水平高于A组,差异有统计学意义(P<0.05,见表4)。
2.5 体液及细胞免疫指标 三组患者治疗前血清IgA、IgM、IgG、IgE水平和CD3+、CD4+、CD8+细胞分数及CD4+/CD8+细胞比值比较,差异无统计学意义(P>0.05)。三组患者治疗后血清IgA、IgM、IgG、IgE水平和CD3+、CD4+、CD8+细胞分数及CD4+/CD8+细胞比值比较,差异有统计学意义(P<0.05);C组患者治疗后血清IgA、IgM水平和CD3+、CD4+细胞分数及CD4+/CD8+细胞比值高于A组、B组,血清IgG、IgE水平和CD8+细胞分数低于A组、B组,差异有统计学意义(P<0.05);B组患者治疗后血清IgA、IgM水平和CD3+、CD4+细胞分数及CD4+/CD8+细胞比值高于A组,血清IgG、IgE水平和CD8+细胞分数低于A组,差异有统计学意义(P<0.05,见表5)。
2.6 氧化应激反应指标 三组患者治疗前血清SOD、MDA、GSH-Px水平比较,差异无统计学意义(P>0.05)。三组患者治疗后血清SOD、MDA、GSH-Px水平比较,差异有统计学意义(P<0.05);C组患者治疗后血清SOD、GSH-Px水平高于A组、B组,血清MDA水平低于A组、B组,差异有统计学意义(P<0.05);B组患者治疗后血清SOD、GSH-Px水平高于A组,血清MDA水平低于A组,差异有统计学意义(P<0.05,见表6)。
表2 三组患者治疗前后主要中医证候评分比较(±s,分)Table 2 Comparison of mean scores of major TCM syndromes in the three groups before and after treatment

表2 三组患者治疗前后主要中医证候评分比较(±s,分)Table 2 Comparison of mean scores of major TCM syndromes in the three groups before and after treatment
注:与治疗前比较,aP<0.05;与A组比较,bP<0.05;与B组比较,cP<0.05
组别 例数 胁痛 纳差 神疲乏力 黄疸治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后A 组 38 2.3±0.2 1.4±0.1a 2.2±0.1 1.3±0.2a 2.0±0.2 1.1±0.1a 2.4±0.2 1.3±0.2a B 组 39 2.3±0.1 0.9±0.1ab 2.2±0.1 0.9±0.1ab 2.0±0.1 0.8±0.1ab 2.3±0.2 0.9±0.1ab C 组 40 2.3±0.2 0.5±0.1abc 2.1±0.1 0.5±0.1abc 2.0±0.2 0.5±0.1abc 2.4±0.2 0.5±0.1abc F值 1.50 29.30 1.00 58.30 0.51 31.40 0.40 46.20 P值 0.20 <0.01 0.40 <0.01 0.95 <0.01 0.68 <0.01
表3 三组患者治疗前后肝功能指标及PT比较(±s)Table 3 Comparison of mean levels of liver function markers and prothrombin time in the three groups before and after treatment
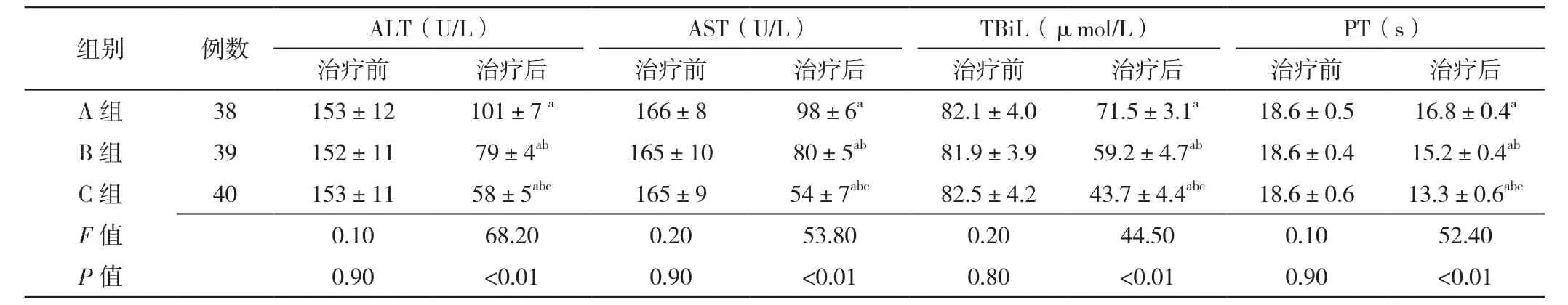
表3 三组患者治疗前后肝功能指标及PT比较(±s)Table 3 Comparison of mean levels of liver function markers and prothrombin time in the three groups before and after treatment
注:ALT=丙氨酸氨基转移酶,AST=天冬氨酸氨基转移酶,TBiL=总胆红素,PT=凝血酶原时间;与治疗前比较,aP<0.05;与A组比较,bP<0.05;与B组比较,cP<0.05
组别 例数 ALT(U/L) AST(U/L) TBiL(μmol/L) PT(s)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后A 组 38 153±12 101±7 a 166±8 98±6a 82.1±4.0 71.5±3.1a 18.6±0.5 16.8±0.4a B 组 39 152±11 79±4ab 165±10 80±5ab 81.9±3.9 59.2±4.7ab 18.6±0.4 15.2±0.4ab C 组 40 153±11 58±5abc 165±9 54±7abc 82.5±4.2 43.7±4.4abc 18.6±0.6 13.3±0.6abc F值 0.10 68.20 0.20 53.80 0.20 44.50 0.10 52.40 P值 0.90 <0.01 0.90 <0.01 0.80 <0.01 0.90 <0.01
表4 三组患者治疗前后血清炎性因子水平比较(±s)Table 4 Comparison of mean levels of serum inflammatory cytokines in the three groups before and after treatment
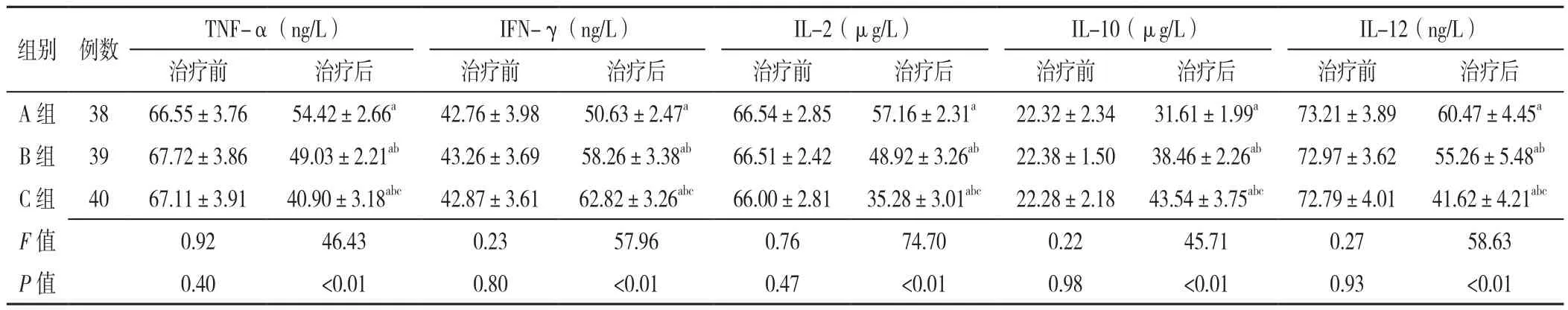
表4 三组患者治疗前后血清炎性因子水平比较(±s)Table 4 Comparison of mean levels of serum inflammatory cytokines in the three groups before and after treatment
注:TNF-α=肿瘤坏死因子,INF-γ=干扰素γ,IL=白介素;与治疗前比较,aP<0.05;与A组比较,bP<0.05;与B组比较,cP<0.05
组别 例数 TNF-α(ng/L) IFN-γ(ng/L) IL-2(μg/L) IL-10(μg/L) IL-12(ng/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后A 组 38 66.55±3.76 54.42±2.66a 42.76±3.98 50.63±2.47a 66.54±2.85 57.16±2.31a 22.32±2.34 31.61±1.99a 73.21±3.89 60.47±4.45a B 组 39 67.72±3.86 49.03±2.21ab 43.26±3.69 58.26±3.38ab 66.51±2.42 48.92±3.26ab 22.38±1.50 38.46±2.26ab 72.97±3.62 55.26±5.48ab C 组 40 67.11±3.91 40.90±3.18abc 42.87±3.61 62.82±3.26abc 66.00±2.81 35.28±3.01abc 22.28±2.18 43.54±3.75abc 72.79±4.01 41.62±4.21abc F值 0.92 46.43 0.23 57.96 0.76 74.70 0.22 45.71 0.27 58.63 P值 0.40 <0.01 0.80 <0.01 0.47 <0.01 0.98 <0.01 0.93 <0.01
表5 三组患者治疗前后体液及细胞免疫指标比较(±s)Table 5 Comparison of mean levels of humoral and cellular immune markers in the three groups before and after treatment
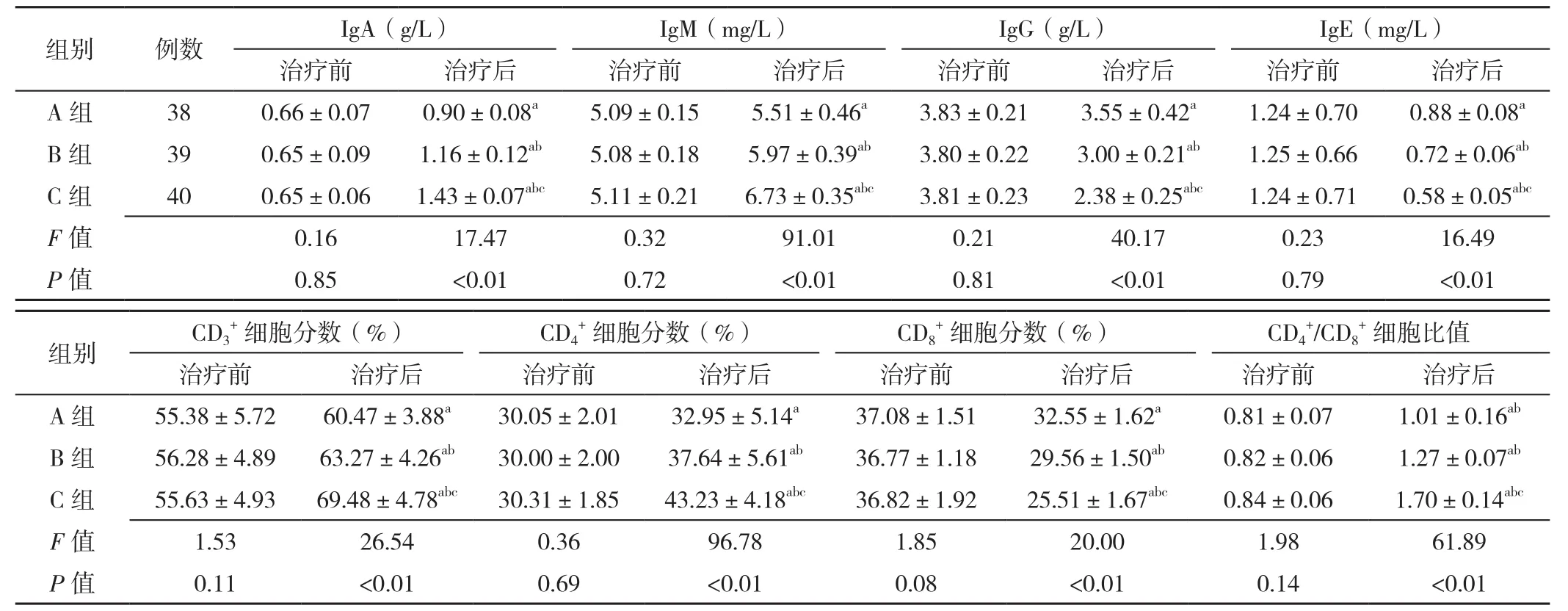
表5 三组患者治疗前后体液及细胞免疫指标比较(±s)Table 5 Comparison of mean levels of humoral and cellular immune markers in the three groups before and after treatment
注:IgA=免疫球蛋白A,IgM=免疫球蛋白M,IgG=免疫球蛋白G,IgE=免疫球蛋白E;与治疗前比较,aP<0.05;与A组比较,bP<0.05;与B组比较,cP<0.05
组别 例数 IgA(g/L) IgM(mg/L) IgG(g/L) IgE(mg/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后A 组 38 0.66±0.07 0.90±0.08a 5.09±0.15 5.51±0.46a 3.83±0.21 3.55±0.42a 1.24±0.70 0.88±0.08a B 组 39 0.65±0.09 1.16±0.12ab 5.08±0.18 5.97±0.39ab 3.80±0.22 3.00±0.21ab 1.25±0.66 0.72±0.06ab C 组 40 0.65±0.06 1.43±0.07abc 5.11±0.21 6.73±0.35abc 3.81±0.23 2.38±0.25abc 1.24±0.71 0.58±0.05abc F值 0.16 17.47 0.32 91.01 0.21 40.17 0.23 16.49 P值 0.85 <0.01 0.72 <0.01 0.81 <0.01 0.79 <0.01组别 CD3+细胞分数(%) CD4+细胞分数(%) CD8+细胞分数(%) CD4+细胞比值治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后+/CD8 A 组 55.38±5.72 60.47±3.88a 30.05±2.01 32.95±5.14a 37.08±1.51 32.55±1.62a 0.81±0.07 1.01±0.16ab B 组 56.28±4.89 63.27±4.26ab 30.00±2.00 37.64±5.61ab 36.77±1.18 29.56±1.50ab 0.82±0.06 1.27±0.07ab C 组 55.63±4.93 69.48±4.78abc 30.31±1.85 43.23±4.18abc 36.82±1.92 25.51±1.67abc 0.84±0.06 1.70±0.14abc F值 1.53 26.54 0.36 96.78 1.85 20.00 1.98 61.89 P值 0.11 <0.01 0.69 <0.01 0.08 <0.01 0.14 <0.01
2.7 不良反应和/或并发症发生情况 A组患者治疗期间出现腹腔积液3例、消化道出血1例;B组患者治疗期间出现肝性脑病1例、腹腔积液1例;C组患者治疗期间无一例出现不良反应和/或并发症。
3 讨论
肝硬化是多种慢性肝病的终末期表现,在中国肝硬化主要由乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)持续感染引起;据统计,我国平均HBV阳性率为7.18%,平均HCV阳性率为3.2%[15]。随着人们生活方式及饮食习惯改变,我国由于饮酒过量、肥胖、糖尿病发病率升高而引起的酒精性和非酒精性肝病患者数量逐年增多,而酒精性和非酒精性肝病均有很大可能或已发展为肝纤维化甚至肝硬化,因此肝纤维化或肝硬化患者数量巨大[16]。
目前,针对肝硬化患者的临床治疗主要集于去除潜在病因、延缓病程进展及维持患者生命,其中OLT虽能在一定程度上改善肝硬化患者肝功能并缓解病情,但并不能从根本上解决肝硬化过程中肝细胞的减少问题,且存在供体资源少、高免疫排斥反应、高费用等缺陷。近年研究表明,BMSCs对肝纤维化、肝硬化均有一定治疗作用,并可改善患者肝功能,提高患者生存质量,同时BMSCs会在受损的肝脏内分化为正常肝细胞、胆管上皮细胞并分泌促进肝生长的生长因子,进而达到缓解或逆转肝纤维化、肝硬化的目的[17-18]。已有大量研究证实干细胞治疗肝纤维化或肝硬化的分子作用机制与干细胞转分化及对微环境的免疫调节有关,而BMSCs可在趋化受体作用下迁移至受损的肝脏,进而分化为肝细胞并补充肝细胞数量[19]。此外,QIAO等[20]还发现,BMSCs可分泌一些促进细胞生长的因子、抑制氧化应激反应产物、调节IFN-γ和TNF-α而抑制肝星状细胞增殖。但是,BMSCs在骨髓中含量极少且其向肝脏损伤部位归巢能力有限,因此BMSCs在临床上的应用也受到一定限制,而通过为干细胞的自我更新与定向分化提供一个良好的微环境以使其在含量极少的情况上提高存活率、增殖率并诱导转化为肝细胞是目前肝硬化失代偿期治疗领域亟待解决的关键问题。
中医学无肝硬化的病名,根据临床症状及体征可将其归于“臌胀”“黄疸”“积聚”等范畴。中医学理论认为,肝硬化的主要病机为毒、瘀、虚羁留搏结,湿、热、瘀、毒侵犯肝脏导致肝脾不调、气虚血瘀,日久正气亏虚而造成肝络受损;而“肾藏精”,主生长发育与生殖,这与干细胞的“自我更新”和“定向分化”有很大的相似性和相关性。许静等[21]研究证实,补肾中药淫羊藿可通过动员体内激素、细胞因子而激活内源性干细胞。中医学理论认为,肾藏精,肝藏血,肾中精气充盈则肝有所养,血有所充;肝藏血量充盈则肾有所藏,精有所资,故云“肝肾同源、精血同源、相互化生”。吴理茂等[22]等研究发现,归元方与BMSCs移植术对急、慢性肝损伤有明确的治疗作用,二者联用可优势互补,具有协同增效作用。范慧慧等[23]研究发现活血化瘀方药不仅能激活并促进内源性干细胞大量增殖,还能调控内源性干细胞分化。
柔肝化纤颗粒由全国名老中医林沛湘所创壮肝逐瘀煎与关幼波教授治疗肝炎肝硬化有效经验方组合而成,并由黄芪、牡蛎、黄精、枸杞、薏苡仁、橘红、泽兰、鸡内金、鳖甲、虎杖、丹皮、黑枣组成,具有健脾补肾柔肝兼顾解毒活血、化痰软坚散结功效和明显的保肝、抗纤维化、抗肝硬化作用。柔肝化纤颗粒中黄芪、黄精、枸杞子、薏苡仁、黑枣具有益气健脾、补肾柔肝功效,有利于通过恢复机体正气、补肾生髓成肝而恢复肝脏组织气血津液,进而保障归巢干细胞增殖、分化、修复、再生;橘红、泽兰、鳖甲、生牡蛎具有活血祛瘀、化痰散结功效,可通过活血化痰而调整气血关系、达到“血和则经脉流行”的目的,进而为干细胞在肝脏的顺利归巢提供有利条件。本研究结果显示,C组患者临床疗效优于A组和B组,且患者治疗后胁痛、纳差、神疲乏力、黄疸评分及血清ALT、AST、TBiL水平低于A组、B组,PT短于A组、B组,表明柔肝化纤颗粒联合BMSCs移植术可有效改善肝硬化失代偿期患者临床症状和体征、肝功能和凝血功能,有利于为受损的肝细胞创造再生及功能恢复的内环境,促使干细胞在肝脏归巢、分化。
研究表明,HBV等病毒持续感染过程中炎性反应及免疫应答紊乱会引起慢性肝损伤及肝纤维化,而促炎/抗炎因子及Th1/Th2的动态平衡在肝纤维化、肝硬化发生和发展过程中发挥着重要作用[24-25]。IL-2、IL-10、IL-12均为白介素家族成员,其中IL-2、IL-12是促炎性因子,可加剧肝纤维化进程[26];IL-10是一种抗炎因子,可通过促进T辅助细胞增殖而抑制促炎性因子的过度表达并减轻炎性反应所致肝损伤[27]。TNF-α与IFN-γ主要由Th1细胞分泌,其中TNF-α可促进T细胞产生多种促炎性因子并参与炎性反应及抗凋亡等过程;IFN-γ主要参与抗病毒、抗肿瘤及免疫调节[28]。由Th2细胞分泌的IL-10的主要作用为诱发过敏反应[29]。本研究结果显示,C组患者治疗后血清TNF-α、IL-2、IL-12水平低于A组和B组,而血清IFN-γ、IL-10水平高于A组和B组,表明柔肝化纤颗粒联合BMSCs移植术可有效减轻肝硬化失代偿期患者炎性反应,对促炎/抗炎因子及Th1/Th2失衡具有一定调节作用。
表6 三组患者治疗前后氧化应激反应指标比较(±s)Table 6 Comparison of mean levels of oxidative stress markers in the three groups before and after treatment
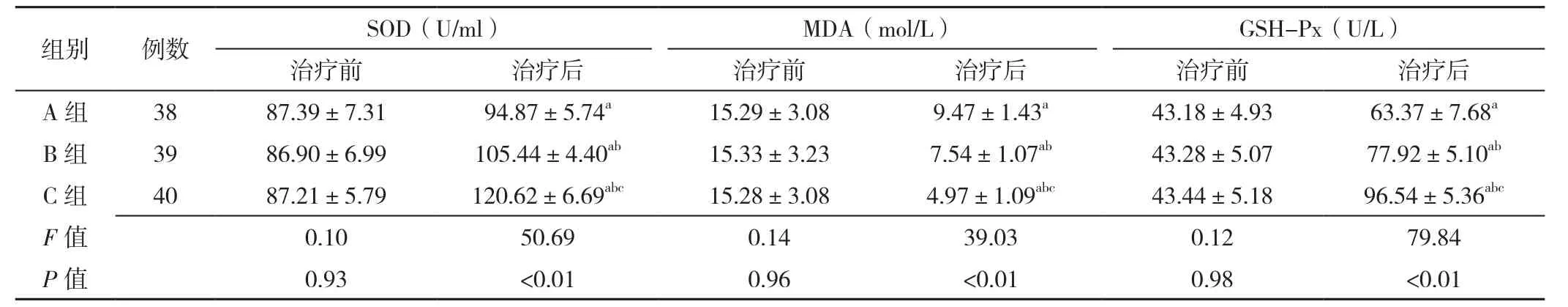
表6 三组患者治疗前后氧化应激反应指标比较(±s)Table 6 Comparison of mean levels of oxidative stress markers in the three groups before and after treatment
注:SOD=超氧化物歧化酶,MDA=丙二醛,GSH-Px=谷胱甘肽过氧化物酶;与治疗前相比aP<0.05;与A组相比bP<0.05;与B组相比cP<0.05
组别 例数 SOD(U/ml) MDA(mol/L) GSH-Px(U/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后A 组 38 87.39±7.31 94.87±5.74a 15.29±3.08 9.47±1.43a 43.18±4.93 63.37±7.68a B 组 39 86.90±6.99 105.44±4.40ab 15.33±3.23 7.54±1.07ab 43.28±5.07 77.92±5.10ab C 组 40 87.21±5.79 120.62±6.69abc 15.28±3.08 4.97±1.09abc 43.44±5.18 96.54±5.36abc F值 0.10 50.69 0.14 39.03 0.12 79.84 P值 0.93 <0.01 0.96 <0.01 0.98 <0.01
免疫功能主要反映的是机体对外邪侵袭的抵抗能力,体液及细胞免疫是机体免疫系统的主要组成部分,而免疫功能紊乱是导致肝硬化加重的重要原因,其中外周血T淋巴细胞亚群在肝脏炎症、损伤及纤维化过程中发挥着重要作用,而免疫球蛋白具有调节细胞毒作用[30]。本研究结果显示,C组患者治疗后血清IgA、IgM水平和CD3+、CD4+细胞分数及CD4+/CD8+细胞比值高于A组、B组,血清IgG、IgE水平和CD8+细胞分数低于A组、B组,表明柔肝化纤颗粒联合BMSCs移植术可有效改善肝硬化失代偿期患者免疫功能。
氧化应激反应指机体或细胞内活性氧(ROS)过度产生和/或抗氧化防御功能减弱导致二者平衡受到严重破坏而造成组织、细胞损伤的状态[31]。研究表明,ROS的过度产生可引起生物膜磷脂中多价不饱和酸和脂肪酸发生脂质过氧化反应,而MDA为脂质过氧化物之一,可反映机体组织损伤程度;SOD和GSH-Px均是机体内重要的抗氧化酶,对调节氧化/抗氧化平衡具有重要的作用[32]。本研究结果显示,C组患者治疗后血清SOD、GSH-Px水平高于A组和B组,而血清MDA水平低于A组和B组,表明柔肝化纤颗粒联合BMSCs移植术可有效减轻肝硬化失代偿期患者氧化应激反应。本研究结果还显示,C组患者治疗期间无一例出现不良反应和/或并发症,提示柔肝化纤颗粒联合BMSCs移植术有利于减少肝硬化失代偿期患者治疗过程中不良反应和或并发症的发生,但由于本研究为单中心研究,样本量较小、观察时间较短且A、B组患者中出现并发症者例数过少,无法行统计学分析及假设检验,因此柔肝化纤颗粒联合BMSCs移植术治疗肝硬化失代偿期的具体作用机制及安全性等仍有待进一步研究证实。
综上所述,柔肝化纤颗粒联合BMSCs移植术可有效改善肝硬化失代偿期患者临床症状和体征、肝功能、凝血功能及免疫功能,减轻患者炎性反应及氧化应激反应,有一定临床推广应用价值,而采用中医药招募内源性干细胞的动员方案仍需进行更多临床试验以获得更多循证医学证据等。
作者贡献:吕艳杭负责数据分析、文章撰写及论文修订;吴姗姗进行结果分析与解释;王振常负责研究的构思与设计及可行性分析,对文章整体负责;叶学劲负责文章的监督管理;符燕青、段桂姣、苏晓文、农小欣进行数据收集及统计学处理。
本文无利益冲突。
