从差异表达蛋白及其调控层面探讨慢性乙型肝炎肝胆湿热证与脾胃湿热证的证候差异
2021-12-07淡丽娟柴少竹黎桂玉苏悦邹嘉曦文莉
淡丽娟,柴少竹,黎桂玉,苏悦,邹嘉曦,文莉
慢性乙型肝炎(CHB)指由乙型肝炎病毒(HBV)持续感染引起的慢性肝脏炎性疾病,其传染性较强、发病率较高,可引起多个器官损伤[1]。据统计,全球范围内约有2.4亿HBV感染者[2],而CHB是全球主要健康负担之一[3]。研究表明,中医药治疗CHB在改善患者症状、减轻肝损伤、延缓病情进展等方面具有一定优势和特色[4-5],而辨证论治虽是中医药治疗疾病的精髓与核心,但由于辨证存在一定主观性及复杂性,因此中医药治疗优势的发挥受到一定影响。
湿热证是CHB的常见证候,但其定位尚存在一定争议:受现代解剖定位影响,有学者认为CHB应该定位于肝胆[6];丁然等[7]通过对19 000余份病毒性肝炎患者病位证素进行统计分析认为病毒性肝炎主要病位证素是脾而非肝;蔡行平[8]提出“肝病缠绵当以治脾为先”,认为脾虚对于肝组织的病理变化影响深远。笔者所在课题组前期研究结果显示,1 260例CHB患者中184例(占14.6%)为肝胆湿热证,211例(占16.7%)为脾胃湿热证,提示脾胃湿热证是CHB患者最常见证型,而脾胃与肝胆均是CHB常见病变部位[9]。由于缺乏客观生物学依据,因此CHB湿热证病位是否存在脾胃与肝胆的差异目前仍存在争议。此外,脾胃湿热证和肝胆湿热证同为中焦湿热证,二者均有纳差、呕恶、口干口苦、舌红、苔腻等湿热证表现,辨证分型较易混淆,但二者治疗处方不尽相同,因此有必要寻找二者证候差异的生物学本质及客观标志物。本研究在前期研究基础上对通过蛋白组学分析技术筛选出来的差异表达蛋白进行了深入分析,旨在从差异表达蛋白及其调控层面探讨CHB肝胆湿热证与脾胃湿热证的证候差异、探寻区分二者的潜在客观标志物,为CHB的辨证论治提供生物学依据。
1 资料与方法
1.1 一般资料 选取2018年1月—2019年1月中国人民解放军西部战区总医院肝病科门诊、消化科门诊收治的CHB患者30例,其中辨证分型为肝胆湿热证者15例(肝胆湿热组)、脾胃湿热证者15例(脾胃湿热组);另选取同期在中国人民解放军西部战区总医院体检健康者10例作为对照组。对照组受试者中男5例,女5例;年龄26~50岁,平均年龄为(25.0±7.6)岁。肝胆湿热组患者中男11例,女4例;年龄18~54岁,平均年龄为(39.5±32.0)岁。脾胃湿热组患者中男10例,女5例;年龄27~50岁,平均年龄为(41.0±38.5)岁。三组受试者性别(χ2=1.47,P=0.48)、年龄(F=0.92,P=0.41)比较,差异无统计学意义,具有可比性。排除标准:(1)合并其他肝炎病毒和/或人免疫缺陷病毒(HIV)感染;(2)合并肝硬化、恶性肿瘤;(3)合并药物性或中毒性肝损伤、自身免疫性肝炎及其他遗传-代谢性肝脏疾病;(4)合并严重心、肺及内分泌、血液系统等疾病;(5)合并高血压、糖尿病、肾脏病;(6)妊娠或哺乳期女性;(7)伴有精神疾病等;(8)存在研究者认为不适合纳入研究的其他情况。本研究通过成都中医药大学附属医院医学伦理委员会审查,三组受试者均被告知研究内容、目的及相关注意事项并自愿签署知情同意书。
1.2 西医诊断标准 CHB的西医诊断标准参照《慢性乙型肝炎防治指南(2015年更新版)》[1],具体如下:(1)血清HBV表面抗原(HBsAg)和/或HBV脱氧核糖核酸(HBV-DNA)阳性时间>6个月,可诊断;(2)既往有CHB病史且血清HBsAg阳性,可诊断;(3)血清HBsAg、HBV e抗原(HBeAg)、HBV-DNA均为阳性,丙氨酸氨基转移酶(ALT)持续或反复升高,或兼肝组织病理学病变诊断为HBeAg阳性CHB;血清HBsAg阳性、HBeAg阴性、HBV-DNA阳性,ALT持续或反复升高,或兼肝组织学病变诊断为HBeAg阴性CHB。
1.3 中医辨证分型标准 中医辨证分型标准参照《慢性乙型肝炎中医诊疗指南(2018年版)》[7]。
1.3.1 肝胆湿热证 主症:(1)胁肋胀痛;(2)舌苔黄腻,脉弦数或弦滑数。次症:(1)呕恶纳呆,厌油腻;(2)身目发黄、色泽鲜明;(3)小便黄。具备以上所有主症、主症(1)及任意两项次症、主症(2)及次症(1)(2)者辨证分型为肝胆湿热证。
1.3.2 脾胃湿热证 主症:(1)脘腹痞闷;(2)苔黄腻。次症:(1)呕恶纳呆,厌油腻;(2)身目发黄、色泽鲜明,小便黄;(3)大便臭秽黏滞。具备以上所有主症、主症(1)及任意两项次症、主症(2)及次症(1)(2)者辨证分型为脾胃湿热证。
1.4 差异表达蛋白分析 采集三组受试者清晨空腹肘静脉血3~5 ml,室温下静置1 h,待血清析出后置于离心机并以3 500 r/min的速率离心10 min以进一步分离血清,温度设置为4 ℃;离心完成后提取1 ml上清液并置于冻存管及-80 ℃冰箱中保存,之后用干冰密封。结合笔者所在课题组前期通过蛋白组学分析技术筛选出的CHB肝胆湿热证与脾胃湿热证差异表达蛋白,采用酶联免疫吸附试验(ELISA)检测目标蛋白,包括人癌胚抗原相关细胞黏附分子1(CEACAM1)、单核细胞趋化蛋白1(MCP-1)、基质细胞衍生因子1(SDF-1)、人类黏蛋白2(ORM2)、人膜突蛋白(MSN)、纤维胶凝蛋白2(FCN2)、血管细胞黏附分子1(VCAM-1)、胰岛素样生长因子1(IGF-1)、人神经源性基因座同源缺口蛋白2(NOTCH2)、人β-淀粉样前体蛋白(β-APP)、人乌头酸酶(ACO1)、人山梨醇脱氢酶(SORD)、人乙醛脱氢酶1家族成员A1(ALDH1A1),试剂盒均来源于上海活乐生物科技有限公司,生产批号依次为20903C18、20903M03、20903S21、20903R16、20903M42、20903F38、20903K24、20903G15、20903N07、20903A16、20903A67、20903S33、20903A02。按照相应试剂盒说明书,采用酶标仪在450 nm波长处依序测量各个酶孔光密度(OD)值,并根据OD值计算目标蛋白表达量。
本研究背景:
湿热证是慢性乙型肝炎的常见证候,而作为慢性乙型肝炎常见证型,肝胆湿热证与脾胃湿热证的辨证分型较易混淆,但二者治疗处方不尽相同。目前,关于慢性乙型肝炎肝胆湿热证与脾胃湿热证证候差异的生物学本质及能够区分二者的客观生物学标志物均鲜有报道。
本研究创新点:
本研究从差异表达蛋白及其调控层面探讨了慢性乙型肝炎肝胆湿热证与脾胃湿热证证候差异的生物学本质,并发现了区分二者的潜在蛋白。
本研究价值:
本研究从现代生物学角度揭示了慢性乙型肝炎肝胆湿热证与脾胃湿热证因病位差异而呈不同证候表现的本质,有利于丰富中医证候现代科学内涵,为慢性乙型肝炎湿热证的精准化辨证论治及方药作用靶点研究提供生物学依据。
1.5 生物信息学分析 通过生物信息学在线工具STRING数据库对差异表达蛋白进行蛋白相互作用(protein-protein interaction,PPI)网络分析,同时运用Excel 2016、DAVID Bioinformatics Resources 6.7等对差异表达蛋白进行基因本体论数据库(gene ontology,GO)富集和生物途径(Kyoto encylopedia of genes and genomes,KEGG)信号通路分析。
1.6 统计学方法 使用SPSS 25.0统计学软件进行数据分析,本研究中计量资料均符合正态分布,以(±s)表示,三组间比较采用单因素方差分析(one-way ANOVA),两两比较采用q检验;采用MedCalc18.11.6绘制受试者工作特征(ROC)曲线以分析差异表达蛋白对CHB肝胆湿热证与脾胃湿热证的鉴别诊断价值,一般认为在ROC曲线下面积(AUC)>0.50的情况下AUC越接近于1则诊断效能越高,本研究以AUC0.50~0.69为诊断准确性较低,0.70~0.90为诊断准确性中等,>0.90为诊断准确性较高[10]。以P<0.05为差异有统计学意义。
2 结果
2.1 差异表达蛋白分析 三组受试者CEACAM1、MCP-1、SDF-1、ORM2、MSN、FCN2、VCAM-1、IGF-1、NOTCH2、β-APP、ACO1、SORD、ALDH1A1蛋白表达量比较,差异有统计学意义(P<0.05);肝胆湿热组、脾胃湿热组患者CEACAM1、MCP-1、SDF-1、ORM2、MSN、FCN2、VCAM-1、IGF-1、NOTCH2、β-APP、ACO1、SORD、ALDH1A1蛋白表达量均低于对照组,差异有统计学意义(P<0.05);脾胃湿热组患者CEACAM1、MCP-1、MSN、VCAM-1蛋白表达量高于肝胆湿热组,SDF-1、ORM2、FCN2、IGF-1、NOTCH2、β-APP蛋白表达量低于肝胆湿热组,差异有统计学意义(P<0.05,见表1)。
以P<0.01为标准进一步筛选肝胆湿热证与脾胃湿热证差异表达蛋白,结果上述10种差异表达蛋白仅CEACAM1、SDF-1、MSN、IGF-1入选,其中脾胃湿热组患者CEACAM1、MSN蛋白表达量高于肝胆湿热组,SDF-1、IGF-1蛋白表达量低于肝胆湿热组(P<0.01,见图1)。
2.2 生物信息学分析 PPI网络分析结果显示,CHB肝胆湿热证与脾胃湿热证之间CEACAM1、MCP-1、SDF-1、ORM2、MSN、FCN2、VCAM-1、IGF-1、NOTCH2、β-APP蛋白存在较紧密的关联(见图2);GO富集分析结果显示,CEACAM1、MCP-1、SDF-1、ORM2、MSN、FCN2、VCAM-1、IGF-1、NOTCH2、β-APP蛋白的生物学效应主要涉及蛋白质结合、细胞黏附分子结合、G蛋白耦联受体结合、信号受体结合、胰岛素受体结合等;KEGG信号通路分析结果显示,CEACAM1、MCP-1、SDF-1、ORM2、MSN、FCN2、VCAM-1、IGF-1、NOTCH2、β-APP蛋白主要参与白细胞跨内皮迁移、核因子(NF)-κB信号通路、内分泌抵抗、晚期糖基化终末产物(AGE)-晚期糖基化终末产物受体(RAGE)信号通路、肿瘤坏死因子(TNF)信号通路、癌症相关通路等。
2.3 ROC曲线分析 CHB肝胆湿热组与脾胃湿热组之间差异表达(P<0.01)蛋白CEACAM1、SDF-1、MSN、IGF-1鉴别诊断CHB肝胆湿热证与脾胃湿热证的ROC曲线进行分析,结果显示CEACAM1、SDF-1、MSN的P值均<0.05,而IGF-1的P值>0.05,因此分别以CEACAM1、SDF-1、MSN建立单独鉴别诊断模型,结果显示CEACAM1、SDF-1、MSN鉴别诊断CHB肝胆湿热证与脾胃湿热证的AUC分别为0.73〔95%CI(0.54,0.87)〕、0.70〔95%CI(0.51,0.85)〕、0.72〔95%CI(0.53,0.86)〕,灵敏度分别为86.67%、86.67%、80.00%,特异度均为56.25%(见图3)。

图1 三组受试者差异表达蛋白表达量比较的散点图Figure 1 Scatter plots for comparison of expression levels of differentially expressed proteins in two syndrome-based subgroups of chronic hepatitis B and control group
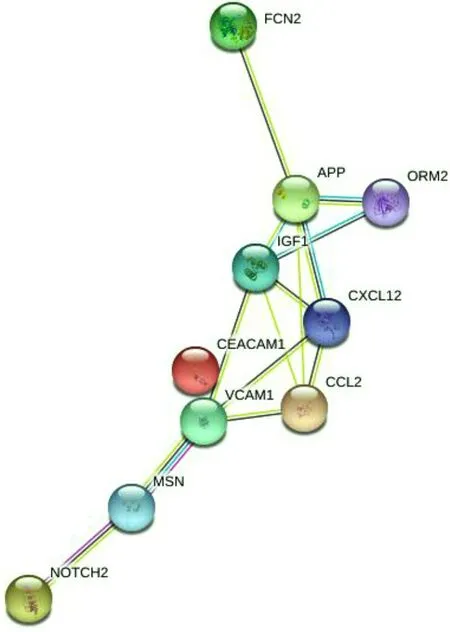
图2 CHB肝胆湿热证与脾胃湿热证之间10种差异表达蛋白的PPI网络分析Figure 2 PPI network analysis of 10 differentially expressed proteins between liver-gallbladder damp-heat and spleen-stomach dampness-heat syndromes in chronic hepatitis B
表1 三组受试者差异表达蛋白表达量比较(±s)Table 1 Comparison of the levels of differentially expressed proteins in two syndrome-based subgroups of chronic hepatitis B and control group
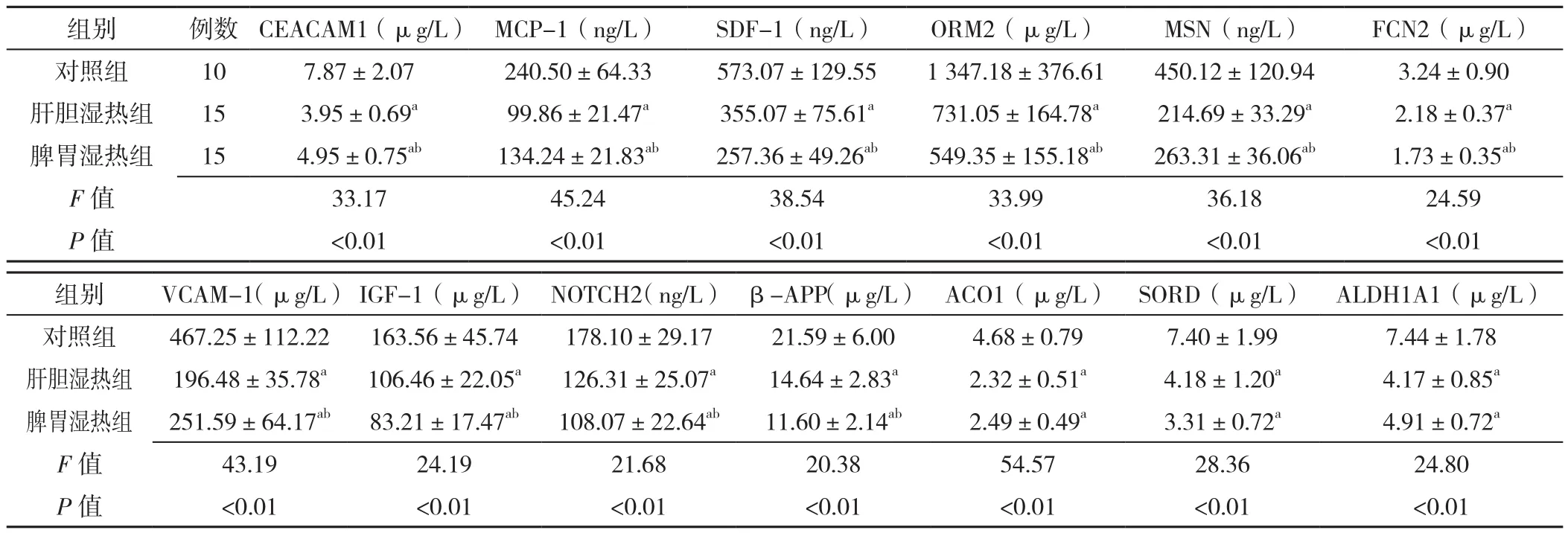
表1 三组受试者差异表达蛋白表达量比较(±s)Table 1 Comparison of the levels of differentially expressed proteins in two syndrome-based subgroups of chronic hepatitis B and control group
注:CEACAM1=人癌胚抗原相关细胞黏附分子1,MCP-1=单核细胞趋化蛋白1,SDF-1=基质细胞衍生因子1,ORM2=人类黏蛋白2,MSN=人膜突蛋白,FCN2=纤维胶凝蛋白2,VCAM-1=血管细胞黏附分子1,IGF-1=胰岛素样生长因子1,NOTCH2=人神经源性基因座同源缺口蛋白2,β-APP=人β-淀粉样前体蛋白,ACO1=人乌头酸酶,SORD=人山梨醇脱氢酶,ALDH1A1=人乙醛脱氢酶1家族成员A1;与对照组比较,aP<0.05;与肝胆湿热组比较,bP<0.05
组别 例数 CEACAM1(μg/L) MCP-1(ng/L) SDF-1(ng/L) ORM2(μg/L) MSN(ng/L) FCN2(μg/L)对照组 10 7.87±2.07 240.50±64.33 573.07±129.55 1 347.18±376.61 450.12±120.94 3.24±0.90肝胆湿热组 15 3.95±0.69a 99.86±21.47a 355.07±75.61a 731.05±164.78a 214.69±33.29a 2.18±0.37a脾胃湿热组 15 4.95±0.75ab 134.24±21.83ab 257.36±49.26ab 549.35±155.18ab 263.31±36.06ab 1.73±0.35ab F值 33.17 45.24 38.54 33.99 36.18 24.59 P 值 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01组别 VCAM-1(μg/L) IGF-1(μg/L) NOTCH2(ng/L) β-APP(μg/L) ACO1(μg/L) SORD(μg/L) ALDH1A1(μg/L)对照组 467.25±112.22 163.56±45.74 178.10±29.17 21.59±6.00 4.68±0.79 7.40±1.99 7.44±1.78肝胆湿热组 196.48±35.78a 106.46±22.05a 126.31±25.07a 14.64±2.83a 2.32±0.51a 4.18±1.20a 4.17±0.85a脾胃湿热组 251.59±64.17ab 83.21±17.47ab 108.07±22.64ab 11.60±2.14ab 2.49±0.49a 3.31±0.72a 4.91±0.72a F值 43.19 24.19 21.68 20.38 54.57 28.36 24.80 P 值 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01
3 讨论
辨证论治是中医学的核心理论,辨证是论治的前提和基础,而证候的本质研究和证候生物学标志物的发现是实现中医临床与理论突破的核心科学技术问题之一[11]。近年来,基于蛋白质组学分析技术开展的生物学研究为深入阐释中医证候本质提供了新的切入点,多种中医证候生物学标志物已在不同疾病研究中被发现,如WEN等[12]研究发现纤维连接蛋白1(FN1)、谷胱甘肽过氧化物酶(GPX3)和角蛋白10(KRT10)为艾滋病热毒蕴结证特异性表达蛋白,而视黄醇结合蛋白4(RBP4)、载脂蛋白E(ApoE)和激肽原1(KNG1)则为艾滋病脾肾阳虚证特异性表达蛋白;JIANG等[13]研究发现γ-谷氨酰水解酶(GGH)、免疫球蛋白 G3(IGHG3)、结合珠蛋白(HPT)分别为肺结核肺阴虚证、阴虚火旺证、气阴两虚证特异性表达蛋白;LIU等[14]研究发现KNG1、载脂蛋白C3(APOC3)和对氧磷酶1(PON1)可作为中医阴虚热证的潜在生物学标志物。本研究以CHB两种最常见的湿热证肝胆湿热证和脾胃湿热证为切入点,在笔者所在课题组前期研究基础上结合ELISA、生物信息学在线工具、ROC曲线等进行了差异表达蛋白分析、生物信息学分析、鉴别诊断价值分析,并针对既往研究多停留在探索疾病中医证候客观标志物层面的局限性,从差异表达蛋白及其调控层面探讨了CHB肝胆湿热证与脾胃湿热证证候差异的生物学基础,以期为迁延难愈不易区分的CHB肝胆湿热证与脾胃湿热证的辨证论治提供生物学依据,筛选潜在客观标志物。
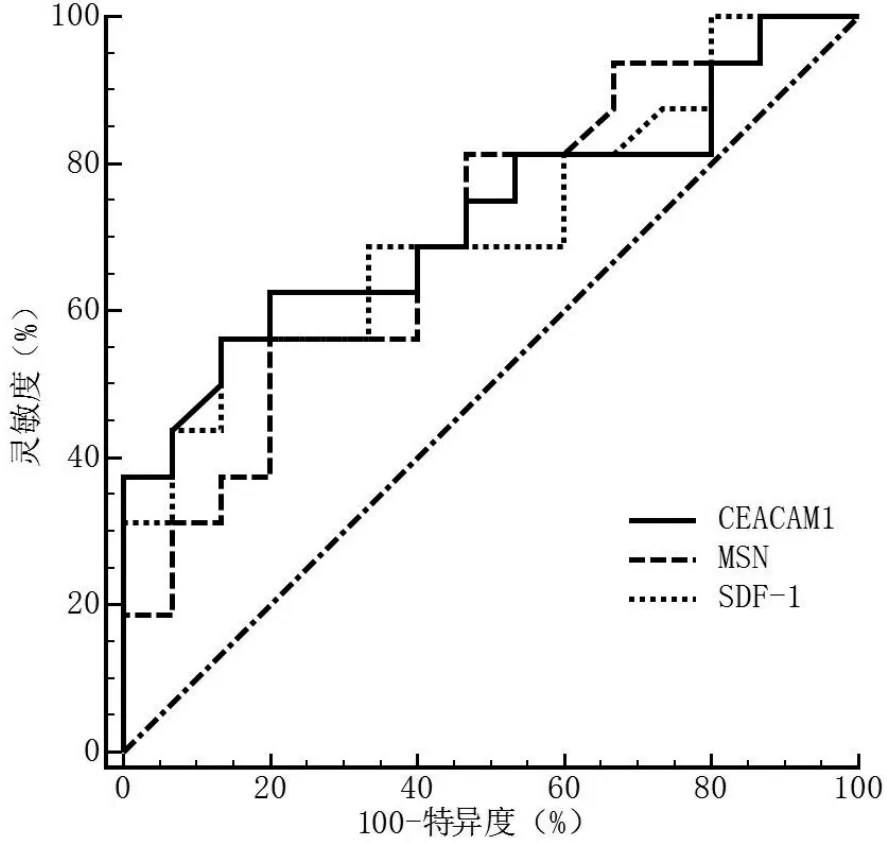
图3 CEACAM1、MSN、SDF-1对CHB肝胆湿热证与脾胃湿热证鉴别诊断价值的ROC曲线Figure 3 ROC curve for CEACAM1,MSN and SDF-1 in distinguishing liver-gallbladder damp-heat and spleen-stomach damp-heat syndromes in chronic hepatitis B
研究表明,白细胞跨内皮迁移作为白细胞募集的最后一步,在感染性疾病及免疫反应过程中具有重要作用,而抑制作为炎性反应中枢通路的NF-κB信号通路则可减轻肠黏膜上皮损伤和炎性反应程度[15-16],同时AGE与RAGE相互作用可引起氧化应激反应、激活NF-κB并刺激VCAM-1等炎性细胞因子的表达,进而引发瀑布式炎性反应[17]。本研究结果显示,脾胃湿热组患者CEACAM1、MCP-1、MSN、VCAM-1蛋白表达量高于肝胆湿热组,SDF-1、ORM2、FCN2、IGF-1、NOTCH2、β-APP蛋白表达量低于肝胆湿热组,进一步行生物信息学分析发现,CHB肝胆湿热证与脾胃湿热证之间CEACAM1、SDF-1、ORM2、MSN、FCN2、VCAM-1、IGF-1、NOTCH2、β-APP存在较紧密的关联,且这10种差异表达蛋白的生物学效应主要涉及蛋白质结合、细胞黏附分子结合、G蛋白耦联受体结合、信号受体结合、胰岛素受体结合等,并主要参与白细胞跨内皮迁移、NF-κB信号通路、内分泌抵抗、AGE-RAGE信号通路、TNF信号通路、癌症相关通路等,提示CHB肝胆湿热证与脾胃湿热证证候差异可能与NF-κB信号通路和AGE-RAGE信号通路、氧化应激反应相关,但具体机制尚需进一步研究。
CEACAM1主要参与肝细胞的分化及细胞间通讯,在细胞活化、增殖,分化及凋亡相关信号转导过程中具有重要作用[18-21]。近年研究表明,CEACAM1是特异性CD8+T细胞的重要功能调节因子,CD8+T细胞CEACAM1缺陷会导致脾、淋巴结、肝及血清中抗病毒抗体减少[22];此外,CEACAM1还可通过多种细胞间黏附、细胞内信号转导而影响细胞生长和分化,在炎症调节、癌症相关免疫反应方面具有重要作用[23]。由于CHB湿热证严重程度在一定程度上可反映肝脏炎症损伤程度,因此CEACAM1可能通过调节炎性反应而参与CHB湿热证的发生和发展[24]。
SDF-1也称为CXCL12,是一类具有趋化活性的细胞因子,主要在肝脏等组织中广泛表达,除在包括胚胎发生、造血、血管生成及炎症在内的生理和病理过程中发挥着重要作用外,还在多种传染性疾病、炎性疾病、自身免疫性疾病及恶性疾病中发挥着重要作用[25]。研究表明,SDF-1可激活并诱导干细胞、内皮细胞及大多数白细胞迁移,同时可通过与其受体CXC趋化因子受体4(CXCR4)和非典型趋化因子受体3(ACKR3)相互作用及与组织、内皮中糖胺聚糖(GAGs)结合而在稳态和病理条件下发挥生物学效应[26]。
MSN是ERM(ezrin-radixin-moesin)蛋白家族成员,虽然ERM蛋白主要在肝脏组织中特异性表达,但MSN仅在肝星状细胞中表达;此外,MSN也是内皮细胞中唯一的含量丰富的ERM蛋白。研究表明,与正常组织相比,肝癌组织中MSN表达量明显升高,且MSN的表达与肝癌分化、侵袭密切相关[27]。
由上述可知,CEACAM1、SDF-1、MSN的生物学效应可能与CHB肝胆湿热证与脾胃湿热证证候差异存在一定关联性,这也为其作为区分CHB肝胆湿热证与脾胃湿热证的潜在客观标志物奠定了基础。本研究以P<0.01为标准进一步筛选肝胆湿热证与脾胃湿热证差异表达蛋白,结合笔者前期研究发现的16种(笔者前期研究共发现16种,本研究初始纳入13种)差异表达蛋白仅CEACAM1、SDF-1、MSN、IGF-1入选,进一步绘制ROC曲线发现CEACAM1、SDF-1、MSN的P值均<0.05,而IGF-1的P值>0.05,因此分别以CEACAM1、SDF-1、MSN建立的单独鉴别诊断模型结果显示,CEACAM1、SDF-1、MSN鉴别诊断CHB肝胆湿热证与脾胃湿热证的AUC分别为0.73、0.72、0.70,表明CEACAM1、SDF-1、MSN对CHB肝胆湿热证与脾胃湿热证的鉴别诊断准确性为中等,可作为区分CHB肝胆湿热证与脾胃湿热证的潜在客观标志物。
综上所述,CHB肝胆湿热证与脾胃湿热证之间存在客观差异,CEACAM1、SDF-1、MSN、IGF-1是二者主要差异表达蛋白,CHB肝胆湿热证与脾胃湿热证证候差异的生物学机制可能与NF-κB信号通路、AGE-RAGE信号通路介导的氧化应激反应等有关,而CEACAM1、SDF-1、MSN可作为区分CHB肝胆湿热证与脾胃湿热证的潜在客观标志物;但本研究样本量有限、相关差异表达蛋白在CHB湿热证中的具体作用尚不明确,后期有待扩大样本量进一步验证并深入探讨导致CHB肝胆湿热证与脾胃湿热证证候差异的生物学机制。
志谢:中国人民解放军西部战区总医院为笔者所在课题组合作医院,在此感谢肝病科门诊和消化科门诊相关工作人员及指导老师的支持与帮助!
作者贡献:淡丽娟、柴少竹进行研究的构思与设计及可行性分析,进行资料收集、整理及论文撰写;黎桂玉、苏悦进行论文及英文的修订;邹嘉曦、文莉负责文章的质量控制及审校,对文章整理负责,监督管理。
本文无利益冲突。
