合成大麻素类新精神活性物质的代谢物鉴定研究进展
2021-12-07李乐赵君博严慧刘万卉向平吴何坚
李乐,赵君博,严慧,刘万卉,向平,吴何坚
1.司法鉴定科学研究院 上海市法医学重点实验室 司法部司法鉴定重点实验室 上海市司法鉴定专业技术服务平台,上海 200063;2.烟台大学药学院,山东 烟台 264005
合成大麻素类新精神活性物质是与天然大麻主要活性成分四氢大麻酚(Δ9-tetrahydrocannabinol,Δ9-THC)相似的人工合成物质,是内源性大麻素受体1(cannabinoid receptor 1,CB1)和CB2的激动剂,其中CB1主要存在于神经细胞,介导与大麻相关的精神效应,而CB2主要存在于免疫细胞[1-3]。合成大麻素不依赖于大麻的种植,成本更低且获取容易,能产生更为强烈的兴奋、致幻等效果,是目前世界上新精神活性物质中涵盖物质种类最多、滥用最为严重的家族[4]。欧洲毒品和毒瘾监测中心(European Monitoring Centre for Drugs and Drug Addiction,EMCDDA)在2021 年的世界毒品报告中指出,合成大麻素类物质是监测到的最大一类[5]。
合成大麻素于2008 年首次被发现,德国的一个实验室在网络上热销的一种名为“香料”的产品中首次检出1-戊基-3-(1-萘甲酰基)吲哚(JWH-018),同年12 月,欧洲和日本首次确定将合成大麻素归类为娱乐性滥用药物[6-7],随后其他国家也将其进行了列管[8]。但仍有不法分子对列管内的合成大麻素进行结构修饰以规避相关法律规定,吸食该类物质后会出现头晕、呕吐、精神恍惚、致幻等反应,过量吸食会出现休克、窒息甚至猝死等情况[9-10],已引发多起毒驾、故意伤害等危害公共安全事件。我国于2021年7月正式整类列管合成大麻素,与之相关的合成大麻素滥用监测技术亟待提高。合成大麻素在人体内代谢迅速,尿液中几乎无法检出原体[11-14]。一般来讲,Ⅰ相代谢产物可作为鉴别合成大麻素是否摄入的最佳代谢标志物,因为其质谱响应较高,并且在一段时间内比Ⅱ相代谢产物稳定。其中还有一些羟基化代谢产物会产生比合成大麻素原体更大的毒性,比如JWH-018 的主要代谢产物4’-羟基-JWH-018 和5’-羟基-JWH-018,1-(5-氟戊基)-3-(1-萘甲酰基)-1H-吲哚(AM-2201)的主要代谢产物4’-羟基-AM-2201[15],有报道[16]称服用JWH-018 后会导致癫痫发作和室上性心动过速,所以对新出现的合成大麻素进行代谢研究非常重要。许多新精神活性物质的代谢物仍具有药理活性,同时,代谢物对确认摄取新精神活性物质、延长检出时限、提供摄毒信息等具有极大应用价值,因此,代谢物通常与原体物质一同被纳入分析鉴定的范畴。随着合成大麻素的不断涌现和泛滥,对其代谢物进行鉴定成为当前的研究热点。合成大麻素种类繁多、结构复杂,不同合成大麻素的体内代谢与其结构密切相关,明确合成大麻素体内代谢及其与结构的关系可有效补充合成大麻素的相关毒理学数据。此外,体内外代谢研究可以为合成大麻素滥用监测提供基础数据。
本文基于合成大麻素的结构和分类,对代谢软件预测以及人肝细胞模型、人肝微粒体模型、大鼠体内模型、斑马鱼模型、真菌秀丽线虫模型在代谢物鉴定方面的应用进行综述,在此基础上可以对新出现的合成大麻素在体内的代谢情况进行预测,在没有代谢物标准物质的情况下可以根据相关代谢物的参考谱图对合成大麻素进行鉴别,为临床监测和法医毒物学实验室生物检材中合成大麻素及其相关代谢物的分析提供可靠的数据支撑。
1 结构和分类
大多数合成大麻素是亲脂性和非极性的化合物,一般由20~26 个碳原子组成。典型的合成大麻素结构主要由四部分组成:带取代基的母核、链接部分、链接组和末端取代基[17-18]。链接组指的是戊基吲哚环或吲唑环与萘环之间的化学键,主要是羰基、酯键、酰胺键[19-20]。联合国毒品和犯罪问题办公室(United Na⁃tions Office on Drugs and Crime,UNODC)根据化学结构将合成大麻素主要分为经典大麻、萘甲酰基吲哚类、苯乙酰基吲哚类、苯甲酰基吲哚类、萘甲基吲哚类、金刚烷甲酰基吲哚类、萘甲酰基吡咯类、环丙基甲酰吲哚类、吲唑酰胺类和其他合成大麻素[21-22]。
2 代谢软件预测
在制药行业,代谢软件预测潜在的毒性代谢物对临床前研究和临床决策都非常重要[23-30]。该工具主要基于专家知识预测目标化合物在体内的代谢情况,研究人员通过积累代谢研究经验、完善代谢物数据库、总结最新的代谢知识、及时将其转化为代谢规则、定期更新数据库,为未知代谢物的鉴定提供了有力的数据支撑。
2011 年,T’JOLLYN 等[24]对Meteor、MetaSite、Star⁃Drop 代谢软件预测工具进行了评估。其中Meteor 是一个基于代谢经验的软件预测工具。MetaSite 是一种与血红素相关的代谢软件,可用于预测在细胞色素P450(cytochrome P450,CYP450)酶参与下的Ⅰ相代谢反应,但并不涉及非CYP450 酶介导的反应,比如[1-(5-氟戊基)-1H-吲唑-3-基](萘-1-基)甲酮(THJ-2201)的氧化脱氟反应不是由CYP450 酶催化产生的,所以MetaSite 对THJ-2201 的代谢预测没有包含该反应[26]。StarDrop 则是通过分子动力学和量子化学模拟CYP450 3A4、2D6、2C9 参与下的相关代谢反应,预测药物研发中小分子药物的代谢位点[27]。META 通过汇总与代谢相关的主要酶,并对每个酶的结构位点及其活性进行评估,其中包含1 000 多种生物转化,涵盖了30种转化酶[28]。MetabolExpert 可在药物发现过程或研究阶段快速预测化合物的代谢过程,有助于对代谢物的结构进行鉴别,其中10.0版本的数据库包含了17 种生物转化,新版本更是可以预测通过新陈代谢产生特定化合物的底物[29]。MetaDrug 则是基于规则对人体内的代谢物进行预测,通过一个通用的分析程序导入得到的代谢组学数据,然后逐个分析或与结构信息学横向相结合进行分析[30]。
DIAO 等[31]对THJ-2201 的代谢进行了研究,在进行肝细胞孵育实验之前首先用MetaSite 代谢软件进行了预测,该软件共预测了8 种Ⅰ相代谢产物和7 种Ⅱ相代谢产物,主要涉及脱烷基化、羟基化、羰基化和烯基化的代谢反应,但软件预测的代谢产物与人肝细胞孵育、尿液中的代谢情况不一致。研究人员采用高分辨质谱技术对THJ-2201在人肝细胞模型中的代谢情况进行表征,共得到了27 种代谢产物,其中最主要的两种代谢产物是N-戊酸-THJ-018 和5’-羟基-THJ-018。尿液中的THJ-2201通过氧化脱氟生成5’-羟基-THJ-018 后进一步氧化为N-戊酸-THJ-018。N-戊酸-THJ-018 可以作为鉴别THJ-2201 是否摄入的代谢标志物[32]。ADAMS 等[33]在一次大规模的中毒案件中采用代谢软件预测尿液中的羧酸化代谢产物用于鉴别3-甲基-2-[1-(4-氟苄基)吲唑-3-甲酰氨基]丁酸甲酯(AMB-FUBINACA)的摄入,所得样品采用液相色谱-四极杆飞行时间质谱进行分析后,在所有8 名患者的血清和全血中都发现了脱酯基后羧酸化的代谢产物。
软件预测的主要优势在于操作简单、计算速度快,不需要参考标准、孵育或高分辨质谱技术,不受种属差异性的限制[34]。但软件中所包含的代谢酶种类有限,不包含化合物的全部代谢途径。随着对底物和酶活性位点作用机理的深入了解,详细分析相关代谢数据,有助于专业人员对代谢规则进行补充。虽然软件预测出来的代谢物种类更多,但假阳性结果也比较多,要求相关人员具有代谢经验的同时,还应该结合代谢物鉴定模型以及实际生物检材获得的数据,对目标物进行系统性的研究,为实际案情的解析提供可靠的依据。
3 代谢物鉴定模型
人体内的代谢主要是通过将外源性药物转化为水溶性更大的代谢物排泄出体外[35],主要在肝中进行,也发生在消化道、肺、肾、肠和心脏等其他部位,药物的代谢主要与局部组织的血流量和代谢相关酶的分布有关,其中肝血流量丰富且含有大部分代谢酶,特别是CYP450 家族[36-38]。代谢模型的建立为全面评估化合物在人体内的代谢提供了有效的研究手段。本文对常见的体内外代谢模型(人肝细胞模型、人肝微粒体模型、大鼠体内模型、斑马鱼模型和真菌秀丽线虫模型)的特点进行了比较。附表1 总结了合成大麻素的常见代谢模型以及相关的代谢途径[39-67]。
3.1 体外代谢模型
3.1.1 人肝细胞模型
肝细胞是从生物体内分离出来的活细胞,包含完整的Ⅰ相和Ⅱ相药物代谢酶、代谢所需的辅因子、摄取和外排药物的转运蛋白以及药物结合蛋白[34],人肝细胞相比于人肝微粒体模型可以系统反映化合物在人体肝组织内的代谢情况,是研究合成大麻素在体内生物转化的理想模型[68]。为了优化合成大麻素在人肝细胞中的代谢条件,研究人员首先通过量化人肝微粒体孵育过程中合成大麻素的消耗量来确定合成大麻素的半衰期。
该模型已经成功预测了尿液中合成大麻素的主要代谢产物,包括N-(1-氨甲酰基-2-甲基丙基)-1-戊基吲唑-3-甲酰胺(AB-PINACA)和N-(1-氨甲酰基-2-甲基丙基)-1-(5-氟戊基)吲唑-3-甲酰胺(5FAB-PINACA)[39]、1-(4-氟苄基)-1H-吲哚-3-甲酸-1-萘酯(FDU-PB-22)和1-(4-氟苄基)吲哚-3-甲酸-8-喹啉酯(FUB-PB-22)[40]、1-(5-氟戊基)吲哚-3-甲酸-1-萘酯(NM-2201)[41]、N-(1-氨甲酰基-2-甲基丙基)-1-(4-氟苄基)吲唑-3-甲酰胺(AB-FUBINACA)[42]等。CASTANETO 等[42]采用人肝细胞模型模拟了吲唑酰胺类合成大麻素AB-FUBINACA在人体内的代谢情况,利用液相色谱-高分辨质谱法(liquid chromatogra⁃phy-high resolution mass spectrometry,LC-HRMS)分析后共得到了11 种代谢产物,其中人肝细胞孵育后的主要代谢物是酰胺水解产物,也是尿液中经过β-葡萄糖醛酸水解后含量最高的代谢产物。WOHLFARTH等[43]通过人肝细胞模型对1-(5-氟戊基)-3-(2,2,3,3-四甲基环丙甲酰基)吲哚(5F-UR-144,XLR-11)进行代谢表征,共得到了14 个Ⅰ相代谢产物和16 个Ⅱ相代谢产物,主要是羟基化、羧酸化、半缩酮和半缩醛的代谢产物,根据质谱峰面积确定的主要代谢产物为2’-羧基-XLR-11、1-戊基-3-(2,2,3,3-四甲基环丙甲酰基)吲哚(UR-144)、N-(5’-羟基)-UR-144、羟基-XLR-11 葡萄糖醛酸结合物和2’-羧基-UR-144 戊酸,其中尿液经检测后的主要代谢产物是UR-144 戊酸和N-(5’-羟基)-UR-144。TRUVER 等[44]利用人肝细胞模型和高分辨质谱技术获得了2-[1-(5-氟戊基)-1H-吲哚-3-甲酰氨基]-3,3-二甲基丁酸甲酯(5F-MDMB-PICA)的代谢产物共22 种,在该模型中主要的代谢途径包括酯水解和酯基水解结合氧化脱氟,而根据尿液中的代谢数据推测这些代谢产物可能会成为筛查5F-MDMB-PICA中毒的代谢标志物。
人肝细胞约占肝总体积的80%,通过该体外模型可以得到丰富的代谢物数据,目前已经通过现代冷冻保存技术商品化[69]。但低温保存的人肝细胞比人肝微粒体的成本高,而且肝细胞活性会受到反复冻融的影响,应严格按照要求在-80 ℃中进行保存,解冻后应该先检查肝细胞的活性。
3.1.2 人肝微粒体模型
人肝微粒体是指肝组织经匀浆离心,除去细胞核和线粒体后,离心、沉淀得到的内质网囊泡碎片,药物直接接触人肝微粒体中的代谢酶(主要含有细胞色素氧化酶、尿苷二磷酸葡萄糖苷酸转移酶和酯酶等),不需要穿过细胞膜,就像在肝细胞中代谢一样。研究[45]结果表明,药物在人肝微粒体中的生物转化率比人体内更高,也比原生肝细胞高。人肝微粒体模型常被用于预测新型合成大麻素在人体内的代谢情况。SOBOLEVSKY等[46]采用人肝微粒体模型和液相色谱-三重四极杆质谱、高分辨质谱对萘甲酰基吲哚类合成大麻素AM-2201的代谢途径进行预测,共得到7种代谢产物,研究发现该体外模型中的主要代谢反应为单羟基化、双羟基化、N-脱烷基化和二氢二醇的形成,结合尿液数据验证体外数据后推荐单羟基化代谢产物为AM-2201 的代谢标志物。APIRAKKAN 等[47]利用人肝微粒体模型、高分辨质谱对5F-NNEI[即萘甲酰基吲哚类合成大麻素1-(5-氟戊基)-N-(萘-1-基)-1H-吲哚-3-甲酰胺(5F-MN-24)]的代谢途径进行了模拟预测,共检出9 种Ⅰ相代谢产物,主要的代谢途径包括羟基化和氧化作用,与MINAKATA等[48]报道的人体尿液和血清中5F-NNEI(即5F-MN-24)的体内代谢产物数据一致,主要是代谢产物的丰度存在差异,可能与孵育时间有关。
人肝微粒体模型的主要缺点是和真实尿样中的主要代谢产物存在一定的差异,是由于缺少醛氧化酶、N-乙酰基转移酶、谷胱甘肽S-转移酶和磺基转移酶等其他酶[70],如5F-AKB48[即N-(1-金刚烷基)-1-(5-氟戊基)吲唑-3-甲酰胺(5F-APINACA)]和AM-2201 的代谢[34]。AM-2201 在人肝微粒体中的代谢情况不能完全匹配真实尿样中的代谢产物数据,原因可能是人肝微粒体中不存在氧化脱氟的相关酶,在人肝微粒体孵育过程中主要产生N-脱氟戊基、单羟基化、双羟基化和二氢二醇代谢产物。一位研究员服用5 mg的AM-2201后检测尿液中的主要代谢物[15],共鉴定出4 种主要代谢产物,分别是N-(5’-羟基戊基)-JWH-018、N-戊酸-JWH-018、6’-羟基-吲哚-AM-2201 和N-(4’-羟基戊基)-AM-2201,浓度最高的代谢产物是N-戊酸-JWH-018 和N-(5’-羟基戊基)-JWH-018。而AM-2201 和JWH-018 有相同的代谢产物N-(5’-羟基戊基)-JWH-018 和N-戊酸-JWH-018。因此,仅根据尿液中这两种代谢产物鉴别AM-2201 和JWH-018 的摄入具有一定难度,还需要代谢产物6’-羟基-吲哚-AM-2201和N-(4’-羟基戊基)-AM-2201 的数据加以区分。MOGLER 等[71]研究了合成大麻素5-戊基-2-(2-苯基丙-2-基)-2,5-二氢-1H-吡啶[4,3-b]吲哚-1-酮(CUMYL-PEGACLONE)在人肝微粒体和尿液之间的差异,所有人的尿液(n=30)中均未检出合成大麻素原体,共检出22 种Ⅰ相代谢产物,经人肝微粒体孵育后的单羟基代谢产物浓度最高,主要的代谢途径包括单羟基化、双羟基化、脱氢、N-脱烷基化、β-氧化(戊基侧链氧化为丙酸代谢产物)、戊基侧链羰基化等。其中含量最高的两种代谢物是戊基侧链单羟基化和进一步羰基化的代谢产物,可以将这两种主要代谢产物作为鉴别是否摄入CUMYL-PEGACLONE 的代谢标志物。与人肝细胞模型不同的是,涉及人肝微粒体模型研究的相关人员要有药物代谢方面的基础知识,特别是代谢途径和所涉及的酶未知的情况下,还需要确定在人肝微粒体模型中必需辅助因子的信息。
在临床前毒理学研究中使用肝微粒体模型而不是肝细胞模型,是造成c-Met抑制剂SGX-523开发终止的主要原因[34]。SGX-523 在人体内的主要代谢途径是经过醛氧化酶氧化生成2-喹啉酮-SGX-523,其在尿液中的溶解度远低于SGX-523,该物质可能是造成肝毒性的主要原因。在药物研究前期,研究人员[72]首先对肝微粒体进行了物种间的比较,实验结果误导了研究小组将大鼠和狗作为体外毒理学研究模型,由于醛氧化酶在大鼠和狗体内几乎没有表达,不产生毒性代谢物,因此忽略了对人体的潜在毒性。
3.2 体内代谢模型
3.2.1 大鼠体内模型
缺乏合成大麻素的临床前毒理学相关数据,在一定程度上阻碍了对其的临床研究。在新型合成大麻素源源不断涌入市场的棘手情况下,对每一种新型合成大麻素开展临床研究不切实际。因此,研究人员会选择体内代谢模型系统研究合成大麻素在体内的药效学和药代动力学,但研究发现,体内代谢模型之间的代谢情况也会存在一定的差异,如AM-2201 在大鼠和人体内产生的主要代谢产物既有相同之处也有不同之处[73]。大鼠尿液经β-葡萄糖醛酸酶水解后的主要代谢产物是N-戊酸-JWH-018 和6’-羟基-吲哚-AM-2201,还包括两个次要代谢产物N-(5’-羟基戊基)-JWH-018 和N-(4’-羟基戊基)-AM-2201[15]。这些代谢产物的相对丰度在人和大鼠的尿液中存在较大差异,人尿液中的主要代谢产物是N-戊酸-JWH-018 和N-(5’-羟基戊基)-JWH-018,而代谢产物N-(4’-羟基戊基)-AM-2201 和6’-羟基-吲哚-AM-2201 的相对丰度较低。KEVIN 等[74]对大鼠体内模型中萘甲酰基吲哚类合成大麻素1-戊基-N-(萘-1-基)-1H-吲唑-3-甲酰胺(MN-18)的代谢途径进行了研究,向SD 大鼠的腹腔注射3 mg/mL 的MN-18,于注射后8 h 和24 h 采集尿样,经过分离和鉴别后尿液中的主要代谢产物是萘甲酰单羟基代谢产物。
采用大鼠体内模型进行人体内代谢研究相对容易,且成本低廉、取材方便,还可以提供代谢物参考标准,如果大鼠尿液中存在人体的主要代谢物,研究人员就可以用真实尿样来分离和鉴别代谢物,提供合成大麻素的代谢标志物。啮齿类动物模型的另一个优点是同时可以观察到动物的行为特征和生理变化,检测到合成大麻素的毒性,但在代谢方面也存在物种差异性。
3.2.2 斑马鱼模型
20 世纪80 年代,STREISINGER 等[75]首次将斑马鱼作为动物模型应用到遗传学研究中,此后斑马鱼被广泛用于药物的筛选和毒性研究。斑马鱼是一种生活在淡水中的小型硬骨鱼,具有易于饲养、发育快速、性成熟期短、体积小、养殖成本低、繁殖率高等优点,主要含有Ⅰ相代谢酶CYP450 和Ⅱ相代谢酶尿苷二磷酸葡萄糖醛基转移酶、磺基转移酶等,目前主要用于体内药效、毒性和安全性的评价。也有研究[76-77]评估了不同生长阶段斑马鱼幼体产生相应代谢物的能力,成年斑马鱼体内的代谢与人体相似。
YUE 等[49]采用斑马鱼模型模拟了合成大麻素3,3-二甲基-2-[1-(4-氟丁基)吲哚-3-甲酰氨基]丁酸甲酯(4F-MDMB-BICA)的代谢情况,将斑马鱼置于2.5 μg/mL 的4F-MDMB-BICA 水箱中浸泡24 h,结合LC-HRMS 对其代谢物进行鉴定和结构表征,共得到14种Ⅰ相代谢产物和4种Ⅱ相代谢产物,主要的代谢途径包括N-脱烷基化、N-脱烷基后羟基化、酰胺水解、氧化脱氟、羧酸化、羟基化、酯水解、脱氢、葡萄糖醛酸结合反应和硫酸化反应,其中酯水解的代谢产物是斑马鱼中含量最丰富的代谢物,可以用于监测实际案例中真实头发样本中4F-MDMB-BICA 的使用情况。XU 等[50]采用斑马鱼模型和人肝微粒体模型系统研究了AMB-FUBINACA 的代谢特征,发现人肝微粒体中产生的17种代谢产物中有16种都在斑马鱼模型中被鉴别出来,主要的代谢途径包括酯水解、甲基化、羟基化、烷基链水解和葡萄糖醛酸结合反应等。
在生物学上,斑马鱼基因与人类基因有一定的相似性,基因同源性高达87%,并且早期胚胎发育与人类极为相似,是一种可预测代谢物的脊椎动物模型[78],其包含的Ⅰ相代谢酶CYP450 和Ⅱ相代谢酶尿苷二磷酸葡萄糖苷酸转移酶和磺基转移酶对于研究合成大麻素在生物检材中的代谢情况至关重要,但目前在传统法医和临床实验室采用斑马鱼模型进行研究的较少,而且药物代谢研究通常需要养殖斑马鱼数天之后才能采集养殖池中的样本。另外,斑马鱼和人的代谢之间存在种属差异,进一步限制了该模型的广泛应用。
3.2.3 真菌秀丽线虫模型
真菌秀丽线虫模型也是一种研究合成大麻素代谢物的新方法[79-80],具有Ⅰ相和Ⅱ相代谢酶。一份关于真菌秀丽线虫代谢模型的研究报告[79]表明,该模型和人体在药物代谢方面具有高度相似性,主要的代谢途径包括羟基化、羧酸化、生成二氢二醇、氧化脱氟、N-脱烷基化、葡萄糖醛酸结合反应、硫酸化等反应。
WATANABE等[51-52,81-82]利用真菌秀丽线虫模型在代谢方面做了很多研究,并且对该孵育系统和人体内产生代谢物的相似性进行了评估。在对真菌秀丽线虫和人体内产生的代谢产物进行比较时,发现其代谢途径有相似之处,但又存在一定的差异。如JWH-018 在合成大麻素吸食者尿液中的两种主要代谢产物分别是N-(4’-羟基戊基)-JWH-018 和N-戊酸-JWH-018,而在真菌秀丽线虫模型中N-(4’-羟基戊基)-JWH-018 是主要的代谢产物,而N-戊酸-JWH-018 是次要代谢产物[52];AM-2201 在人体内产生的主要代谢产物是6’-羟基-吲哚-AM-2201 和N-(4’-羟基戊基)-AM-2201。虽然在真菌秀丽线虫模型中也检出了这些代谢产物,但信号相对较低,可能是由于缺乏氧化脱氟酶或其活性太低导致,人肝微粒体模型中同样缺乏氧化脱氟酶。通过该模型主要得到的是Ⅰ相代谢产物,而Ⅱ相代谢产物数据往往有限,但可以作为一个补充模型研究人体的合成大麻素代谢,对代谢情况进行表征。
真菌秀丽线虫模型为药物代谢研究的相关实验室提供了一种高通量、简便快捷、成本低的用于预测合成大麻素代谢途径的体内代谢模型,对养殖人员的专业程度要求低,且相关质谱碎片信息丰富,有利于对代谢物进行结构鉴定[83],是生产和分离代谢产物的有效模型。但在难以形成代谢参考标准的情况下,研究人员仅利用高分辨质谱的数据可能无法判断羟基在吲哚或吲唑上的具体位置。在培育孵化样本之前,该真菌模型中的药物代谢研究需要花费较长时间,而且大多数法医和临床实验室没有配备真菌秀丽线虫模型平台并且缺乏相关培育经验。尽管该模型中存在一些和人体相似的CYP450 酶,但在代谢方面还是存在一定的差异,这在一定程度上限制了真菌秀丽线虫模型的广泛应用。
综上所述,体内外代谢模型虽然可以模拟合成大麻素在体内的生物转化过程,系统反映合成大麻素在生物体内的代谢反应,但由于和人存在物种差异性,涉及的代谢相关酶具有差异,其应用具有一定的局限性。目前最常用和最成熟的体外孵育模型是人肝细胞和人肝微粒体模型,其具有高度的人体相关性,可以得到丰富的代谢产物数据,人肝细胞模型相比于人肝微粒体模型可以系统反映化合物在人体肝内的代谢情况,而合成大麻素在人肝微粒体模型中的生物转化率比人体内更高,也比原生肝细胞高。代谢软件获得的假阳性结果较多,需要相关研究人员具有一定的代谢理论知识和相关代谢经验,可结合代谢模型的各自特点完善合成大麻素在人体内代谢的指纹图谱。而人肝微粒体模型获取代谢数据简便快捷、成本低,已成为预测新型合成大麻素在人体内代谢途径的常见模型。
4 代谢物鉴定方法
4.1 气相色谱-质谱法
气相色谱-质谱法(gas chromatography-mass spec⁃trometry,GC-MS)是鉴定合成大麻素常用的方法,常将氦气作为载气,采用程序升温的方式将化合物进行分离。其中气相色谱-高分辨质谱能够测定目标物质的精确分子量,提供化学结构信息,对提取物中未知以及已知结构的化合物及其相关代谢物进行定性和定量分析。
GRIGORYEV 等[53]采用GC-MS 对金刚烷甲酰基吲哚类合成大麻素AB-001 进行了代谢位点和代谢途径的分析,对目标化合物进行了甲基化和三甲基硅烷化的衍生化处理,在尿液中初步鉴定出7 种代谢物,未检出母体化合物,但综合两个单羟基代谢产物和两个双羟基代谢产物的数据可以鉴别AB-001。SOBOLEVSKY 等[54]通过GC-MS 对金刚烷甲酰基吲哚类合成大麻素N-(1-金刚烷基)-1-戊基吲哚-3-甲酰胺(APICA)在人肝微粒体中的代谢产物进行了表征,结果表明,对于APICA 滥用检测的首选化合物是双羟基化和三羟基化的代谢产物。
4.2 LC-HRMS
合成大麻素类新精神活性物质及其相关代谢物大部分都是通过LC-HRMS 进行鉴别的,该技术同时结合了液相色谱的高分离能力和质谱的高灵敏度、高选择性。最常用的色谱柱是C18或C8柱,流动相的水相为甲酸或甲酸盐溶液,有机相为甲醇或乙腈,采用梯度洗脱程序。目前液相色谱法采用的分析柱内径一般为2~5 mm,内部填料粒径小于5 μm,相比于GCMS的样品制备相对简单,不需要衍生化处理,灵敏度更高,更加稳定,分析范围更广。高分辨质谱是目前最常用的工具,已成为表征不同生物基质中小分子、药物、代谢物结构的首选方法。如四极杆-飞行时间质谱仪和轨道离子阱质谱仪是分析代谢物结构的首选仪器,可以快速获得高灵敏度的全扫描质谱图和二级质谱图,有助于研究人员推测化合物及其相关代谢物的质谱裂解途径,从而确认代谢产物的结构。
ERRATICO 等[55]采用LC-HRMS 对N-(1-氨甲酰基-2-甲基丙基)-1-(环己基甲基)吲唑-3-甲酰胺(AB-CHMINACA)及其代谢物进行了分析鉴定,在体外模型人肝微粒体中共得到了26 种代谢产物,其中大部分也存在于AB-CHMINACA 吸食者的尿液中,这些代谢产物及其结构可以通过高分辨质谱进行鉴别。CASTANETO 等[42]通过LC-HRMS 分析了人肝细胞模型中AB-FUBINACA及其代谢物,共鉴定出11种代谢产物(2 种葡萄糖醛酸结合物),在真实尿样中进行验证,共鉴定出10 种代谢产物,主要的代谢途径是末端酰胺水解、酰基葡萄糖醛酸化和氨氧基丁烷部分的羟基化。MÖLLER 等[56]开发了一种基于酶水解、液液萃取和液相色谱-电喷雾串联质谱分析的常规筛选方法,并将该方法应用于约7 500份尿样的检测,证明该方法能够鉴别人尿液中的JWH-018及其代谢物。
LC-HRMS 可以准确检测离子峰的质荷比,是质谱检测的目标,也是质谱定性的关键,其可以有效鉴别出合成大麻素及其相关的碎片离子,从而实现代谢物的鉴定。同时,基于LC-HRMS 的非靶向筛选方法为研究人员提供了一种可追溯的数据储存方式,是目前代谢物鉴别中最常用的方法。
5 合成大麻素类物质的代谢规律
从合成大麻素的结构中可见,新型合成大麻素结构修饰的主要趋势是戊基吲哚或吲唑环的戊基末端氟原子-氢原子置换,这大大提高了化合物的生物活性[79]。WOHLFARTH 等[39]认为这些合成大麻素的代谢规律是相似的,就羟基化的代谢反应来看,非氟取代的合成大麻素优先在戊基侧链的末端和4’位发生羟基化,而5-氟类似物在侧链上的主要代谢反应是脱氟氧化、进一步羧酸化。然而,由于合成大麻素结构的不断修饰,这种代谢途径不一定会发生。基于上述代谢模型的相关代谢数据,归纳出合成大麻素的代谢规律:
(1)羰基键。含有羰基的合成大麻素如图1A 所示,发生的主要代谢途径是戊基侧链末端和4’位的羟基化,并进一步羧酸化和羰基化,这些生物转化也适用于含有脂肪族侧链的化合物。而含有氟戊基侧链的合成大麻素如图1B 所示,主要代谢途径是氧化脱氟、进一步羧酸化,这些代谢产物与相应的含有戊基侧链合成大麻素的代谢产物相同,其中含氟的单羟基化代谢产物(主要是吲哚环或吲唑环或4’位)可考虑作为代谢标志物。
(2)酯键。含有酯键的合成大麻素如图1C 所示,发生的主要代谢反应是酯水解,生成的羧酸化代谢产物丰度相对较高,戊基侧链或氟戊基侧链会进一步发生氧化反应,但氧化程度比有羰基键连接时低。对于含氟戊基吲哚环的合成大麻素如图1D 所示,主要的代谢反应也是酯水解,在侧链上几乎不会发生氧化脱氟反应。
(3)酰胺键。含戊基侧链的合成大麻素如图1E所示,主要的代谢途径是末端的酰胺水解为羧酸,并进一步在戊基侧链上羰基化。含氟戊基侧链的合成大麻素如图1F 所示,主要的代谢途径是末端酰胺水解为羧酸和氟戊基侧链的脱氟氧化,进一步氧化为羧酸。
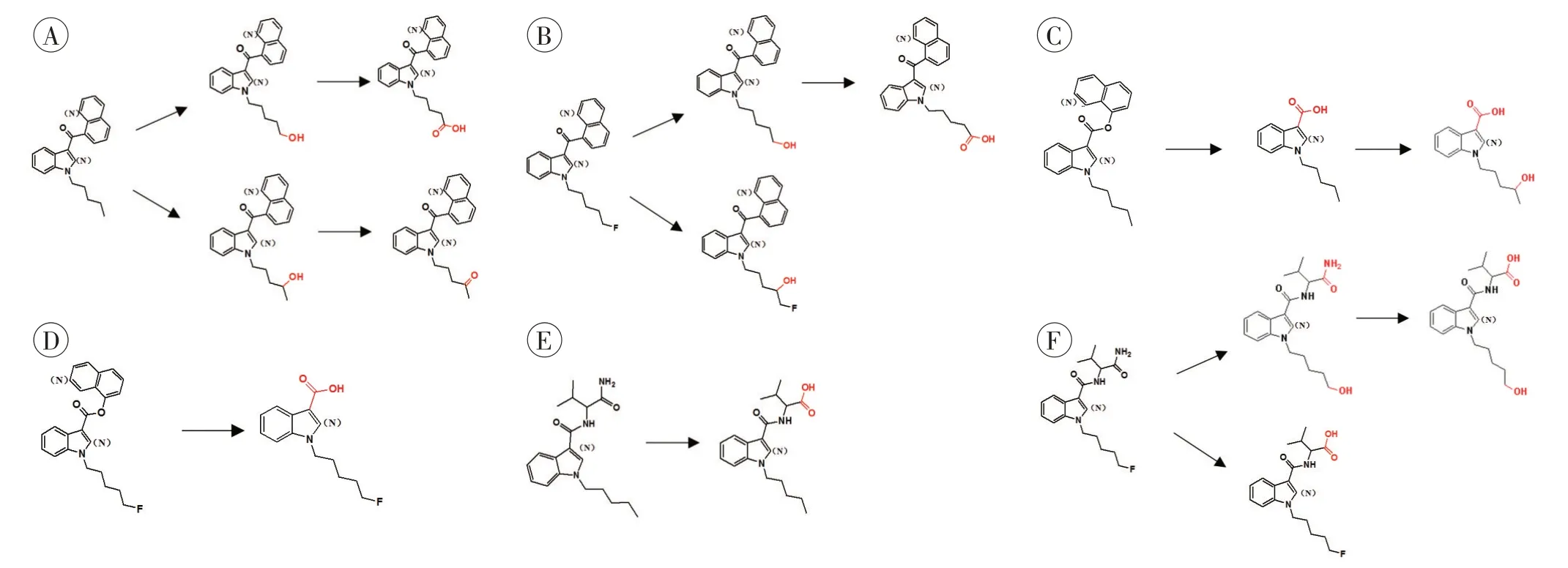
图1 合成大麻素的结构特点和代谢模式Fig.1 Structural characteristics and metabolic patterns of synthetic cannabinoids
6 结论
我国已经对合成大麻素进行了整类列管,由于新出现的合成大麻素人体数据不易及时获得,因此有必要通过代谢模型对合成大麻素及其相关代谢物进行系统研究。本文基于合成大麻素的结构和分类,代谢软件预测的代谢物数据,并结合体内外代谢模型、代谢物鉴定方法,总结出合成大麻素的相关代谢规律,以期为合成大麻素类新精神活性物质的摄毒鉴定及毒理学研究提供数据支撑。
