实时三维超声心动图联合二维斑点追踪显像技术评价冠状动脉慢血流患者左房结构及相位功能改变
2021-12-07邢雨蒙永乐德红舒先红潘翠珍
邢雨蒙 陈 永乐 孔 德红 颜 彦 舒先红, 潘翠珍,△
(1复旦大学附属中山医院心脏超声诊断科 上海 200032;2上海市影像医学研究所 上海 200032;3上海市心血管病研究所 上海 200032)
冠状动脉慢血流(coronary slow flow,CSF)是指冠状动脉造影(coronary angiography,CAG)时未见明显狭窄性病变,但血管远端出现血流充盈延迟的现象[1]。微血管及血管内皮细胞功能障碍、弥漫性血管粥样硬化、炎症反应、脂肪代谢紊乱以及血小板功能异常等可能在CSF 发生发展中起到作用[2-5]。研究认为左房大小及功能的改变是评估许多心血管疾病预后的可靠指标[6],因此早期识别CSF 患者左房功能变化具有重要意义。当前,很多学者认为CSF 患者存在左室重塑及功能受损[7-8],但关于CSF 对左房功能影响的研究尚不多见。因受肺静脉、左心耳形状、房间隔倾斜位置等解剖结构因素影响,传统二维超声在测量左房时具有局限性。 本研究旨在应用实时三维超声心动图(realtime three-dimensional echocardiography,RT-3DE)联合二维斑点追踪显像(two-dimensional speckle tracking imaging,2D-STI)定量 评估CSF 患者左房功能的早期改变。
资料和方法
研究对象选取2016年11月至2019年2月因胸痛在复旦大学附属中山医院行CAG 检查并确诊为CSF 的患者35例,剔除图像质量欠佳者3例,最终 纳 入32例 作 为CSF 组:男19例,女13例,年 龄36~68岁,平均年龄(55.63±7.56)岁。纳入标准:采用校正的TIMI 血流帧数法(the corrected thrombolysis in myocardial infarction frame count,cTFC),即至少存在1 支冠状动脉cTFC>27 帧,且病变血管狭窄程度<40%。排除标准:合并心律失常、心肌病、瓣膜病、左室射血分数(left ventricular ejection fraction,LVEF)<55%、冠状动脉扩张、先天性心脏病,既往心肌梗死及各种心脏手术史、恶性肿瘤、严重高血压、肝肾功能不全、血液及免疫系统疾病等。选取30例同一时期年龄、性别相匹配的CAG 检查结果正常者作为对照组(排除标准同前):男15例,女15例,年龄33~67岁,平均年龄(54.83±7.83)岁。
测量仪器使用Philips Epic 7c 彩色多普勒超声诊断仪(探头型号:S5-1 和X5-1,频率:2~4 MHz和1~5 MHz)采集图像,并配备Philips Qlab10.4 脱机分析工作站。
图像采集嘱患者左侧卧位,待其呼吸平稳后连接心电图并记录心率,使用S5-1 探头采集并存储心尖左室长轴观、心尖四腔观及心尖两腔观切面的超声图像(连续5 个心动周期),获取并记录以下超声参数:左房前后径(left atrial diameter,LAD)、左室舒张末期(left ventricular end-diastolic volume,LVEDV)及收缩末期容积(left ventricular end-systolic volume,LVESV)、LVEF(通过双平面Simpson 法获得)、二尖瓣舒张早期及舒张晚期血流峰值流速(E 值、A 值)及舒张早期二尖瓣环室间隔侧组织速度(e,值),通过计算得到E/A 及E/e,值。嘱患者平静呼吸后屏气,切换X5-1 探头并点击“full volume”模式获取连续4个心动周期上述切面的全容积图像。
图像分析将所有图像资料导入Philips Qlab10.4 工作 站。RT-3DE 图 像 分 析:选 择3DQ 模式,分别于左房心内膜面标记取样点,系统自动生成时间-容积曲线(图1),测量左房3 个时相(左室收缩期、左室舒张早期、左室舒张晚期)的容积,经体表面积标准化后得到左房最大容积指数(left atrial maximum volume index,LAVImax)、收缩前容积指数(left atrial pre-atrial contraction volume index,LAVIpreA)及最小容积指数(left atrial minimum volume index,LAVImin)。通过公式计算进一步得到:左房总射血分数(left atrial total emptying fraction, LATEF) = (LAVImax-LAVImin)/LAVImax;左房被动射血分数(left atrial passive emptying fraction, LAPEF) = (LAVImax-LAVIpreA)/LAVImax;左 房 主 动 射 血 分 数(left atrial active emptying fraction, LAAEF) =(LAVIpreA-LAVImin)/LAVIpreA。 2D-STI 图像分析:选择aCMQ 选项,分别于心尖四腔观和心尖两腔观切面绘制感兴趣区(将取样点标记于二尖瓣环左房侧壁、二尖瓣环房间隔侧及左房顶部),手动调节感兴趣区至最佳位置。系统自动生成应变、应变率曲线(图2),测量左房舒张早期、收缩期及舒张晚期的平均峰值应变(LAScd、LASr、LASct)及应变率(pLASRcd、pLASRr、pLASRct)。最后纳入统计分析的为两个切面获取的参数平均值。

图1 RT‐3DE 生成的左房容积曲线Fig 1 The volume curve of left atrium formed by RT‐3DE

图2 2D‐STI 生成的左房应变(A)及应变率(B)曲线Fig 2 The curves of LA strain(A)and strain rate(B)formed by 2D‐STI
重复性检验随机抽取20例入组对象,选取2名对试验方案不知情的主治医师分别进行RT-3DE及2D-STI 左房参数的测量(观察者间变异性),其中一名医师间隔2 周时间以相同步骤再次测量上述参数(观察者内变异性)。
统计学分析选择SPSS 22.0 软件进行统计分析,连续性变量用(±s)表示,分类变量用百分比表示。两组数据间的比较选择独立样本t检验(正态分布)或Wilcoxon 秩和检验(非正态分布)。率的比较采用χ2检验。左房参数之间的相关性采用Pearson 分析。 用组内相关系数(intraclass correlation coefficient,ICC)反映左房参数测量的可重复性。P<0.05 为差异有统计学意义。
结果
一般临床资料比较CSF 组与对照组的一般临床资料组间差异无统计学意义。与对照组CAG结果相比,CSF 组左前降支(left anterior descending branch,LAD)、左 回 旋 支(left circumflex artery,LCX)、右冠状动脉(right coronary artery,RCA)的TFC 值及三者之和除以3 获取的平均TFC 值(mean-TFC)均明显增大(P均<0.05,表1)。
表1 两组间一般临床资料及CAG 结果比较Tab 1 Comparison of clinical and angiographic characteristics between the two groups [n(%)or ±s]
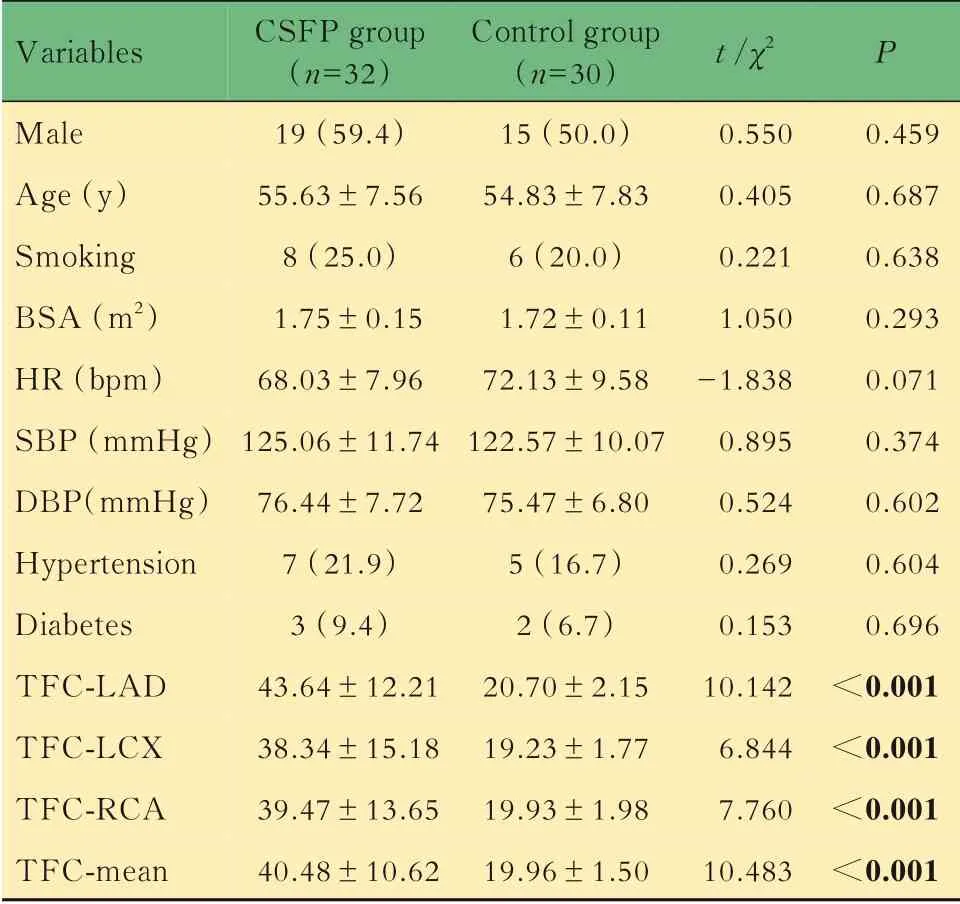
表1 两组间一般临床资料及CAG 结果比较Tab 1 Comparison of clinical and angiographic characteristics between the two groups [n(%)or ±s]
BSA:Body surface area;HR:Heart rate;SBP:Systolic blood pressure;DBP:Diastolic blood pressure;TFC:Thrombolysis in myocardial infarction frame count;LAD:Left anterior descending branch;LCX:Left circumflex artery;RCA:Right coronary artery.
Variables Male Age(y)Smoking BSA(m2)HR(bpm)SBP(mmHg)DBP(mmHg)Hypertension Diabetes TFC-LAD TFC-LCX TFC-RCA TFC-mean CSFP group(n=32)19(59.4)55.63±7.568(25.0)1.75±0.1568.03±7.96125.06±11.7476.44±7.727(21.9)3(9.4)43.64±12.2138.34±15.1839.47±13.6540.48±10.62 Control group(n=30)15(50.0)54.83±7.836(20.0)1.72±0.1172.13±9.58122.57±10.0775.47±6.805(16.7)2(6.7)20.70±2.1519.23±1.7719.93±1.9819.96±1.50 t /χ2 0.5500.4050.2211.050-1.8380.8950.5240.2690.15310.1426.8447.76010.483 P 0.4590.6870.6380.2930.0710.3740.6020.6040.696<0.001<0.001<0.001<0.001
超声参数比较两组间常规超声心动图参数LVEDV、LVESV、LVEF、LAD、E/A、E/e,差异均无统计学意义(表2)。RT-3DE 与2D-STI 参数:与对 照 组 相 比,CSF 组LAVImax、LAVIpreA、LAVImin 增 加,但LATEF、LAPEF、LASr、LAScd、pLASRr、pLASRcd 降低(P均<0.05,表3、4)。虽然CSF 组LAAEF、pLASRct 较对照组有所升高,但两组间差异无统计学意义。
表2 两组间常规超声心动图参数结果比较Tab 2 Comparison of conventional echocardiographic data between the two groups (±s)
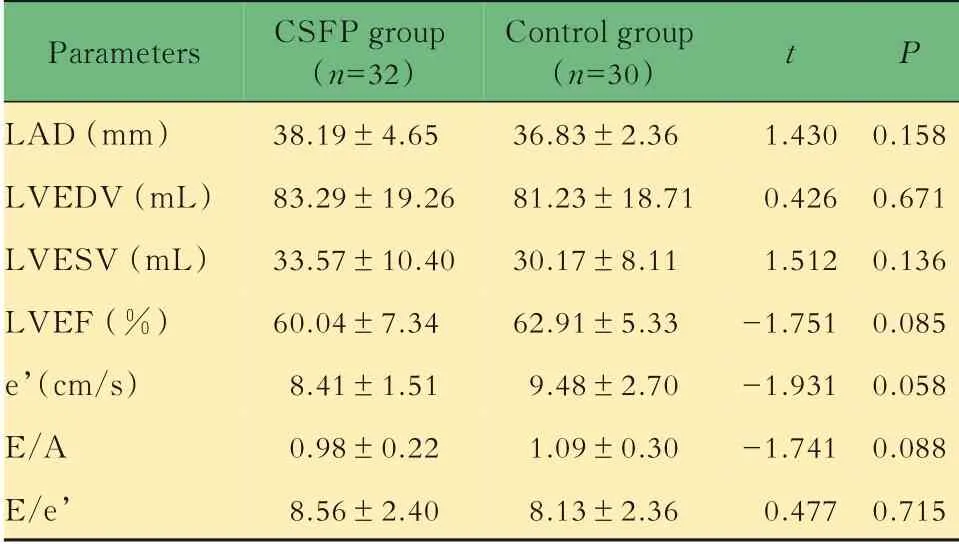
表2 两组间常规超声心动图参数结果比较Tab 2 Comparison of conventional echocardiographic data between the two groups (±s)
LAD:Left atrial diameter;LVEDV:Left ventricular end-diastolic volume;LVESV:Left ventricular end-systolic volume;LVEF:Left ventricular ejection fraction.
Parameters LAD(mm)LVEDV(mL)LVESV(mL)LVEF(%)e’(cm/s)E/A E/e’CSFP group(n=32)38.19±4.6583.29±19.2633.57±10.4060.04±7.348.41±1.510.98±0.228.56±2.40 Control group(n=30)36.83±2.3681.23±18.7130.17±8.1162.91±5.339.48±2.701.09±0.308.13±2.36 t 1.4300.4261.512-1.751-1.931-1.7410.477 P 0.1580.6710.1360.0850.0580.0880.715
表3 两组间RT‐3DE 参数结果比较Tab 3 Comparison of RT3DE data between the two groups(±s)
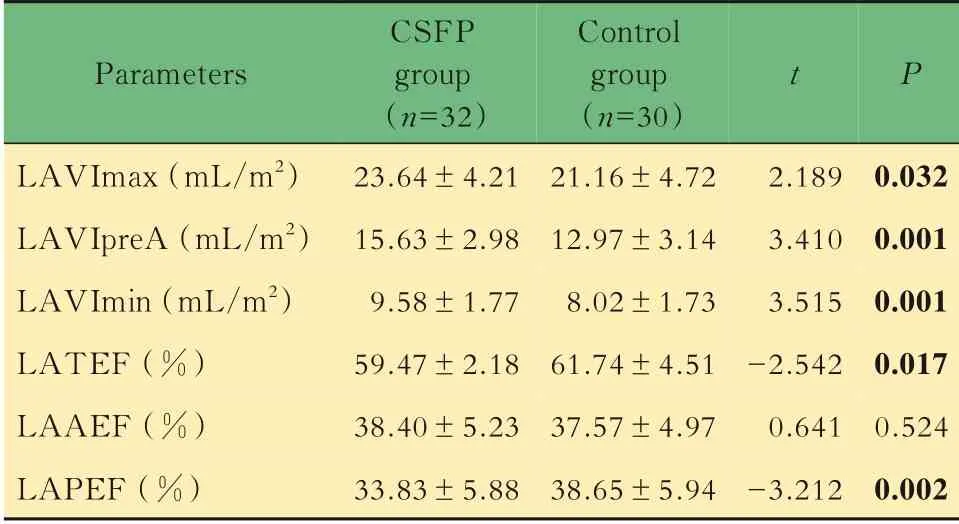
表3 两组间RT‐3DE 参数结果比较Tab 3 Comparison of RT3DE data between the two groups(±s)
LAVImax:Left atrial maximum volume index;LAVIpreA:Left atrial pre-atrial contraction volume index;LAVImin:Left atrial minimum volume index;LATEF:Left atrial total emptying fraction;LAAEF:Left atrial active emptying fraction;LAPEF:Left atrial passive emptying fraction.
Parameters LAVImax(mL/m2)LAVIpreA(mL/m2)LAVImin(mL/m2)LATEF(%)LAAEF(%)LAPEF(%)CSFP group(n=32)23.64±4.2115.63±2.989.58±1.7759.47±2.1838.40±5.2333.83±5.88 Control group(n=30)21.16±4.7212.97±3.148.02±1.7361.74±4.5137.57±4.9738.65±5.94 t 2.1893.4103.515-2.5420.641-3.212 P 0.0320.0010.0010.0170.5240.002
相关性分析Pearson 相关性分析提示,CSF 患者LATEF 与LASr、pLASRr(r=0.657 和0.400),LAPEF 与LAScd、pLASRcd(r=0.569 和0.745),LAAEF 与pLASRct(r=0.488)均 呈 正 相 关(P均<0.05)。
表4 两组间2D‐STI 参数结果比较Tab 4 Comparison of 2D‐STI data between the two groups(±s)
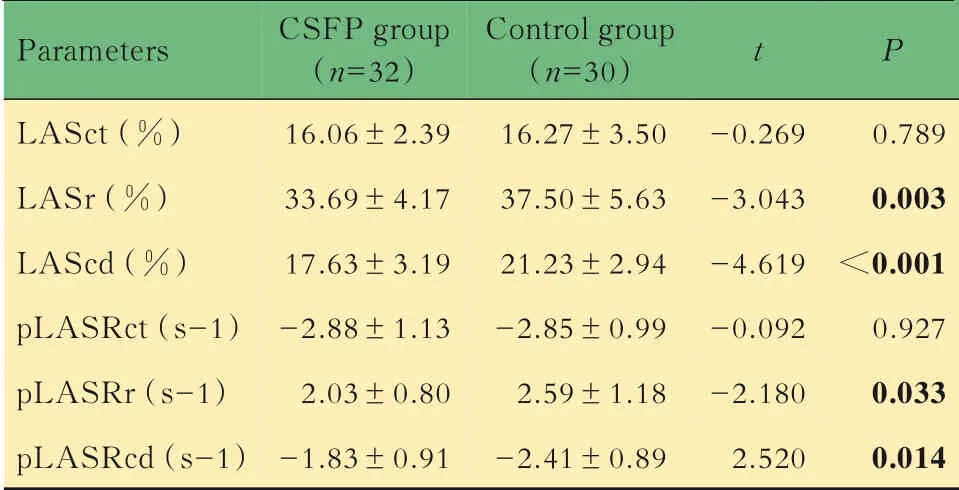
表4 两组间2D‐STI 参数结果比较Tab 4 Comparison of 2D‐STI data between the two groups(±s)
Refer to Fig 2.
Parameters LASct(%)LASr(%)LAScd(%)pLASRct(s-1)pLASRr(s-1)pLASRcd(s-1)CSFP group(n=32)16.06±2.3933.69±4.1717.63±3.19-2.88±1.132.03±0.80-1.83±0.91 Control group(n=30)16.27±3.5037.50±5.6321.23±2.94-2.85±0.992.59±1.18-2.41±0.89 t-0.269-3.043-4.619-0.092-2.1802.520 P 0.7890.003<0.0010.9270.0330.014
重复性检验观察者内左房参数的变异性测量值为:LAVImax(ICC=0.93)、LAVIpreA(ICC=0.91)、LAVImin(ICC=0.93)、LASr(ICC=0.94)、LAScd(ICC=0.91)、LASct(ICC=0.91)、pLASRr(ICC=0.94)、pLASRcd (ICC=0.93)、pLASRct(ICC=0.92);观察者间左房参数的变异性测量值为:LAVImax (ICC=0.89)、LAVIpreA (ICC=0.88)、LAVImin(ICC=0.89)、LASr(ICC=0.92)、LAScd(ICC=0.89)、LASct(ICC=0.91)、pLASRr(ICC=0.92)、pLASRcd (ICC=0.93)、pLASRct(ICC=0.89)。 以上数据提示通过RT-3DE 及2DSTI 获取的左房参数可重复性较好。
讨论
研究报道,在因胸痛行CAG 的患者中,CSF 的检出率为1%~7%,其中80% 以上的患者存在反复发作性胸痛,20% 左右因症状严重须再入院治疗[9-10]。虽然CSF 患者无明显冠脉狭窄,但临床中可出现反复心绞痛、急性心肌梗死、心律失常,甚至心脏猝死等不良事件[11-12]。左房在调节左室充盈压及维持正常心脏功能中具有重要意义,主要作用于以下3 个时相[13]:(1)储器功能,在心脏收缩期收集经肺静脉回流的血液;(2)传导功能,在舒张早期协助左房血液流入左室;(3)泵功能,在舒张末期心房收缩进一步促进左室充盈。因此,准确评估左房相位功能有助于了解疾病进展和预后。但由于长期缺乏关注,CSF 的病理学机制及其对左房的影响至今仍未阐明。
当前,临床中常采用双平面Simpson 法评估左房功能,但其应用具有局限性,如操作繁琐(需分别测量3 个时相的容积)、耗时且重复性较差。 RT-3DE 作为一项新技术,逐渐应用于左房容积及功能的评估中,其测量准确性高于传统二维超声且与心脏磁共振具有较好的一致性[14-15]。2D-STI 无超声角度依赖性,能通过定量评估心肌变形能力来反映心肌受损程度,研究发现2D-STI 获取的应变及应变率参数可定量评估左房相位功能,且测量结果与磁共振相 关性较高[16]。 本研究应用RT-3DE 联合2D-STI 定量评价CSF 患者左房3 个时相的功能,发现CSF 患者左房容积指数(LAVImax、LAVIpreA、LAVImin)均较对照组增大,提示CSF 患者左房发生重构。 与对照组相比,CSF 患者LATEF、LAPEF、LASr、LAScd、pLASRr、pLASRcd 均 降低,提示左房储器及传导功能均受损。研究认为弥漫性冠脉钙化、内膜增厚、冠脉血流储备受损都可能与CSF 心肌功能受损有关[17]。推测引起CSF 患者心房功能改变的机制可能为:随着心肌顺应性受损,为保持足够左室射血量,左房压增高以克服增高的左室舒张压,这一现象可导致肺静脉血流回流受阻,致使左房储器功能受损。此外,增加的左室僵硬度及左室内压共同阻碍左房血液流入左室,导致左房传导功能受损。随着左房内残存血量增多,左房逐渐松弛扩张,可能引起储器功能进一步降低。
本研究中,CSF 组的LAAEF、pLASRct 较对照组有增高趋势,但两组间差异无统计学意义,提示CSF 患者早期发生储器及传导功能受损时,泵功能可能发生代偿性改变。而Li 等[18]研究认为,CSF 患者存在LATEF、LAAEF 降低,LAPEF 虽较对照组有所降低,但未达到统计学差异,这一结果可能与两组研究选取的入组对象的冠脉受累支数及受累血管分布不同、冠脉血流帧数差异等有关。本研究具有一定的局限性,由于样本量较少且获取的左房参数未与心脏磁共振参数进行比较,CSF 对左房相位功能的影响及机制有待后期扩大研究样本量进一步证实。
综上所述,CSF 患者早期出现左房增大且储器功能及传导功能受损,泵功能可能出现代偿性增高。RT-3DE 与2D-STI 一致性较好,两者联合可更加方便、准确地定量评估CSF 患者左房结构及相位功能的早期改变。
作者贡献声明邢雨蒙 数据整理和分析,论文构思和撰写。陈永乐,孔德红 研究设计,图像采集。颜彦 临床入组对象筛选和数据收集。舒先红 可行性分析,图像整理。 潘翠珍 图像采集、整理和保存,论文指导。
利益冲突声明所有作者均声明不存在利益冲突。
