基于靶扫描和常规扫描CT 图像的影像组学模型预测肺磨玻璃结节的2年生长
2021-12-07薛丽敏强金伟陶广昱
薛丽敏 李 瀛 强金伟 于 红 张 玉 邓 林 陶广昱
(1上海市影像医学研究所 上海 200032;2复旦大学附属金山医院放射科 上海 201508;3上海交通大学医学院附属上海市胸科医院放射科 上海 200030)
肺癌是最常见的恶性肿瘤,其发病率和死亡率均高居恶性肿瘤首位,严重威胁着人类的健康和生命[1-2]。肺癌的早期诊断和治疗是降低死亡率的关键。近年来,随着低剂量CT 的广泛应用以及健康体检的普及,肺结节的检出率显著提高,给肺结节的管理带来巨大挑战。大多数持续存在的肺磨玻璃结节(ground-glass nodule,GGN)虽为肺腺癌或癌前病变,但大部分呈惰性生长,且非浸润性腺癌手术切除后的5年生存率近100%[3],因此仍需长期随访,这增加了GGN 的管理难度。
靶CT 扫描(targeted CT,T-CT)通过结合小扫描野和大矩阵,有效提高组织的空间分辨率,较常规CT 扫描(conventional CT,C-CT)更利于显示GGN 的影像学细节[4],已广泛应用于临床日常诊断中。影像组学能从影像学图像中深度挖掘信息,并寻找肉眼无法识别的疾病的细微结构特征,能够反映人体组织、细胞和基因水平的变化,从而对疾病的诊治提供帮助[5]。研究发现,基于GGN 患者TCT 图像的诊断较C-CT 图像更利于减少不必要的随访[6]。然而,基于T-CT 和C-CT 图像的影像组学模型预测GGN 2年生长的差异尚不清楚。
倍增时间常用于评估肺结节的生长速度,与体积倍增时间(volume doubling time,VDT)相比,质量倍增时间(mass doubling time,MDT)能同时反映结节大小和密度变化,因而能更敏感、更可靠地评估结节的生长速度[7]。Tan 等[8]基于VDT 区分肺结节的快速、慢速增长,并结合临床特征建立了影像组学模型以预测肺结节的生长速度。Yoon 等[9]选取结节边缘相关的影像组学特征建立了GGN 生长预测模型,但未考虑密度变化也是GGN 生长的一种 形 式。Qiu 等[10]根据GGN 直径 增 加和实性 成分出现定义纯GGN 生长,但未考虑GGN 密度增加但尚未出现实性成分的情况。因此,本研究基于GGN的直径、密度增加定义生长,通过比较基于T-CT 和C-CT 图像建立的影像组学特征集预测GGN 2年生长的效能,确定适当的建模扫描方案,进一步建立影像组学列线图来帮助管理GGN。
资料和方法
病例资料本研究经上海市胸科医院伦理委员会批准(批准文号:KS1956),免除患者知情同意。回顾性搜集上海市胸科医院PACS 系统中2018年10月—2019年1月肺GGN 随访患者的CT 图像及临床资料。纳入标准:(1)GGN 的最长径为4~30 mm;(2)同时有基线的T-CT 图像和C-CT 图像;(3)生长结节在2年内生长,未生长结节至少随访2年。排除标准:(1)图像有明显伪影;(2)随访期间行抗肿瘤治疗;(3)T-CT 图像未扫及随访的GGN。收集患者的基线年龄、性别,对其CT 图像进行分析,收集结节的毛刺征、胸膜凹陷征、肺气肿等特征。最终389例患者共414 个肺GGN 纳入本研究。
结节分组和生长定义将每个结节的基线T-CT图像和C-CT 图像分为T-CT 组和C-CT 组。将纳入的414 个GGN 按照7∶3 的比例随机分为训练组(n=290)和验证组(n=124)。根据GGN在2年内是否生长分为生长组和稳定组。“生长”定义为结节长径至少增加2 mm 和/或平均CT值至少增加30%[11-12]。“稳定”定义为结节大小和平均CT值均保持稳定。
扫描方法使用多层螺旋CT(Ingenuity 128,iCT 256,美国Philips 公司)进行扫描。 患者仰卧位,头先进,在吸气后屏住呼吸进行胸部C-CT 高分辨率扫描,扫描范围从肺尖至肺底。扫描参数:管电压120 kV,管电流250 mA,准直0.625 mm,螺距0.984,扫描时间5~7 s,视野(field of view,FOV)为400 mm×400 mm,图像矩阵为512×512,采用标准重建算法序列进行薄层重建,重建层厚和间隔均为1 mm,滤过函数C。发现病灶后,立即对病灶区域行T-CT 超高分辨率扫描,扫描参数:管电压为120 kV,管 电 流250 mA,准 直0.625 mm,螺 距0.641,扫描时间5~7 s,FOV 为180 mm×180 mm,图像矩阵为1024×1024,重建层厚和间隔均为1 mm,滤过函数C。观察的肺窗窗宽为1450 HU,窗位为-520 HU;纵隔窗窗宽为300 HU,窗位为35 HU。
结节分割将患者的CT 图像导入ITK-SNAP(3.8.0 版),调至肺窗后,基于横断位图像沿每层结节边缘手动勾画感兴趣区,生成体积感兴趣区(VOI)。首先由第一位医师对所有结节进行勾画。1 个月后,随机抽取30 个结节的图像,由第一位医师和第二位医师进行重复勾画,以评估影像组学特征的组内和组间可重复性。结节的生长特征和临床信息均对2 位医师行盲法处理。
影像组学特征提取和筛选使用Pyradiomics软 件(https://pypi. org/project/pyradiomics/)对勾画所得的肺结节T-CT VOI 和C-CT VOI 进行影像组学特征的提取和筛选,并采用图像生物标志物标准化倡议(IBSI)推荐的标准(https://arxiv. org/abs/1612.07003)对所有图像进行归一化处理,分别从每个GGN 的T-CT VOI 和C-CT VOI 图像中提取一阶、二阶、高阶、小波变换及高斯变换特征。将组内和组间相关系数<0.75 的特征去除后,进一步去除Pearson 相关系数>0.9 的冗余特征(若两个特征相关性较高,则去除具有最大平均绝对值相关性的特征),对保留下来的特征行进一步筛选:使用最小绝对收缩与选择算子(least absolute shrinkage and selection operator,LASSO)经10 倍交叉验证的方法得到最小误差λ,并根据λ 得到系数非零的影像组学特征。对最优影像组学特征进行线性拟合,根据各自加权系数,生成影像组学评分(radscore),以计算每个GGN 对应的radscore。
影像组学特征集构建和交叉预测根据训练组的最优影像组学特征,分别构建T-CT 和C-CT影像组学特征集(radiomics signature)模型以预测GGN 的2年生长。使用验证组数据分别对以上两个模型进行验证和交叉预测(用T-CT 模型预测CCT 数据;用C-CT 模型预测T-CT 数据),计算各自的AUC、敏感度和特异度。采用Delong 检验比较T-CT 和C-CT 影像组学特征集的预测效能,选取二者中表现较佳的模型进一步建立影像组学列线图。
影像组学列线图构建选取患者的临床资料(年龄、性别)以及影像科医师评估的影像学特征(胸膜凹陷征、毛刺征、肺气肿)作为临床特征;采用多因素二元逻辑回归分析在上述临床特征中筛选出GGN 2年生长的独立危险因子,并构建临床特征集(clinical signature);采用多因素逻辑回归的方法结合影像组学特征集和临床特征集,构建成影像组学列线图(radiomics nomogram)。使用验证组的数据对建立的训练组模型进行验证,分别计算AUC、敏感度和特异度以评估模型效能。 采用Hosmer-Lemeshow 试验绘制校准曲线来评估影像组学列线图在训练组和验证组中的拟合度和预测性能。
临床应用价值为评估影像组学的临床实用性,采用临床决策曲线比较不同概率阈值下分别基于3 个模型(影像组学特征集、临床特征集与影像组学列线图)决策时GGN 患者能获得的临床净收益。
统计学分析使用SPSS(26.0 版)和R 软件(3.0.1 版)。采用独立样本t检验比较生长组和稳定组,训练组和验证组之间连续变量的差异性。采用χ2检验比较各组间分类变量的差异。P<0.05 为差异有统计学意义。 采用“glmnet”软件包进行LASSO 回归分析、线性回归分析以及Logistic 回归分析,以筛选影像组学特征及临床特征。 采用“rms”软件包进行列线图、刻度曲线绘制,采用“pROC”软件包计算AUC,采用“dca.R”软件进行决策曲线分析。
结果
临床资料本研究最终纳入389例患者共414个肺GGN,基线最长径为6~26 mm,其中72 个结节最终经手术切除。2年内生长的GGN(生长组)为88 个,保持稳定的GGN(稳定组)为326 个。生长组中,65 个GGN 仅 大 小 改 变,8 个GGN 仅 密度 增 高,15 个GGN 同时发生大小和密度改变。研究的流程图见图1。生长组和稳定组,训练组和验证组的临床特征见表1。所有临床特征在训练组和验证组之间差异均无统计学意义。年龄、性别、胸膜凹陷征、毛刺征在生长组和稳定组之间差异有统计学意义(P<0.05)。

图1 研究流程图Fig 1 The workflow of the study
表1 不同组别GGN 的临床特征Tab 1 Clinical features in different GGN groups [n(%)or ±s]
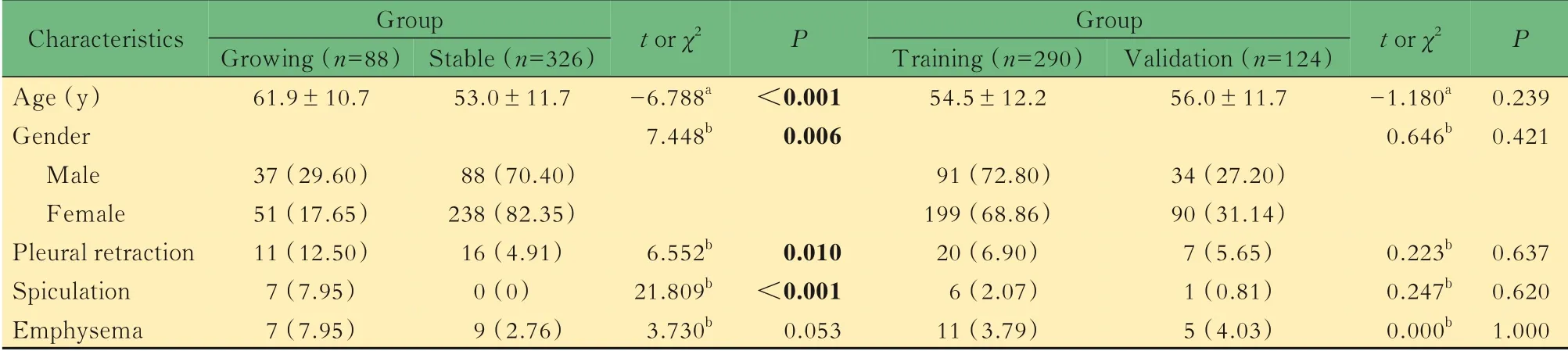
表1 不同组别GGN 的临床特征Tab 1 Clinical features in different GGN groups [n(%)or ±s]
a t value;b χ2 value.GGN:Ground-glass nodule.
Characteristics Age(y)Gender Male Female Pleural retraction Spiculation Emphysema Group Growing(n=88)61.9±10.737(29.60)51(17.65)11(12.50)7(7.95)7(7.95)Stable(n=326)53.0±11.788(70.40)238(82.35)16(4.91)0(0)9(2.76)t or χ2-6.788a 7.448b 6.552b 21.809b 3.730bP<0.0010.0060.010<0.0010.053 Group Training(n=290)54.5±12.291(72.80)199(68.86)20(6.90)6(2.07)11(3.79)Validation(n=124)56.0±11.734(27.20)90(31.14)7(5.65)1(0.81)5(4.03)t or χ2-1.180a 0.646b 0.223b 0.247b 0.000b P 0.2390.4210.6370.6201.000
特征提取、筛选和影像组学特征集构建GGN的基线T-CT VOI 和C-CT VOI(图2)各提取1317个影像组学特征,经特征筛选后,分别筛选出7 个和6个最优影像组学特征(图3),由此构建成T-CT 和CCT 影像组学特征集以预测GGN 的2年生长,并分别计算两组的radscore值,radscore公式见附加文件。

图2 T‐CT 和C‐CT 扫描的GGN 图像对比Fig 2 Comparison of GGNs shown by C‐CT and T‐CT
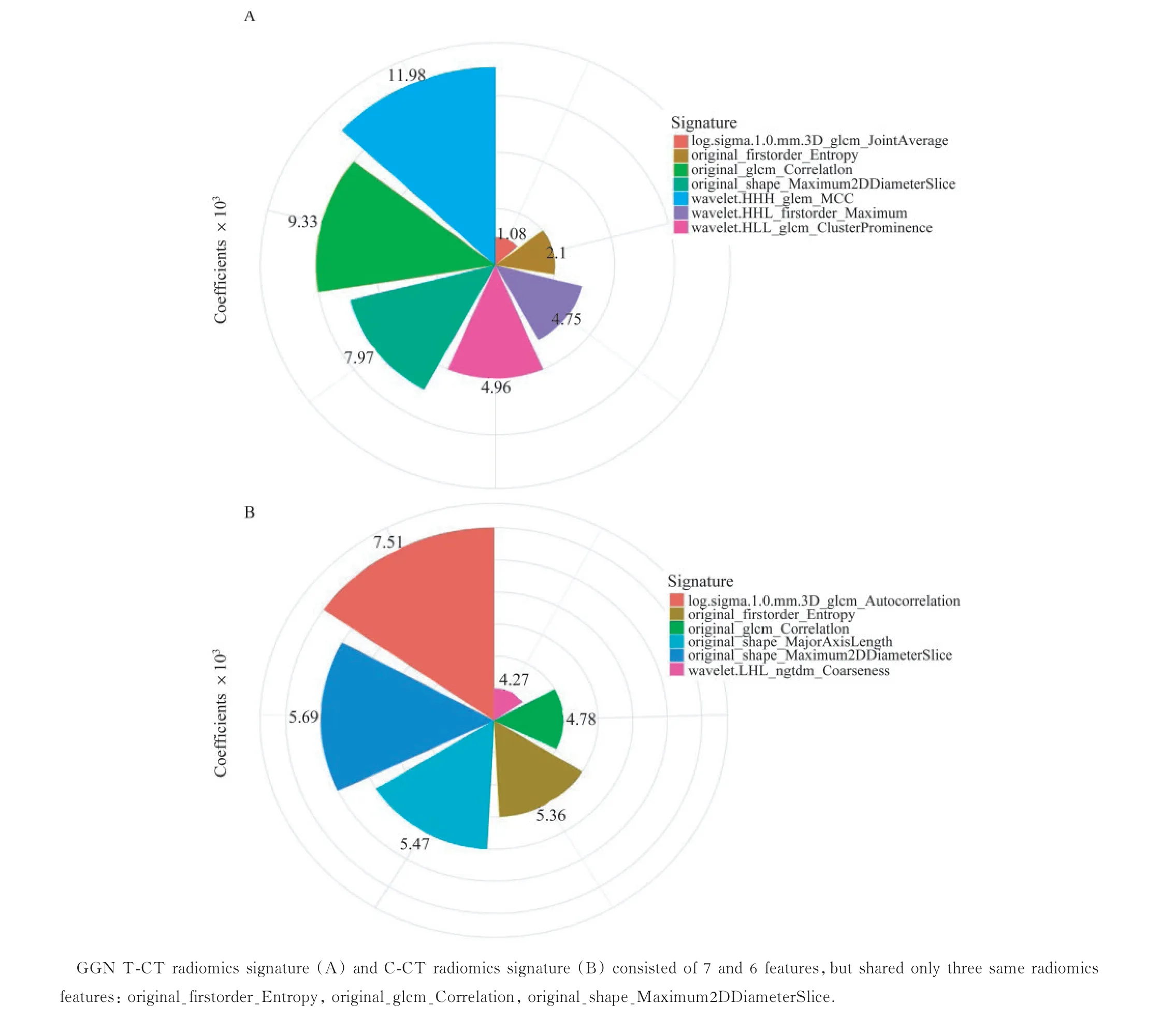
图3 筛选的影像组学特征及其系数Fig 3 Selected radiomics features and their coefficients in GGN
影像组学特征集效能、交叉预测效能T-CT和C-CT 影像组学特征集在训练组和验证组中的预测效能、T-CT 影像组学特征集预测C-CT 数据的效能、C-CT 影像组学特征集预测T-CT 数据的效能如表2 所示。Delong 检验比较各模型的预测结果如表3 所示。T-CT 和C-CT 影像组学特征集预测GGN 2年生长的AUC 无显著性差异。考虑到C-CT 在临床中应用更广泛,本研究最终选取C-CT 影像组学特征集,并结合临床特征进一步构建影像组学列线图。采用C-CT 影像组学特征集对T-CT 图像进行2年生长预测时,与采用C-CT 影像组学特征集对C-CT 图像进行验证的AUC 差异无统计学意义,与采用T-CT 影像组学特征集对T-CT 图像进行验证的AUC 差异无统计学意义。
临床特征集、影像组学列线图预测效能多因素Logistic 回归分析显示:年龄、性别和毛刺征是GGN 2年生长的独立危险因素。结合影像组学特征集与独立危险因素,构建影像组学列线图以预测GGN 2年生长(图4、5)。校正曲线显示其预测结果和实际结果一致(附加文件)。临床特征集、影像组学列线图在训练组和验证组中预测GGN 2年生长的效能见表2。无论是在训练组还是验证组中,影像组学列线图均具有最高的AUC。但影像组学列线图与C-CT 影像组学特征集的AUC 无显著性差异(表3),独立危险因素的结合未能显著提高模型的预测效能。
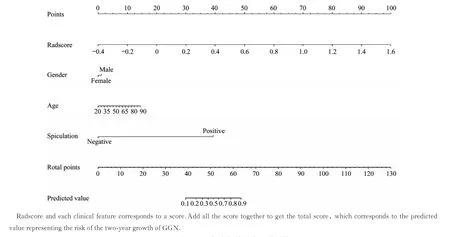
图4 预测GGN 2年生长的影像组学列线图Fig 4 Radiomics nomogram for predicting the two‐year growth of GGN

表2 各模型的预测GGN 2年生长的效能Tab 2 Prediction efficiency of the two‐year growth for GGN in each model

表3 各模型预测GGN 2年生长的AUC 比较Tab 3 AUC comparisons in predicting the two‐year growth of GGN by different models
临床实用性临床决策曲线显示,在一定概率阈值下,相较于“全干预”或“零干预”的处理方法,影像组学特征集和影像组学列线图均能有效预测GGN 2年生长,提高患者临床净收益。在大多数概率阈值下,相较于影像组学特征集,基于影像组学列线图的决策能使患者获得更高的临床净收益(图6)。

图6 临床决策曲线分析模型的净收益Fig 6 Clinical decisive curve for analyzing the net benefit of models
讨论
近年来,低剂量CT 肺癌筛查的普遍应用显著提高了肺GGN 的检出率,同时肺GGN 的管理面临更大挑战。为优化肺GGN 的管理,本研究构建了基于小视野超高分辨率的T-CT 和常规高分辨率N-CT 扫描图像构建的影像组学特征集,并比较了两者预测GGN 2年生长的效能,有助于选取合理的随访手段,同时结合年龄、性别和毛刺征3 个临床特征进一步构建了影像组学列线图,实现了对GGN无创性个体化2年生长预测,减少了不必要的随访,具有临床应用价值。
Fleischner 学会2017 版指南建议:6 mm 以上的GGN 随访至少5年以监测其变化。但研究发现部分<6 mm 的GGN 虽在5年随访期间保持稳定,但5年后仍会生长[13]。因此,无论何种大小的GGN,>5年的长期随访皆有必要。尽管指南根据结节的直径、类型及危险因素推荐了不同随访间隔(3~6 个月、6~12 个月或18~24 个月),在一定程度上减少了不必要的随访,但>5年(甚至10年)的长期随访导致患者过度辐射暴露、经济负担增加。因此,长期管理GGN 中如何合理减少CT 扫描随访至关重要。

图5 影像组学列线图在临床中的使用Fig 5 Application of the radiomics nomogram in clinical practice
本研究中,T-CT 和C-CT 影像组学特征集分别由7 个和6 个最优影像组学特征构建,两组中只有3个特征相同。 而国外学者发现CT 像素大小不同时,近80% 的影像组学特征在患者内的变异性大于在患者间的变异性[14]。因此,我们认为CT 像素大小不同导致的患者内影像组学特征差异可能是本研究两组模型部分特征不同的主要原因。虽然TCT 和C-CT 的最优影像组学特征不完全相同,但预测GGN 2年生长的效能相仿,且C-CT 模型预测TCT 和T-CT 模型预测C-CT 的效能也相仿。因此,我们认为随访GGN 可不必额外行T-CT,采用CCT 图像即足以预测GGN 的生长;即使患者仅提供T-CT 图像,也能采用C-CT 影像组学特征集预测GGN 的2年生长。这不仅减少了额外T-CT 带来的辐射暴露,同时缩短了患者的检查时间,减少了图像存储负荷,提高了检查效率。考虑到部分与GGN生长相关的影像学特征难以勾画进VOI(如毛刺征等),因此也被纳入临床特征中。从临床特征中,我们筛选出年龄、性别和毛刺征3 个特征为GGN 2年生长的独立危险因素,这与部分学者的研究结果类似[13,15]。肺癌发病率随年龄段增加而增加[16],表皮生长因子受体突变多见于男性,与GGN 的生长速度呈正相关[17-18],这可能是男性较女性GGN 更易生长的原因。毛刺征由肿瘤的浸润部分对周围组织牵拉形成,能够反映肿瘤的浸润程度,而恶性程度高的GGN 生长速度较恶性程度较低者快,因此毛刺征可能与GGN 生长相关。
最近一项研究结果与本研究结果有所不同,Tao 等[19]比较了基于不同像素的图像建立的影像组学特征集预测GGN 的浸润性,发现3 组模型中几乎无共同的影像组学特征,而像素最小(即扫描矩阵大)的模型具有最高的诊断效能(P<0.05)。本研究的目的是利于基线GGN 图像预测其2年中是否生长,不同的研究目的可能导致不一致的结果。 其次,文献报道的研究对象是经病理证实的GGN,尽管其中部分为病理证实的良性病变,但包含的恶性征象可能较多,而良性征象较多的病变可能未行手术切除。而我们的研究对象是随访的GGN,仅部分经手术切除,恶性征象相对较少,这可能是导致结果不同的主要原因。 此外,我们的研究样本量更大,同时结合临床特征,提高了模型的临床净收益。
本研究存在以下不足:(1)本研究基于回顾性单中心、单一厂商和CT 设备,可能会影响模型的稳健性和普适性。未来需要收集多中心、多设备的样本来验证模型。(2)本研究评估结节生长是基于结节最长径和密度的变化,相比之下,基于体积或质量来监测结节生长更为敏感[7,20]。
综上所述,我们采用临床应用更广泛的C-CT影像组学特征集结合临床特征进一步建立影像组学列线图以预测GGN 的2年生长,虽然模型效能无显著提高,但患者临床净收益得到提高,因此具有临床应用价值。通过列线图计算GGN 2年生长预测值,有助于合理减少随访,将有效帮助管理GGN:低预测值的GGN 患者可延长随访间隔;高预测值的GGN 患者则应尽早穿刺或手术切除,以减少不必要的随访。
作者贡献声明薛丽敏 科研设计,数据采集和分析,图表绘制,论文撰写和修订。李瀛 科研设计,数据分析,图表绘制,可行性分析,论文修订。强金伟 研究设想,可行性分析,监督指导,论文修订。于红 可行性分析。张玉,邓林,陶广昱 数据采集和整理。
利益冲突声明所有作者均声明不存在利益冲突。
