背角无齿蚌硒谷胱甘肽过氧化物酶基因的克隆及2,4-二氯苯酚、2,4,6-三氯苯酚和五氯苯酚对其表达的影响
2021-12-07袁凤娟魏梦薇张慧子王雯邵向阳李媛董艳美王梦琪齐金旭夏西超
袁凤娟,魏梦薇,张慧子,王雯,邵向阳,李媛,董艳美,王梦琪,齐金旭,夏西超
平顶山学院医学院,平顶山 476000
氯酚类化合物(pentachlorophenol, PC)广泛应用于农药、木材防腐剂和个人护肤品等工农业生产中。与此同时,氯酚类化合物是焚烧炉排放气体中二噁英和多环芳烃的最直接前体[1]。目前,氯酚类化合物在地表水、地下水、污水和饮用水中都被不同程度检测到,其可通过食物链放大效应在生物体内呈现持久性的蓄积效应,对个体生长、发育和繁殖带来潜在的干扰作用,氯酚类化合物毒性机制研究已备受关注[2]。在氯酚类化合物中,2,4-二氯苯酚(2,4-DCP)、2,4,6-三氯苯酚(2,4,6-TCP)和五氯苯酚(PCP)大量存在于水体中,对水生生物和人类具有潜在的健康风险,并被国际上列入持久性优先控制污染物[3]。目前,2,4-DCP、2,4,6-TCP和PCP普遍存在于我国的河流之中,其中PCP最为广泛[4]。研究证实,这些氯酚可以诱发水生生物的氧化应激、生殖毒性和内分泌紊乱[5]。氯酚诱发线粒体中氧化磷酸化解偶联和活性氧自由基(ROS)生成是其主要毒性作用机制之一[5-6]。在健康生物个体中ROS保持相对较低的水平,并且ROS生成后会被抗氧化酶迅速清除。
谷胱甘肽过氧化物酶(glutathione peroxidase, GPx)是一类广泛存在于生物体内的重要抗氧化酶,可将有毒的过氧化物还原成无毒的羟基化合物,保护细胞膜结构及功能不受过氧化物干扰及损害,进而参与生物体内氧化还原稳态的调控过程。GPx主要包括含硒GPx(SeGPx)和不含硒GPx这2种类型。SeGPx可以还原有机和无机氧化物,能够将过氧化氢(H2O2)还原为H2O;不含硒GPx只能还原有机氧化物[7]。双壳类是软体动物一个重要类群,常年栖息在海洋、河流和湖泊底部,以滤食生活为主,是检测环境污染的重要指示性生物[8-9]。这些动物发育至成体后不做长距离迁移并在一个区域生活多年,完成生长、成熟和繁殖[8-9]。与其他水生生物相比,双壳类动物在水体中污染物检测中更具有代表性[8-9]。背角无齿蚌(Anodontawoodiana)广泛分布于世界各地的淡水环境,在持久性有机污染物、杀虫剂和重金属等水环境污染检测中常用作指示性生物;同时在水体净化、颗粒物过滤、营养释放和沉积物混合等方面也发挥着积极作用[10]。随着水体污染的加剧,背角无齿蚌数量显著减少,已在北美地区被列入濒危生物。为了深入认识2,4-DCP、2,4,6-TCP和PCP对水生生物的毒性机制,本研究从背角无齿蚌分离出完整的SeGPx基因序列并命名为AwSeGPx,分析2,4-DCP、2,4,6-TCP和PCP对肝胰腺中AwSeGPx表达的影响,为揭示2,4-DCP、2,4,6-TCP和PCP毒理学效应提供理论参考。
1 材料与方法(Materials and methods)
1.1 材料
背角无齿蚌购自南阳市水产市场,2,4-DCP、2,4,6-TCP、PCP和二甲亚砜(dimethyl sulfoxide, DMSO)购自Sigma-Aldrich公司,2,4-DCP、2,4,6-TCP和PCP溶解于DMSO中以制备储备液。TRIzol试剂、M-MLV反转录酶、菌株DH5α、克隆载体pMDl9-T、连接酶、PCR产物回收纯化试剂盒、RACE试剂盒均购自宝生物生物科技有限公司,其余常规药品均为进口或国产分析纯。
背角无齿蚌壳长6.5 cm±0.5 cm,置于实验室自动水循环系统中适应养殖2周,期间停止进食。随后,动物处理实验在长方体的塑料盒(长×宽×高:40 cm×25 cm×10 cm)中进行,每个盒子里面8只河蚌,饲养采用人工模拟池塘水(每1 L去离子水中含48 mg NaHCO3、33 mg CaCl2·2H2O、60 mg MgSO4·7H2O和0.5 mg KCl),喂食小球藻(Chlorellavulgaris)[10]。为了确定AwSeGPx基因的组织分布,对来自同一塑料盒内5只动物进行解剖,取斧足、鳃、肝胰脏、闭壳肌、心脏和外套膜等组织,每个蚌每一个组织提取3次RNA,进行3次qPCR,取平均值,5个平均值加和后再次平均为AwSeGPx在该组织中的表达水平。
动物处理实验过程中,640只河蚌动物分为对照组、2,4-DCP处理组(60、120、240、480和960 μg·L-1)、2,4,6-TCP处理组(50、100、200、400和800 μg·L-1)和PCP处理组(20、40、80、160和320 μg·L-1),对照组用同体积去离子水处理。为确保动物有足够数量取材,每一组设置5个平行盒子,每个盒子8只河蚌,分别在0、6、12、24和48 h时于每组中取出5只河蚌,解剖,液氮速冻,于-80 °C保存。
1.2 总RNA提取与cDNA模板制备
按照试剂盒说明书的要求,使用TRIzol法(Takara,大连)提取总RNA。用1.0%琼脂糖凝胶电泳检测RNA质量。用M-MLV第一链cDNA合成试剂盒(Takara,大连)合成第一链cDNA,作为PCR扩增反应的模板。
1.3 AwSeGPx全基因序列的克隆
根据双壳纲、腹足纲、昆虫纲、甲壳纲和脊椎动物在内其他物种的SeGPx保守区域设计简并引物SeGPx1和SeGPx2,用于扩增AwSeGPxcDNA片段,将PCR产物克隆到pMDT-19(Takara,大连),采用双向测序,鉴定为SeGPx部分序列。以部分cDNA序列设计特异引物(表1),根据RACE试剂盒说明书,采用巢式PCR方法扩增AwSeGPxcDNA的5’和3’区域。扩增产物克隆载体、双向测序、序列比对和拼接。
1.4 序列与系统发育的分析
在GenBank数据库(www.ncbi.nlm.nih.gov/blast)中采用BLAST方法对AwSeGPx序列进行了比对和分析;采用DANMEN软件对AwSeGPx基因进行多序列比对;采用信号肽预测数据库(http://www.cbs.dtu.dk/services/SignalP)对AwSeGPx信号肽序列进行预测;采用SMART数据库(http://smart.embl-heidelberg.de/)对AwSeGPx蛋白质二级结构域进行预测;采用SWISS模型(http://swissmodel.expasy.org/)对AwSeGPx的三维结构进行预测;用MEGA 5.0邻位连接方法,构建AwSeGPx系统进化树。

表1 实验过程中的引物Table 1 Description of the primes used in this study
1.5 real-time PCR定量检测AwSeGPx的表达
为了确定AwSeGPx转录水平,采用SYBR Premix Ex TaqTM试剂盒并按照说明书的要求进行定量分析。根据已有贝类内参基因研究结果,选取β-actin作为内参基因[10-11],根据内参基因和AwSeGPx特异引物分别分离对应序列(表1),琼脂糖凝胶电泳仅检测出一个扩增条带,PCR产物回收、测序、鉴别;结合熔解曲线和扩增曲线结果确定内参基因和目的基因表达的特异性和高效性。使用ABI7500实时检测系统(Applied Biosystems,美国)采用两步法,进行real-time PCR,构建标准曲线,通过2-△△CT分析AwSeGPx表达水平。
1.6 统计学处理
2,4-DCP、2,4,6-TCP和PCP处理后AwSeGPx表达水平的差异采用单向方差分析(analysis of variance, ANOVA),P<0.05为差异有统计学意义。
2 结果(Results)
2.1 背角无齿蚌AwSeGPx分子结构
背角无齿蚌AwSeGPxcDNA全长由870个核苷酸组成(GenBank NO, KU821031),包含一个36 bp的5’非翻译区(UTR)、69 bp的3’UTR。开放阅读框由585 bp核苷酸组成,编码195个氨基酸的多肽链,分子量为22.04 kDa,理论等电点为8.70(图1)。

图1 背角无齿蚌AwSeGPx基因的cDNA序列和推导的氨基酸序列注:起始和终止密码用粗体标示,终止信号“AATAAA”用波浪线标示,硒代半胱氨酸(U44)氨基酸残基用方框标示,GPx标签序列 (68LGFPCNQF75)和活性位点(156WNFEKF161)结合区域用灰色阴影标示,预测的硒插入片段(SECIS)用斜体标示, 谷胱甘肽结合位点的精氨酸(R94, R151)用加粗下划线标示,催化的谷氨酰胺(Q74)和色氨酸(W156)用加粗并方框标示。Fig. 1 Nucleotide and deduced amino acid sequences of AwSeGPx of Anodonta woodianaNote: The start and stop codons are indicated with bold; putative polyadenylation signal “AATAAA” is showed with wavy line; the selenocysteine (U44) are marked with box; the GPx signature motif (68LGFPCNQF75) and active site motif (156WNFEKF161) are highlighted with shadow; the predicted SECIS element in the 3’UTR is marked with italic; the arginine residues (R94, R151) involved in binding glutathione are marked with underline and bold; catalytically important residues of Gln (Q74) and Trp (W156) are bold in a box.
终止信号(AATAAA)在3’UTR的838~843位点处。AwSeGPx氨基酸序列的第44位氨基酸为特殊的硒代半胱氨U(165TGA167),这是SeGPx家族的主要特征。SignalP 3.0程序运行结果显示,AwSeGPx的预测氨基酸序列中没有信号肽(图1)。
AwSeGPx的N端区域由一个包含8个氨基酸(68LGFPCNQF75)的保守结构域和1个谷胱甘肽过氧化物酶家族的活性位点(156WNFEKF161)(图2)。固定硒元素的谷氨酸氨基酸残基和1个色氨酸氨基酸残基,以及负责将底物谷胱甘肽转运至GPx催化中心的2个精氨酸残基(R94, R151)(图2)。
AwSeGPx与其他物种SeGPx序列具有高度的相似性,AwSeGPx蛋白质二级结构包含7个α-螺旋和7个β-折叠(图3(a))。AwSeGPx三维结构排列和其物种SeGPx序列三维结构排列有很高的相似性,尤其是人的SeGPx序列(图3(b))。
2.2 AwSeGPx插入片段(SECIS)预测
用SECISearch 2.19软件预测背角无齿蚌AwSeGPx基因的3’-UTR有101 bp的硒代半胱氨酸插入片段(SECIS),形成一个茎环状的二级结构(图4(a))。与盘鲍(Haliotisdiscusdiscus)SeGPx硒代半胱氨酸插入片段相比,相似度很高,都属于二型硒插入片段,背角无齿蚌硒代半胱氨酸插入片段含有一个顶环,2个内环,2个折叠,保守的腺嘌呤(AA)在内环上。5’茎序列为UAUGAU,内环序列3’茎序列为UGA(图4(b))。

图2 背角无齿蚌AwSeGPx与其他物种SeGPx序列多重比对注:GPx标签序列(68LGFPCNQF75)和活性位点(156WNFEKF161)结合区域用灰色阴影标示,硒代半胱氨酸(U44)氨基酸残基用粗体 并下划线标示,负责催化的谷氨酰胺(Q74)和色氨酸(W156)用粗体标示,谷胱甘肽结合位点的精氨酸(R94, R151)用下划线标示。Fig. 2 Multiple alignment of AwSeGPx of Anodonta woodiana with other SeGPxNote: The GPx signature motif (68LGFPCNQF75) and active site motif (156WNFEKF161) are marked with shadow; the selenocysteine (U44) are bold with underline; catalytically important residues Gln (Q74) and Trp (W156) are indicated with bold; the arginine residues (R94, R151) involved in binding glutathione are marked with underline.
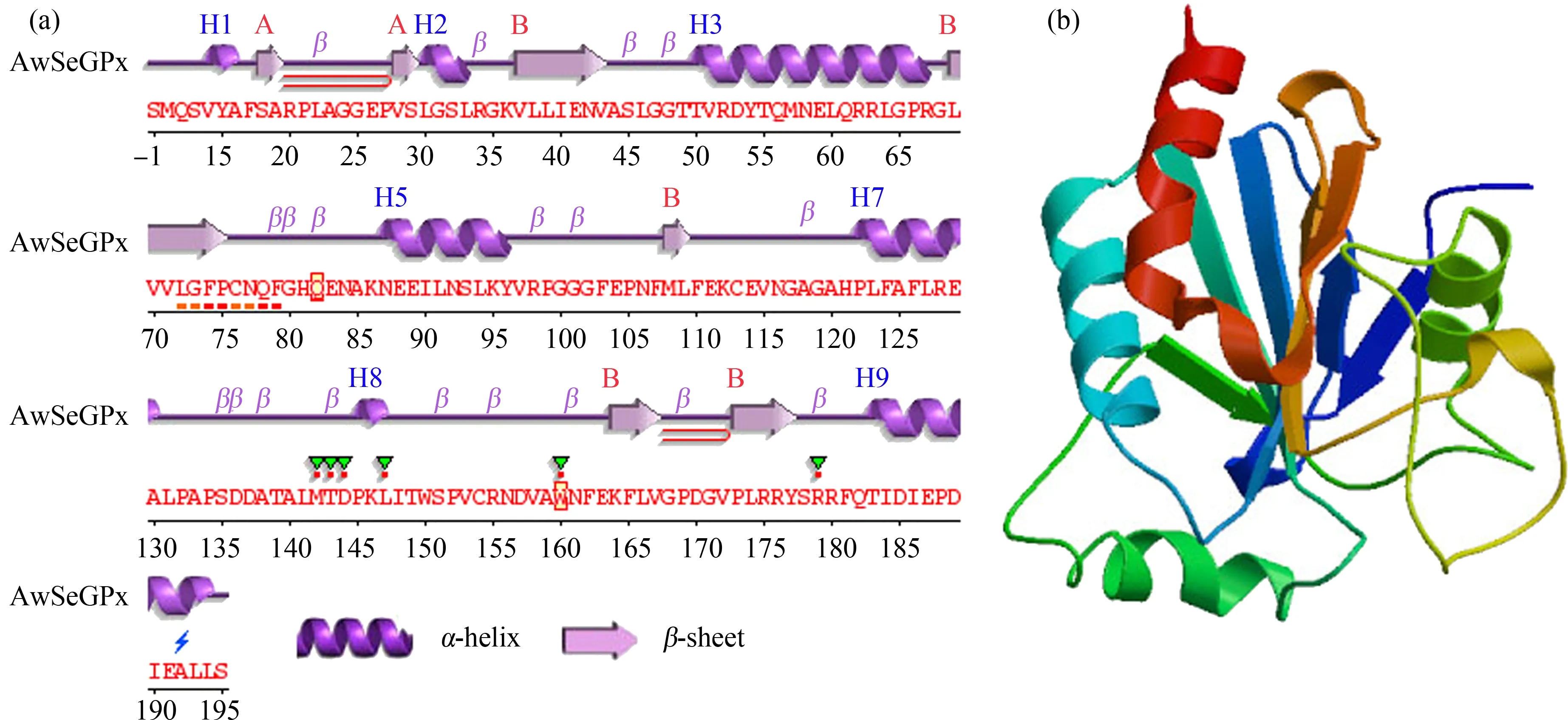
图3 背角无齿蚌AwSeGPx二级和三维结构预测注:(a) AwSeGPx二级结构;(b) AwSeGPx的三维结构。Fig. 3 Predicted secondary and 3D structures of AwSeGPx deduced amino acids of Anodonta woodianaNote: (a) Secondary structure of AwSeGPx; (b) 3D structure of AwSeGPx.
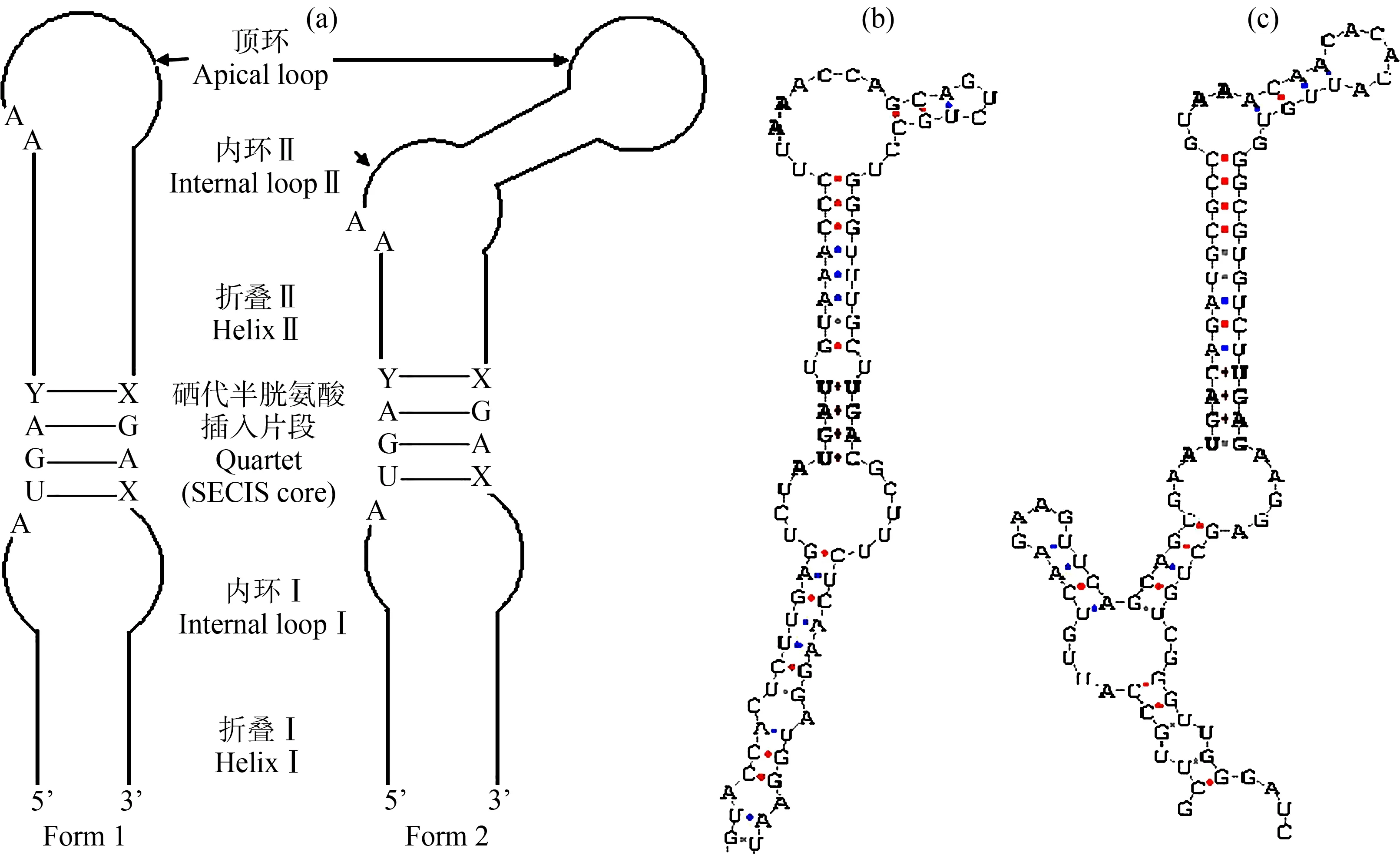
图4 背角无齿蚌与盘鲍硒插入片段比较注:(a) 1型和2型硒插入片段的颈环结构;(b) 背角无齿蚌硒插入片段结构;(c) 盘鲍(Haliotis discus discus)硒插入片段结构。Fig. 4 Predicted secondary structure in SECIS of AwSeGPx of Anodonta woodiana and Haliotis discus discus Note: (a) Schematic representations of stem-loop structures of form 1 and 2 of SECIS; (b) SECIS of Anodonta woodiana; (c) SECIS of Haliotis discus discus.
2.3 系统发育分析
BLAST分析表明,AwSeGPx的氨基酸序列与其他物种SeGPx具有较高的同源性,与三角帆蚌(Hyriopsiscumingii)的同源性为85.64%,与斑马鱼(Daniorerio)的同源性为64.80%,与盘鲍的同源性为30.26%。AwSeGPx与软体动物亲缘关系最近,其次是脊椎动物,最后是昆虫和甲壳动物(图5)。在已证实的软体动物序列中,AwSeGPx进化关系最近的是淡水蚌类,其次是海洋蚌类和螺类(图5)。
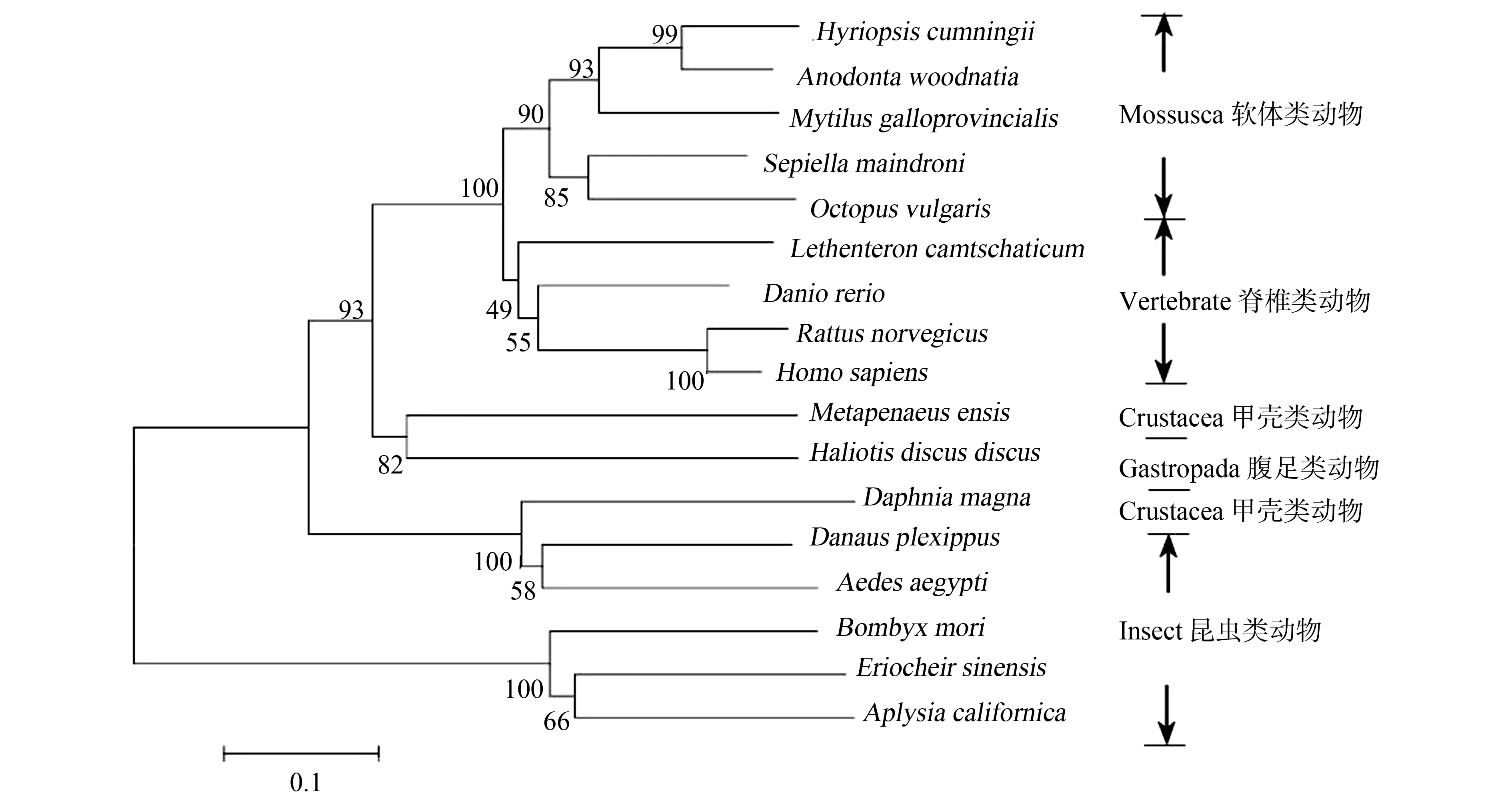
图5 根据背角无齿蚌AwSeGPx氨基酸序列使用邻接法构建的系统进化树Fig. 5 Phylogenetic relation of AwSeGPx of Anodonta woodiana with other organisms
2.4 AwSeGPx的组织分布
实时定量PCR结果显示,背角无齿蚌AwSeGPx在斧足、鳃、肝胰脏、闭壳肌、外套膜和心脏壳中广泛表达(图6)。AwSePGx在肝胰脏和心脏中存在高表达,外套膜、斧足和鳃中存在中等表达,闭壳肌中存在较低表达(图6)。
2.5 急性毒性实验
背角无齿蚌48 h急性毒性试验结果表明,2,4-DCP、2,4,6-TCP和PCP对背角无齿蚌LC50为0.246、0.194和0.139 mg·L-1。
2.6 2,4-DCP、2,4,6-TCP和PCP对肝胰腺AwSeGPx表达的影响
2,4-DCP、2,4,6-TCP和PCP处理能够显著诱导肝胰腺中AwSeGPx的表达(图7)。与对照组相比,用浓度60、120、240、480和960 μg·L-1的2,4-DCP处理后AwSeGPxmRNA水平48 h时比6 h时增加了1.79倍以上(P<0.05)(图7)。
与对照组相比,用浓度50 μg·L-1的2,4,6-TCP处理后AwSeGPx水平在12、24和48 h时显著升高,用浓度100、200、400和800 μg·L-1的2,4,6-TCP处理后AwSeGPx水平在整个实验观察过程中增加了1.01倍以上(P<0.05)(图8)。
与对照组相比,用浓度20、40和80 μg·L-1的PCP处理后AwSeGPx水平在6、12、24和48 h显著升高,AwSeGPxmRNA水平至少增加了62.65%(P<0.05)(图9)。用浓度160 μg·L-1和320 μg·L-1的PCP处理后,AwSeGPxmRNA水平在6、12和24 h显著升高,AwSeGPx水平在48 h下调并降至正常水平(图9)。
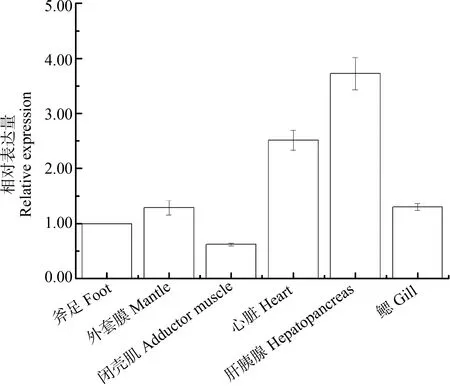
图6 背角无齿蚌AwSeGPx基因的空间表达注:每组数据来源于5只动物。Fig. 6 Real-time PCR analysis of AwSeGPx transcript from different tissues of Anodonta woodianaNote: n=5 replicates for each group.
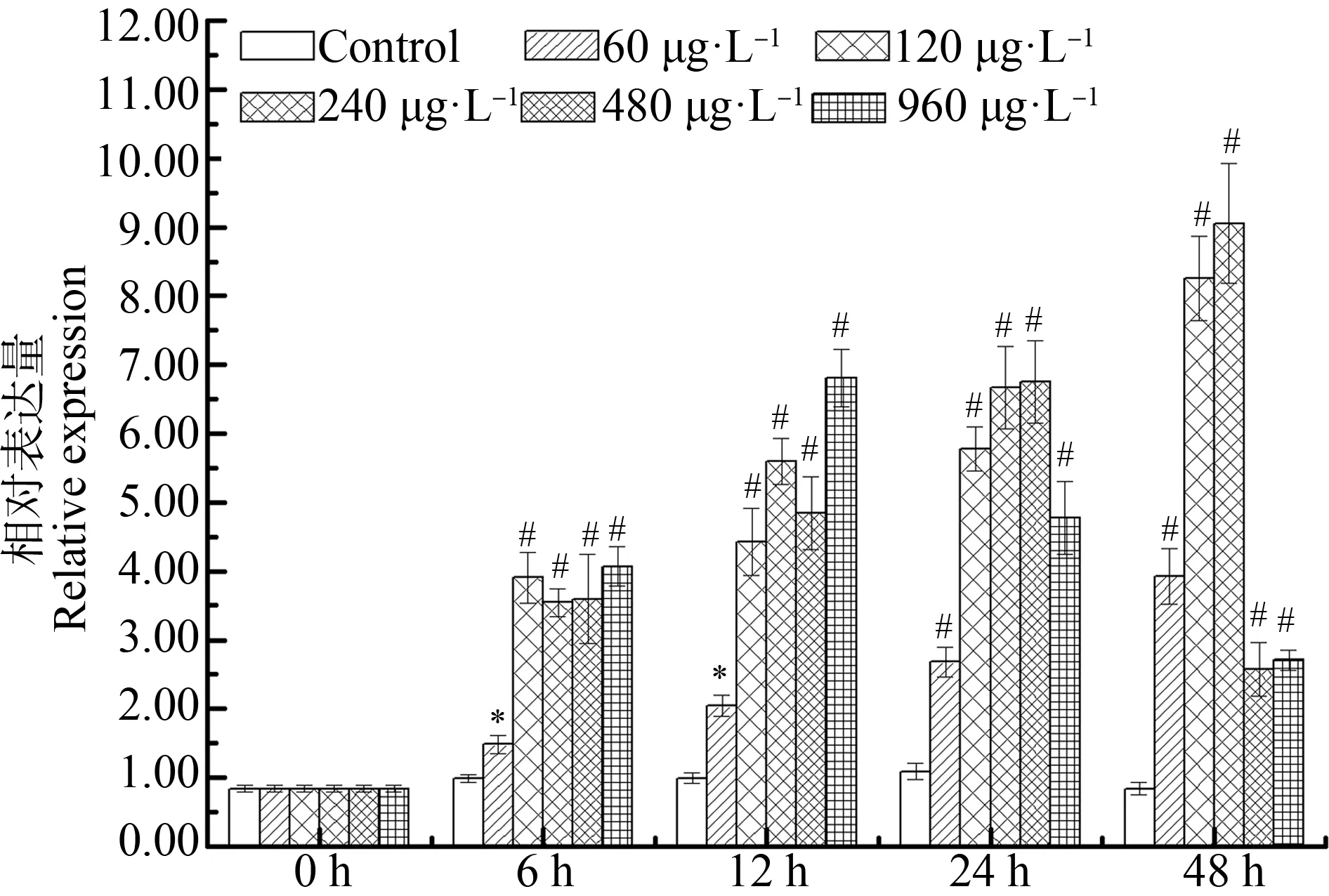
图7 2,4-DCP对背角无齿蚌肝胰腺AwSeGPx 基因表达的影响注:n=5/组/时间点;*、#表示与相应对照组相比有显著差异 (P<0.05、P<0.01)。Fig. 7 Temporal expression of AwSeGPx in the hepatopancreas of Anodonta woodiana after 2,4-DCP challengeNote: n=5/each group/each time point; *, # mean significant differences compared with control group at the same time at P<0.05, P<0.01 level.
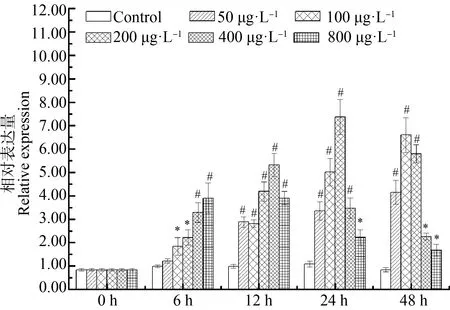
图8 2,4,6-TCP对背角无齿蚌肝胰腺 AwSeGPx基因表达的影响注:n=5/组/时间点;*、#表示与相应对照组相比 有显著差异(P<0.05、P<0.01)。Fig. 8 Temporal expression of AwSeGPx in the hepatopancreas of Anodonta woodiana after 2,4,6-TCP challengeNote: n=5/each group/each time point; *, # mean significant differences compared with control group at the same time at P<0.05, P<0.01 level.
3 讨论(Discussion)
AwSeGPxcDNA编码序列中包含一个无义密码子TGA,提示AwSeGPx是SeGPx家族的一员。无义密码子TGA编码硒代半胱氨酸这一现象首次在小鼠GPx基因中发现,随后在人类和大鼠中也得到进一步证实[12-13]。目前,已在双斑马纹贻贝(Dreissenapolymorpha)、扇贝类虾夷扇贝(Mizuhopectenyessoensis)、菲律宾蛤仔(Venerupisphilippinarum)和盘鲍等软体动物SeGPx中发现该密码子的存在[14-16]。由此可见,硒代半胱氨酸是无脊椎动物到脊椎动物中SeGPx标签位点,同时也是该酶催化的重要活性位点。AwSeGPx氨基酸序列中发现2个保守的SeGPx基因家族的标签序列,分别是68LGFPCNQF75和156WNFEKF161,在这2个结构域中,Gln(Q)和Trp(W)常被视为GPx催化的重要活性位点,并参与硒元素的固定[17]。此外,多重对比结果显示,AwSeGPx序列中Arg94和Arg151与其他SeGPx序列存在高度的同源性,这2个精氨酸残基能够通过静电吸附效应将供体底物引导至催化中心[17]。SECIS元件是SeGPxmRNA序列的一个重要的特征性标签,在翻译过程中将能够将Se引导至UGA密码子位置[18]。AwSeGPxSECIS元件有101个碱基组成,包括1个顶环、2个内环、2个折叠、3个位于内环上腺嘌呤(AA)。已有研究显示,SECIS元件主要有1型和2型这2种主要形式,在1型中,腺嘌呤区域位于顶环,而在2型中,则位于内环[19]。由此可见,AwSeGPx的SECIS元件属于2型类别。
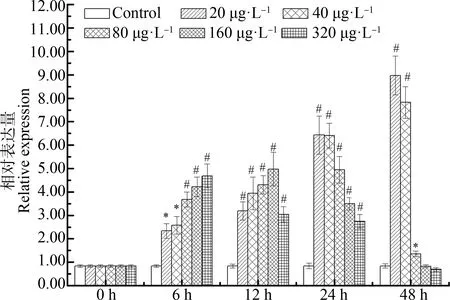
图9 PCP对背角无齿蚌肝胰腺AwSeGPx基因表达的影响注:n=5/组/时间点;*、#表示与相应对照组 相比有显著差异(P<0.05、P<0.01)。Fig. 9 Temporal expression of AwSeGPx in the hepatopancreas of Anodonta woodiana after PCP challengeNote: n=5/each group/each time point; *, # mean significant differences compared with control group at the same time at P<0.05, P<0.01 level.
AwSeGPx广泛分布于鳃、外套膜、闭壳肌、斧足、心脏和肝胰腺中,提示AwSeGPx是一种帮助组织保持氧化还原作用平衡的重要酶;不同组织中的AwSeGPxmRNA水平差异与对抗不同环境中生成的ROS有关。在选取的组织中,AwSeGPx在肝胰脏中表达水平最高,与肝胰腺作为主要代谢器官和氧化应激防御功能器官密切相关[20]。
本研究结果显示,PCP对背角无齿蚌的LC50低于2,4-DCP和2,4,6-TCP的,提示在相同的浓度条件下背角无齿蚌对PCP敏感性高于2,4-DCP和2,4,6-TCP。甲壳动物水蚤的急性毒性实验结果显示,2,4-DCP、2,4,6-TCP和PCP的LC50分别为286.2、341.5和11.4 μg·L-1,慢性毒性实验结果显示,2,4-DCP、2,4,6-TCP和PCP的LC50分别为16.3、54.6和3.9 μg·L-1[1]。在相同浓度条件下,PCP对水生生物毒性比2,4-DCP和2,4,6-TCP更强。研究证实,PCP可以在细胞和组织中通过氧化脱氯进一步转化为其他物质,其中,PCP可被细胞色素P450氧化酶、还原酶催化形成四氯氢醌,四氯氢醌是一种毒性比PCP更强的代谢产物,可诱导DNA链断裂并消耗谷胱甘肽,导致细胞和组织出现大量的ROS和氧化应激效应[21-22]。相对于PCP而言,水环境中的2,4-DCP和2,4,6-TCP化学性质非常稳定,能够在土壤以及底泥介质中长期停留。
本研究结果显示,不同浓度2,4-DCP、2,4,6-TCP和PCP处理能够显著诱导AwSeGPx表达水平的上调,提示AwSeGPx表达水平上调与动物对过氧化物转化能力以及环境耐受能力的增强密切相关。对于生物个体而言,ROS生成是一种正常的生理现象。在正常状态下,ROS生成后会被一系列的抗氧化酶迅速转化和代谢,控制在较低的水平,以维持细胞氧化和还原状态之间的平衡[6-7]。背角无齿蚌作为滤食性淡水生物,水体中氯酚类化合物很容易穿过细胞膜,并蓄积在体内,导致ROS生成显著增多[9-10]。与此同时,机体也可以通过调整抗氧化酶的活性提高对ROS清除能力。在这些抗氧化酶体系中,SeGPx可以还原有机和无机过氧化物,能够将有毒的过氧化物还原成无毒的羟基化合物,保护细胞膜结构及功能不受过氧化物干扰和损害。哺乳动物和硬骨鱼类可以通过提高SeGPx活性来减轻氧化应激的损伤[23]。经Cd和Cu等重金属处理后,菲律宾蛤仔SeGPx表达水平显著上调,提高对重金属环境的耐受能力[15]。H2O2处理后盘鲍体内含硒谷胱甘肽过氧化物酶表达水平显著升高,增强对氧化应激耐受能力[16]。高浓度Hg处理能够抑制紫贻贝SeGPx活性,导致动物体内氧化作用和还原作用之间平衡发生偏移,使氧化作用占居主导地位,助推了Hg诱发氧化应激效应和遗传毒性作用[14]。对于机体而言,SeGPx活性高低与丙二醛的含量密切关联,丙二醛常作为衡量细胞膜脂质过氧化水平的关键指标。由此,2,4-DCP、2,4,6-TCP和PCP处理后AwSeGPx表达水平的升高,一方面反映了这3个化合物在高浓度条件下能够导致背角无齿蚌体内脂质过氧化反应,导致包括细胞膜在内的脂质过氧化损伤;另一方面与动物对过氧化物的转化能力和对环境的耐受能力有关。
本研究从背角无齿蚌中分离出AwSeGPxcDNA全基因序列,该序列具有SeGPx的标签序列和保守序列。2,4-DCP、2,4,6-TCP和PCP处理后动物机体氧化应激水平增加,肝胰腺中AwSeGPx表达水平上调与动物提高过氧化物的还原能力和增强对环境的耐受能力有关。在相同浓度条件下,PCP对动物毒性和环境危害可能大于2,4-DCP和2,4,6-TCP。
