苦蘵毛状根体系的建立
2021-12-07毛延妍王灵艳俞春娜冯尚国王慧中展晓日
毛延妍,邱 恬,2,薛 洁,2,王灵艳,俞春娜,2,冯尚国,2,王慧中,2,展晓日,2
(1. 杭州师范大学生命与环境科学学院,浙江 杭州 311121; 2. 浙江省药用植物种质改良与质量控制技术重点实验室,浙江 杭州 311121)
苦蘵PhysalisangulataL.是茄科Solanaceae酸浆属Physalis植物,是一种民间常用中草药,其宿萼、带宿萼的果实、根、全草均可入药.现代药理研究表明苦蘵具有抗炎、抗氧化、抗肿瘤、免疫调节、镇痛等药理作用[1].目前已从苦蘵中分离获得多种化学成分,包括甾体类(酸浆苦味素类和睡茄内酯类)、黄酮类、有机酸等,其中主要活性成分为甾体类化合物.
毛状根是发根农杆菌Agrobacteriumrhizogenes侵染植物后,将其所携带的能够使植物产生毛状根的Ri质粒上的 T-DNA 转移至植物体内,并最终整合到宿主细胞基因组中产生的[2-3].毛状根生长不依赖外源植物激素,具有生长速度快、周期短、遗传稳定等特点.而且毛状根分化程度高,生长条件要求相对简单,合成次生代谢产物能力与植株相似甚至更强,是一种进行植物次生代谢产物生物合成研究的理想材料,也可作为高效生产植物次生代谢产物的生物反应器[4-5].
苦蘵中主要活性成分甾体类化合物虽已被证实具有多种药理活性,但前期研究发现不同来源苦蘵中的活性成分含量差异较大,且含量相对较低,可能是植物在生长过程中由于外界因素影响所导致.因此本研究利用发根农杆菌诱导苦蘵的毛状根,建立了苦蘵毛状根体系,为今后利用苦蘵毛状根进一步研究其次生代谢产物合成途径及生产药用成分奠定基础.
1 材料
苦蘵种子采自台州,经杭州师范大学生命与环境科学学院王慧中教授鉴定为茄科酸浆属植物苦蘵PhysalisangulataL.的种子;发根农杆菌C58C1由中国中医科学院中药资源中心郭娟研究员提供.
2×Easy Taq Super Mix,Ezup柱式植物基因组DNA抽提试剂盒,头孢噻肟钠(cefotaxime sodium,Cef),DNA marker,利福平(rifampicin,Ref)购自生工生物工程股份有限公司;胰蛋白胨(tryptone),氯化钠(NaCl),次氯酸钠(NaClO)溶液等购自国药集团化学试剂有限公司;酵母提取物(Yeast extract)购自英国Oxoid公司;MS培养基购自北京索莱宝科技有限公司.
2 方法
2.1 苦蘵无菌苗的培养
取苦蘵种子,70%乙醇浸泡3 min,5%NaClO溶液浸泡10 min,无菌水冲洗4~6次.接种于MS固体培养基,25 ℃暗培养2 d后,光照培养箱25 ℃恒温培养,种子萌发后转移至含MS固体培养基的组培瓶中,20 d左右即可得到苦蘵无菌苗.
2.2 菌种的活化
取-80 ℃冰箱中冻存的发根农杆菌C58C1、ACC、A4、9401划线于含有利福平的YEB固体培养基上,28 ℃倒置恒温培养2 d.挑取单菌落接种于10 mL YEB(50 mg·L-1Rif)液体培养基中,28 ℃、220 r·min-1振荡培养至瓶内液体浑浊,取1 mL菌液加入到50 mL YEB(50 mg·L-1Rif)液体培养基中,28 ℃、220 r·min-1振荡培养至A600为0.4~0.6,4 ℃下6 000 r·min-1离心10 min,弃上清液,另取50 mL MS液体培养基重悬沉淀的菌体,即得侵染液.
2.3 外植体的侵染和毛状根的诱导
取苦蘵无菌苗的叶片,切成0.5~1 cm边长的正方形小片,将叶柄和茎剪成长度约0.5~1 cm的小段,置于MS固体培养基上,其中叶片部分背面向上放置,25 ℃恒温暗培养2 d.将预培养后的外植体转至事先制备好的侵染液中,28 ℃、120 r·min-1振荡15 min,取出,用无菌纸吸干外植体表面残留菌液,置MS空白固体培养基上,25 ℃恒温暗培养2 d.取出外植体,无菌水清洗3次,用400 mg·L-1Cef溶液浸泡5 min,吸干表面水分,将其转至含400 mg·L-1Cef的MS固体培养基上,25 ℃恒温暗培养,待外植体边缘长出的毛状根长度约为2 cm时,切下毛状根单独培养.每7 d继代1次,每继代1次,将Cef质量浓度降低100 mg·L-1,直至Cef浓度降低到0,保证完全除菌.
2.4 苦蘵毛状根诱导条件的优化
2.4.1 发根农杆菌菌株对诱导率的影响
取苦蘵叶片,按“2.3”项下方法对其进行预培养后,采用4种发根农杆菌C58C1、ACC、A4、9401分别对苦蘵的叶片进行侵染,28 ℃、120 r·min-1振荡20 min,取出,用无菌纸吸干叶片表面残留菌液,置MS空白固体培养基上,25 ℃恒温暗培养,20 d后统计叶片发根情况,并计算诱导率,公式如下:
毛状根诱导率=(长出毛状根的外植体数/总外植体数)×100%.
2.4.2 培养基对诱导率的影响
取苦蘵叶片,按“2.3”项下方法对其进行预培养后,以C58C1侵染叶片,28 ℃、120 r·min-1振荡20 min,取出,用无菌纸吸干叶片表面残留菌液,分别置于新的MS、1/2MS、B5、1/2B5固体培养基上,25 ℃恒温暗培养,20 d后统计叶片发根情况,并计算诱导率.
2.4.3 外植体对诱导率的影响
分别取苦蘵的叶、茎、叶柄,按“2.3”项下方法对其进行预培养后,以C58C1侵染不同外植体,28 ℃、120 r·min-1振荡20 min,取出,用无菌纸吸干叶片表面残留菌液,置MS空白固体培养基上,25 ℃恒温暗培养,20 d后统计叶片发根情况,并计算诱导率.
2.4.4 侵染时间对诱导率的影响
取苦蘵叶片,按“2.3”项下方法对其进行预培养后,以C58C1侵染叶片,28 ℃、120 r·min-1分别振荡5、10、15、20、25、30 min,取出,用无菌纸吸干叶片表面残留菌液,置MS空白固体培养基上,25 ℃恒温暗培养,20 d后统计叶片发根情况,并计算诱导率.
2.5 苦蘵毛状根的鉴定
选择不同根系的苦蘵毛状根、苦蘵根及苦蘵叶片未侵染状态下长出的根为材料,采用Ezup柱式植物基因组DNA抽提试剂盒提取其DNA.在生工生物工程股份有限公司合成rolB和rolC基因的PCR引物.rolB-F:5′-CGAGGGGATCCGATTTGCTT-3′,rolB-R:5′-GACGCCCTCCTCGCCTTCCT-3′;rolC-F:5′-TCGCCATGCCTCACCAACTCAC-3′,rolC-R:5′-CCTTGATCGAGCCGGGTGAGAA-3′.PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸5 min.琼脂糖凝胶电泳检测目的条带.
2.6 苦蘵毛状根液体扩大培养
经PCR鉴定后,选择白色、多分枝、多根毛、生长迅速的无菌毛状根作为优良株系,转入含50 mL6,7-V液体培养基中,25 ℃、80 r·min-1暗培养,观察毛状根生长情况.
2.7 苦蘵毛状根生长曲线的测定
取在6,7-V液体培养基中生长旺盛且无菌的苦蘵毛状根0.5 g,转至50 mL 6,7-V液体培养基中,5 ℃、80 r·min-1暗培养,每4 d随机取样1次,直至第60 天,每次取样3瓶,记录每瓶毛状根的干质量,计算平均值,绘制其0~60 d的生长曲线.
3 结果与讨论
3.1 苦蘵无菌苗的培养
苦蘵点种后6 d左右发芽,发芽后3 d左右长出两片子叶.点种后30 d左右的无菌植株可用于毛状根诱导实验,不同生长时期苦蘵无菌植株如图1A、1B所示.
3.2 苦蘵毛状根诱导及形态特征
苦蘵叶片在受到发根农杆菌侵染后,6 d左右可观察到外植体伤口处有白色颗粒状突起物,再过3~5 d叶片伤口处便可生长成为多毛、多分枝的白色根.根生长的高峰期在侵染后的第14 天,长出的根形态均为多分枝、多根毛,多数沿着培养基表面或者贴在培养皿侧壁生长,且根的生长速度很快,在发根后的7 d内迅速生长并覆盖培养基表面.毛状根诱导情况见图1C、1D、1E.

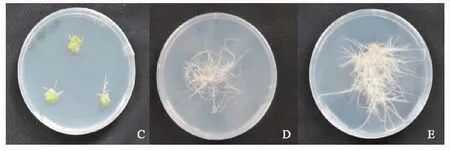
A、B分别为生长9、30 d的苦蘵无菌苗;C、D、E分别为侵染后10、20、25 d时的苦蘵毛状根.
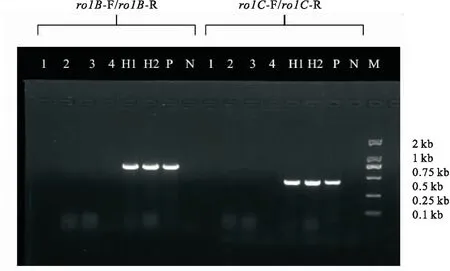
1、2:苦蘵根;3、4:苦蘵叶片未侵染状态下长出的根;H1、H2:不同株系苦蘵毛状根;P:菌株C58C1;N:阴性对照;M:DL 2000 DNA marker.
3.3 苦蘵毛状根PCR鉴定
按“2.5”项所述方法对苦蘵毛状根基因组DNA进行PCR鉴定,结果见图2.PCR结果显示,正常苦蘵根(1、2)及苦蘵叶片未侵染长出的根(3、4)无特异扩增产物,而经过C58C1诱导产生的2种不同根系苦蘵毛状根(H1、H2)和菌液对照(P)均出现了明显的特异扩增条带,从而在分子水平上证明了外源Ri质粒的T-DNA片段已插入并整合到苦蘵毛状根基因组中.
3.4 苦蘵毛状根诱导条件的优化
首先考察了C58C1、ACC、A4、9401分别对苦蘵叶片进行侵染后不同菌株的毛状根诱导率,结果(图3a)表明,4种发根农杆菌对苦蘵毛状根的诱导率均大于60%,其中C58C1和ACC的诱导率可达80%以上,本研究选择了适合于广泛宿主的C58C1作为诱导苦蘵毛状根的发根农杆菌.在此基础上,进一步考察了不同培养基、外植体、侵染时间对毛状根诱导率的影响,结果见图3.由图3b可知,4种培养基中以MS 作为培养介质时苦蘵毛状根诱导率最高,因此选用MS作为培养基.由图3c可知,在相同侵染条件下,用农杆菌分别侵染叶、茎、叶柄,不同外植体的毛状根诱导率差别显著,以叶片为外植体的毛状根诱导率最高,达81.2%.由图3d可知,侵染15~20 min毛状根诱导率为80%以上,但是随着侵染时间的延长,诱导率不升反降,因此最佳侵染时间为15 min.
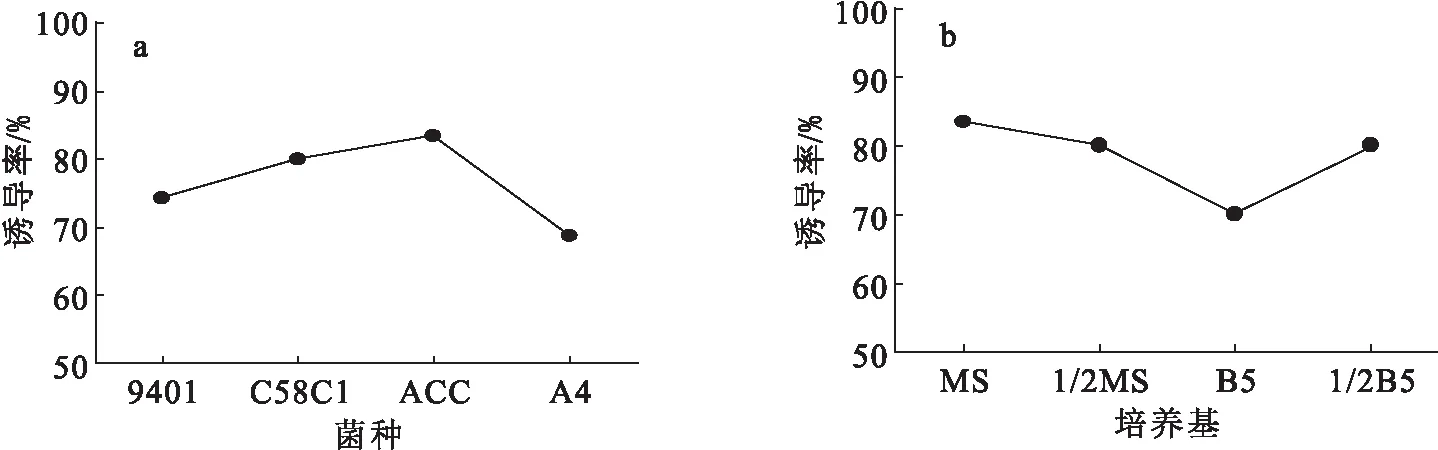
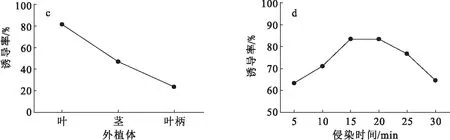
图3 不同诱导条件对苦蘵毛状根诱导率的影响Fig.3 Effect of different conditions on the induction rate of hairy roots
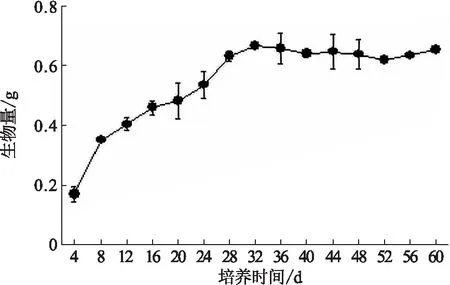
图4 苦蘵毛状根的生物量积累曲线Fig.4 The accumulation of biomass of hairy roots
3.5 苦蘵毛状根悬浮培养的生长曲线
取生长旺盛的苦蘵毛状根接种至6,7-V液体培养基中,从接种后第4 天开始,在培养60 d内每4 d取样1次,每次3份,以毛状根干质量对其悬浮培养时间作图,得到悬浮培养苦蘵毛状根的生长曲线,见图4.由图4分析可知,苦蘵毛状根在4~16 d处于快速生长期,其干质量增长了2.7倍;16~32 d处于生长的稳定期,干质量增长了1.5倍;32 d后苦蘵毛状根质量出现下降趋势.并且随着培养时间的增加,苦蘵毛状根的颜色由白色逐渐转变为黄色,见图5.
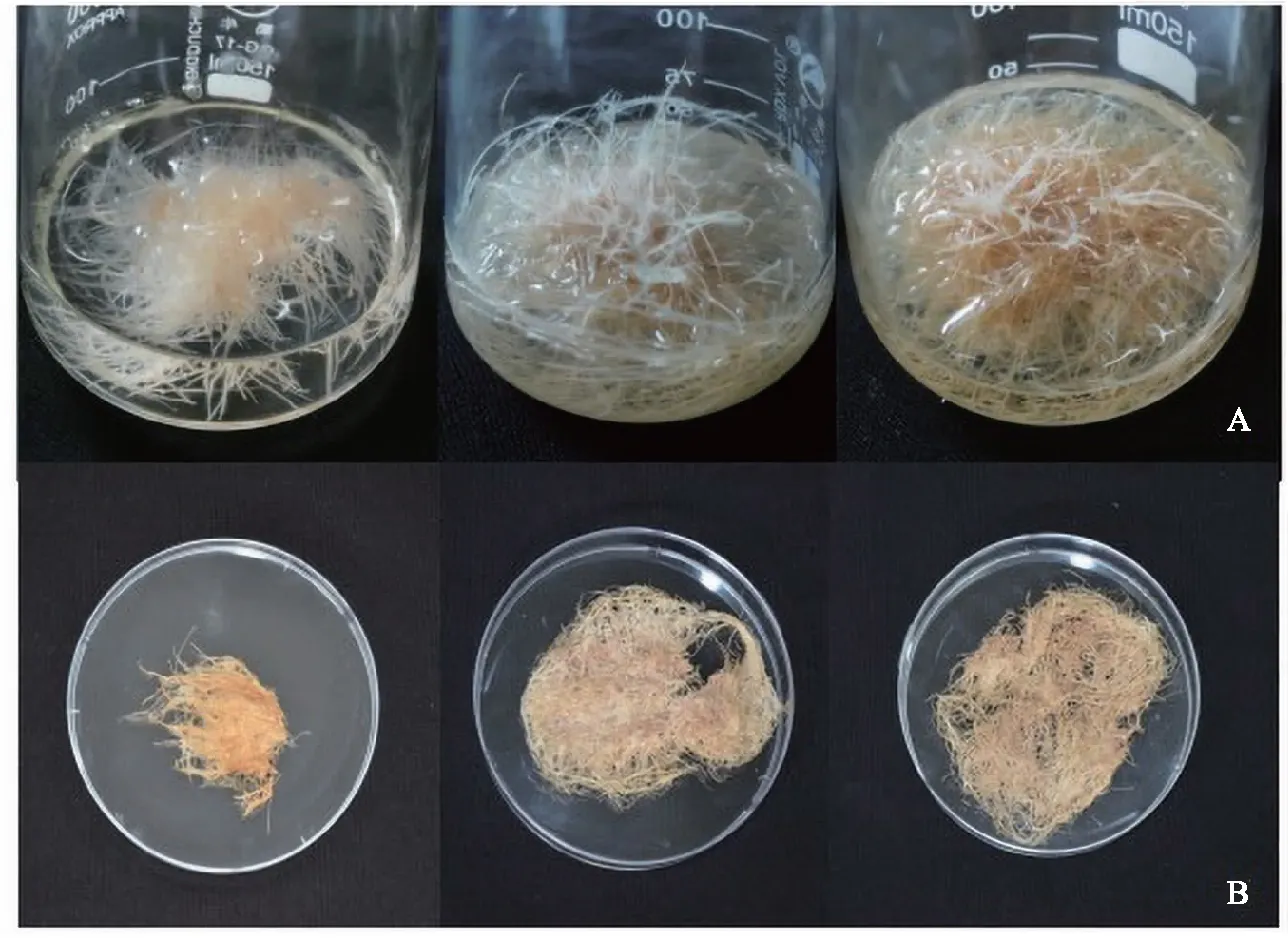
A:毛状根悬浮培养4、32、60 d的生长状态;B:毛状根悬浮培养4、32、60 d的生物量.
4 结论
根据文献报道,目前已有上百种药用植物成功通过发根农杆菌侵染外植体建立了毛状根培养体系,但由于每种植物均有其自身的生理特点,部分植物的毛状根难以诱导.对于每种植物的诱导条件没有固定模式可循,都需要进行大量的优化实验来确定其培养条件.苦蘵是一种具有较高药用价值的植物,但其毛状根诱导体系还未见报道.
本实验以苦蘵无菌植株为材料,通过发根农杆菌侵染苦蘵外植体的方法建立了苦蘵毛状根体系.通过对毛状根基因组DNA进行PCR扩增,验证了质粒基因rolB和rolC的存在,从分子层面对苦蘵毛状根进行了鉴定.同时考察了不同发根农杆菌菌株、培养基、侵染时间、外植体对毛状根诱导率的影响,从而确定苦蘵毛状根培养条件:取苦蘵叶片,切成0.5~1 cm边长的正方形小片,于MS固体培养基上预培养2 d,C58C1侵染15 min.用无菌纸吸干叶片表面残留菌液,置于新的MS固体培养基上,25 ℃暗培养.并绘制了苦蘵毛状根悬浮培养0~60 d的生长曲线,研究不同生长时期苦蘵毛状根生物量的积累,发现苦蘵毛状根的生长周期约为 32 d.
