明胶废水中耐钙菌株的筛选鉴定及培养条件优化
2021-12-06白慧慧任海伟任雨薇唐多利彭轶楠王治业李志忠
白慧慧,任海伟*,任雨薇,唐多利,彭轶楠,王治业,李志忠
(1.兰州理工大学 生命科学与工程学院,甘肃 兰州 730050;2.甘肃省科学院 生物研究所 甘肃省微生物资源开发利用重点实验室,甘肃 兰州 730099)
明胶是一种高分子蛋白质生物材料,因其具有良好的成膜性、侧基的高化学反应活性、生物相容性、胶凝态和溶胶态的可逆转变性以及无毒等优良特性,在感光材料、食品、医药、化妆品、造纸、防腐抗蚀、化工等行业广泛使用[1]。明胶生产过程中耗水量高达1 500~2 000 t/t明胶[2],废水产量庞大,若直接排放将会造成严重的水体和土壤环境污染[3]。另一方面,因明胶生产原料多采用牛骨等动物废弃物,生产过程中又有石灰水中和等步骤,使废水中的Ca2+浓度相对较高[4];较高浓度Ca2+对细胞有一定毒性,污泥上的钙沉淀会降低微生物的生物活性,导致污水生物处理的效率下降;而且明胶废水中Ca2+会与碳酸根离子结合生成碳酸钙,导致次生废物剩余污泥排放量巨大,占到污水处理量的0.4%[5]。如何有效避免高浓度Ca2+引起的污水处理困扰,是明胶加工企业面临的难题之一[6]。若能将明胶废水中的Ca2+通过特定的微生物菌株进行富集吸附,则既可降低污水中Ca2+浓度,还可以生成高钙微生物进行深度利用。
目前MATHIVANAN K等[7]研究发现,赖氨酸芽胞杆菌(Lysinibacillus)作为生物吸附剂对Pb(II)的生物吸附能力和去除效率分别为43.25 mg/g和86.5%;李倩等[8]从活性污泥中筛选得到耐镉菌株,初步鉴定为蜡样芽孢杆菌(Bacillus cereus),得到最大铅离子耐受质量浓度为350 mg/L,吸附量为205 mg/g。邹水林[9]筛选得到一株对铜离子有强耐受能力和吸附性能的菌株Citrobactersp.,该菌株对铜离子的最小抑制浓度可达400 mg/L。周防震等[10]从富硒土壤中筛选出枯草芽孢杆菌(Bacillus subtilis),当Na2SeO3溶液质量浓度20 μg/mL,加硒时间5 h,培养温度37 ℃,富硒率为58.3%。曹礼等[11]筛选出耐锌菌株HXZ-1,当锌离子质量浓度为50 mg/L、培养时间为10 h时,最大吸附量为29.1%。但是,有关耐钙菌株的分离和鉴定鲜有报道。
本研究从明胶加工废水中筛选出有一定耐钙能力的微生物菌株N3-1,利用形态学观察、生理生化试验及16S rRNA序列分析法等方法对其进行鉴定,对其生长特性进行研究,并通过单因素试验、Box-Behnken 试验设计优化菌株N3-1的培养条件,以期为高钙含量的水体污染修复提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 废水样品
明胶加工废水样品:取自甘肃阿敏生物清真明胶有限公司污水处理站。
1.1.2 化学试剂
细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京天根生化科技有限公司;牛肉膏、蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;氯化钠、氯化钙(均为分析纯):天津市凯通化学试剂有限公司。
1.1.3 培养基
液体培养基:蛋白胨10 g/L,牛肉膏3 g/L,氯化钠5 g/L,蒸馏水1 L,121 ℃高压蒸汽灭菌20 min。
固体培养基:琼脂16 g/L,其余与上述液体培养基相同,121 ℃高压蒸汽灭菌20 min。
斜面培养基:琼脂18 g/L,其余同液体培养基,121 ℃高压蒸汽灭菌20 min。
筛选培养基:称取氯化钙8.33 g(Ca2+含量为3 g/L)、27.78 g(Ca2+含量为10 g/L)、55.56 g(Ca2+含量为20 g/L)、83.33 g(Ca2+含量为30 g/L)、111.11 g(Ca2+含量为40 g/L)、138.89 g(Ca2+含量为50 g/L)分别溶于1 L液体的培养基中,121℃高压蒸汽灭菌20min,即得对应Ca2+浓度的筛选培养基。
筛选培养基Ca2+含量的计算公式如下:
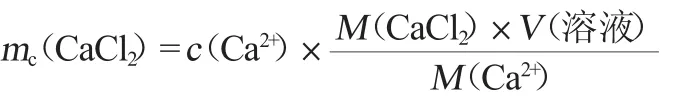
式中:mc(CaCl2)为氯化钙的质量,g;c(Ca2+)为所需的Ca2+含量,g/L;M(CaCl2)为氯化钙的摩尔质量,111 g/mol;M(Ca2+)为Ca2+的摩尔质量,40g/mol;V为培养基体积,L。
1.2 仪器与设备
HVS-1300-U型超净工作台:苏州安泰空气技术有限公司;DHP-9082型电热恒温培养箱:上海一恒科学仪器有限公司;SHZ-8Z型恒温振荡器:国华企业集团有限公司;Genesy 96T型基因扩增热循环仪:杭州郎基科学仪器有限公司;UV2600nmA紫外可见分光光度计:尤尼柯仪器有限公司;24LDJ手提式高压蒸汽灭菌器:江阴滨江医疗设备有限公司;PTC-200型聚合酶链式反应(polymeraschainreaction,PCR)仪:美国BIO-RAD公司。
1.3 方法
1.3.1 废水样品处理
从明胶污水处理站的初沉池、好氧池、厌氧池和排放口4个采样点分别取废水样品5 g,然后加入事先准备的30 mL含玻璃珠的无菌水中。
菌悬液的制备:在30℃、120r/min条件下恒温振荡10min。准确量取1 mL菌悬液加入到9 mL无菌水中得到10-1菌悬液,采用同样方法依次稀释得到10-2~10-7梯度菌悬液。
1.3.2 耐钙菌株的初筛
在超净工作台中,取Ca2+含量为3 g/L已灭菌的液体培养基中加入0.05 mL废水样品,放入37 ℃、120 r/min摇床中培养24 h,得到发酵液。用接种环将发酵液采用三区划线法接种至Ca2+含量为3 g/L的固体培养基中,放置于37 ℃恒温培养48 h。经过反复平板划线分离纯化,将筛选出的菌株进行编号,4 ℃斜面保存[12]。
1.3.3 耐钙菌株的复筛
将初筛得到的菌株按2%的接种量依次加入Ca2+含量为10 g/L、20 g/L、30 g/L、40 g/L、50 g/L的液体培养基中,置于37 ℃摇床中培养24 h,取100 μL培养液用涂布棒均匀涂布在固体培养基中,置于37 ℃恒温培养箱培养48 h,观察菌落形态,挑取高Ca2+含量培养基中生长良好的菌落,最终筛选出耐钙能力强的菌株,接种于斜面培养基,4 ℃保存[13]。
1.3.4 耐钙菌株的鉴定
形态学观察:制备10-6菌悬液均匀涂布于固体培养基上,置于37 ℃恒温培养箱培养48 h会形成单菌落,肉眼及显微镜观察菌落的形状、颜色、粘稠度以及边缘等特征[14]。
生理生化鉴定:参照《常见细菌系统鉴定手册》[15]、《伯杰氏细菌鉴定手册》[16],通过吲哚试验、柠檬酸盐试验等方法考察菌株的生理生化特征。
分子生物学鉴定:利用试剂盒提取菌体总DNA[17];并以该DNA为模板,以27F:5'-AGAGTTTGATCCTGGCTCAG-3',1492R:5'-GGTTACCTTGTTACGACTT-3'为引物[18],进行16S rRNA基因的PCR扩增。PCR扩增体系(50 μL):上下游引物各2 μL,Buffer 5 μL,脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTP)4 μL,TaqDNA 聚合酶0.5 μL,双蒸水35.5 μL,DNA模板1 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火30 s,72 ℃延伸1 min,35个循环;最后94 ℃延伸7 min。扩增产物送往上海生工生物工程有限公司测序。将测序的基因序列通过与美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对,使用MEGA 7.0生物学软件对近似序列进行比对分析,利用邻接(neighbor-joining,NJ)法构建系统发育树[19]。
1.3.5 耐钙菌株培养条件的优化
单因素试验:将筛选菌株接种在30 mL液体培养基中活化18 h后,分别以5%(V/V)的接种量接入已灭菌的装液量为30 mL/250 mL液体培养基中。在37 ℃、120 r/min条件下,分别研究培养时间(0、3 h、6 h、9 h、12 h、15 h、18 h、21 h、24 h、27 h、30 h、33 h、36 h、39 h、42 h、45 h),培养温度(20 ℃、26 ℃、32 ℃、37 ℃、45 ℃),培养基初始pH值(3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0),初始Ca2+含量(0、0.5 mg/L、1.0 mg/L、1.5 mg/L、2.0 mg/L、2.5 mg/L、3.0 mg/L、4.0 mg/L、5.0 mg/L、6.0 mg/L、7.0 mg/L、8.0 mg/L)对菌悬液吸光度值(OD600nm值)的影响,每个试验进行3次平行。
响应面试验:在上述单因素试验结果的基础上,以培养温度(A),培养基初始pH值(B)和初始Ca2+含量(C)为响应因素,以菌悬液吸光度值(OD600nm值)(Y)为响应值,进行基于Box-Behnken试验设计的3因素3水平优化试验,并根据方程(1)对变量进行编码[20]。

式中:Y是响应值即菌悬液吸光度值(OD600nm值);β0是常数;βi是线性系数;βii是二次系数;βij是变量之间相互作用系数,Xi和Xj是表示不同自变量。
通过方差分析(analysis of variance,ANOVA)检验回归系数统计的显著性及模型的充分性,自变量之间的相互作用及其影响利用响应面等值线图进行分析。最后多次试验验证优化设计及统计实验的有效性[21]。
1.3.6 数据处理
利用Excel 2010 软件整理基础数据,整理后的数据通过SPSS 20.0软件进行ANOVA分析,用Origin 8.0进行数据分析作图,用Design Expert 8.0.6 软件进行响应面试验设计并进行相关数据分析。
2 结果与分析
2.1 耐钙菌株的筛选
2.1.1 耐钙菌株的初筛
通过从Ca2+含量为3 g/L已灭菌的培养基平板中初筛获得3株菌株,依次编号为N3-1、N3-2、N3-3。
2.1.2 耐钙菌株的复筛
初筛得到的3株菌株依次通过Ca2+含量为10 g/L、20 g/L、30 g/L、40 g/L、50 g/L的培养基中复筛,菌株N3-2、N3-3在Ca2+含量为20 g/L的培养基中停止生长,菌株N3-1在Ca2+含量为40 g/L的培养基中缓慢生长,在Ca2+含量为50 g/L的培养基中停止生长,通过复筛获得一株耐钙菌株N3-1。
2.2 耐钙菌株的鉴定
2.2.1 菌株N3-1的形态学观察
由图1可知,菌株N3-1在37 ℃固体培养基上培养48 h后形成的表面呈同心环状,边缘锯齿状,灰白色半透明的圆形菌落,菌株N3-1革兰氏染色结果显示为革兰氏阳性菌。

图1 菌株N3-1的菌落(a)及细胞(b)形态Fig.1 Colony (a) and cell (b) morphology of strain N3-1
2.2.2 菌株N3-1的生理生化特征
菌株N3-1的生理生化试验、糖发酵试验鉴定结果分别见表1和表2。由表1和表2可知,菌株N3-1可分解明胶、淀粉、葡萄糖、果糖、鼠李糖、蔗糖、阿拉伯糖、棉子糖、甘露醇等,但不能分解木糖。菌株N3-1吲哚试验、甲基红试验、V-P试验结果均为阳性,柠檬酸盐试验结果为阴性。
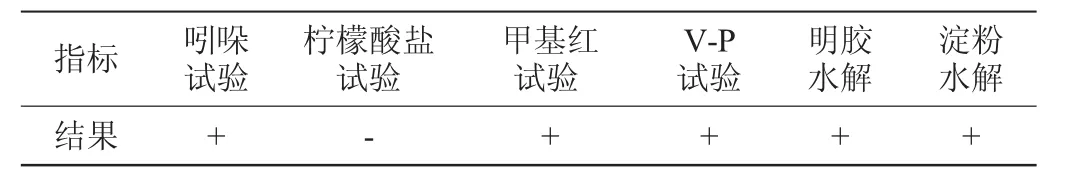
表1 菌株N3-1的生理生化试验结果Table 1 Physiological and biochemical tests results of strain N3-1

表2 菌株N3-1的糖发酵试验结果Table 2 Sugar fermentation tests results of strain N3-1
2.2.3 菌株N3-1的分子生物学鉴定
将菌株N3-1的16S rDNA产物进行测序,测序结果在NCBI上进行BLAST比对,利用MEGA7.0软件中的NJ法对该菌株及与其序列相似度较高的菌株构建系统发育树,结果见图2。由图2可知,菌株N3-1与NCBI GenBank数据库中的Bacillusniabensis(登录号AY998119)同源性最高[22],相似度为100%。结合形态学特征、生理生化试验及16S rRNA分子生物学分析,菌株N3-1被鉴定为尼阿布芽孢杆菌(Bacillus niabensis)。

图2 基于16S rDNA序列菌株N3-1的系统发育树Fig.2 Phylogenetic tree of strain N3-1 based on 16S rDNA sequence
2.3 耐钙菌株N3-1的培养条件优化单因素试验
2.3.1 菌株N3-1的生长曲线
微生物生长有一定的规律性,分为迟缓期、对数期、稳定期和衰退期[23]。由图3可知,菌株N3-1培养0~6 h时菌液澄清,为潜伏期;培养6~21 h菌液开始浑浊,表明菌株的生长速度加快,进入对数期阶段,菌体数出现指数增长;培养21~36 h后菌体浑浊程度相对稳定,未发生明显变化,说明该菌体进入稳定期;培养36 h后吸光度值出现明显的下降趋势,可能由于部分菌体衰亡,说明该菌体进入衰退期。该试验得出菌株N3-1的最佳培养时间为21 h。

图3 菌株N3-1的生长曲线Fig.3 Growth curve of strain N3-1
2.3.2 培养基初始pH值对菌株N3-1生长的影响
pH值是影响微生物生长的重要因素,与微生物的物质代谢、生命活动有着密切的关系[8]。由图4可知,当培养基初始pH值<6时,菌悬液OD600nm值随着pH值的增加呈现快速增长趋势;当培养基初始pH值为6~8时,OD600nm值缓慢增加;当培养基初始pH达到8时,菌株N3-1的OD600nm值达到最大,为0.825;当培养基初始pH>8之后,OD600nm值随着pH的增加反而下降,过高或过低均不利其生长。因此,菌株N3-1的最适培养基初始pH值为8。
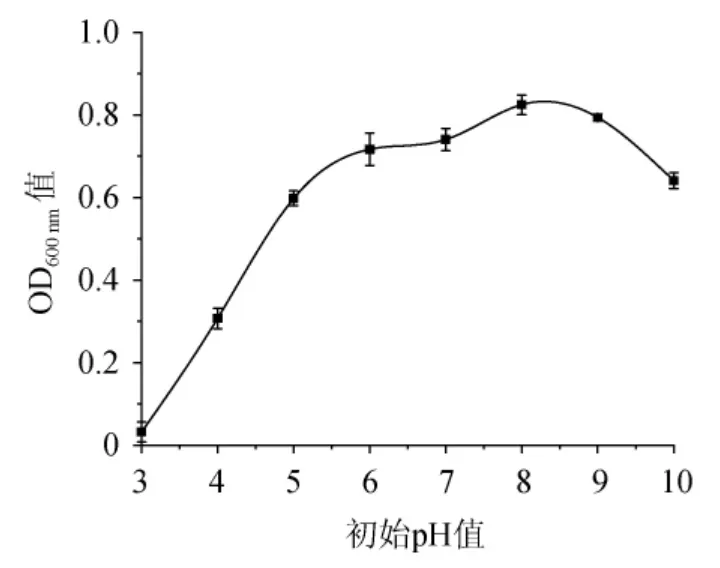
图4 培养基初始pH对菌株N3-1生长的影响Fig.4 Effect of initial medium pH on strain N3-1 growth
2.3.3 培养温度对菌株N3-1生长的影响
温度是微生物的重要生存因子,在适宜温度范围内,酶促反应速率随着温度的升高逐渐加快,微生物的代谢速率和生长速率也相应提高,适宜的培养温度可以使微生物以最快的生长速率繁殖生长[23-24]。由图5可知,当培养温度在20~37 ℃时,随着培养温度的升高,OD600nm值明显升高,表明菌株N3-1的生长速率随着培养温度的升高而加快,生长情况较好;当培养温度为37 ℃时,菌株的OD600nm值达到最大值,为0.489,表明菌株N3-1的培养温度适宜;当培养温度>37 ℃之后,OD600nm值明显下降,表明菌株N3-1的生长速率随着温度的升高而下降。因此,菌株N3-1的最适培养温度为37 ℃。
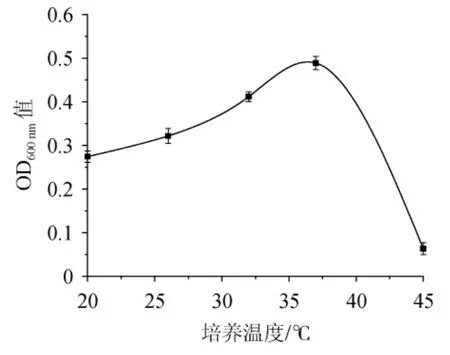
图5 培养温度对菌株N3-1生长的影响Fig.5 Effect of culture temperature on growth of strain N3-1
2.3.4 初始Ca2+含量对菌株N3-1生长的影响
由图6可知,当菌株N3-1在初始Ca2+含量为0.5~1.5 mg/L时,OD600nm值随着钙离子含量的增加而增大,说明初始Ca2+含量在适当范围内能促进该菌株的生长。当初始Ca2+含量为1.5 mg/L时,OD600nm值达到最大,为0.883。当初始Ca2+含量>1.5 mg/L之后,OD600nm值呈波动下降趋势,初始Ca2+含量过高会抑制菌株N3-1的生长。因此,菌株N3-1的最适初始Ca2+含量为1.5 mg/L。

图6 初始Ca2+含量对菌株N3-1生长的影响Fig.6 Effect of initial Ca2+contents on strain N3-1 growth
2.4 菌株N3-1培养条件优化响应面试验
2.4.1 响应面优化试验及结果
在单因素试验基础上,以菌悬液OD600nm值(Y)为响应值,以培养温度(A)、培养基初始pH(B)和初始Ca2+含量(C)为自变量,进行响应面优化试验,Box-Behnken 试验设计及结果见表3,回归模型方差分析见表4。
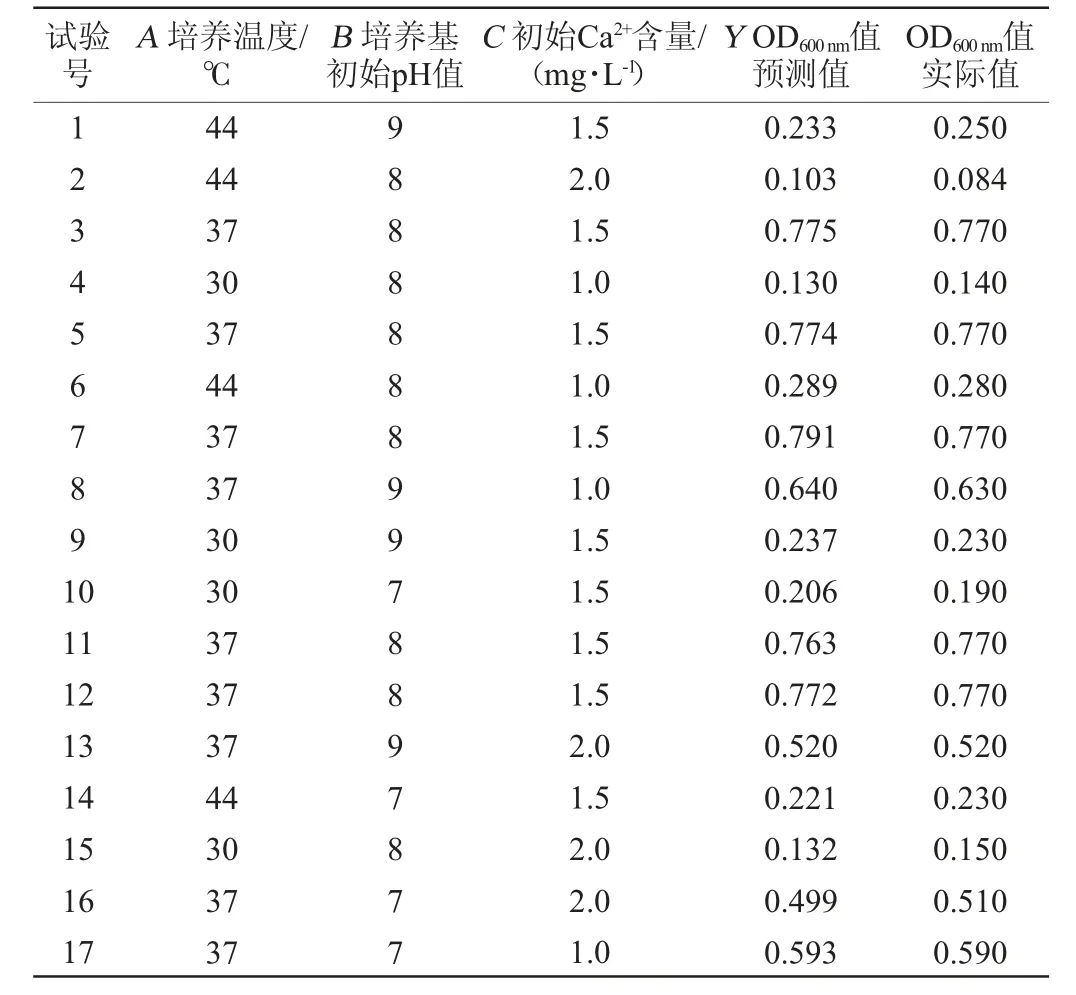
表3 Box-Behnken试验设计及结果Table 3 Design and results of Box-Behnken experiments
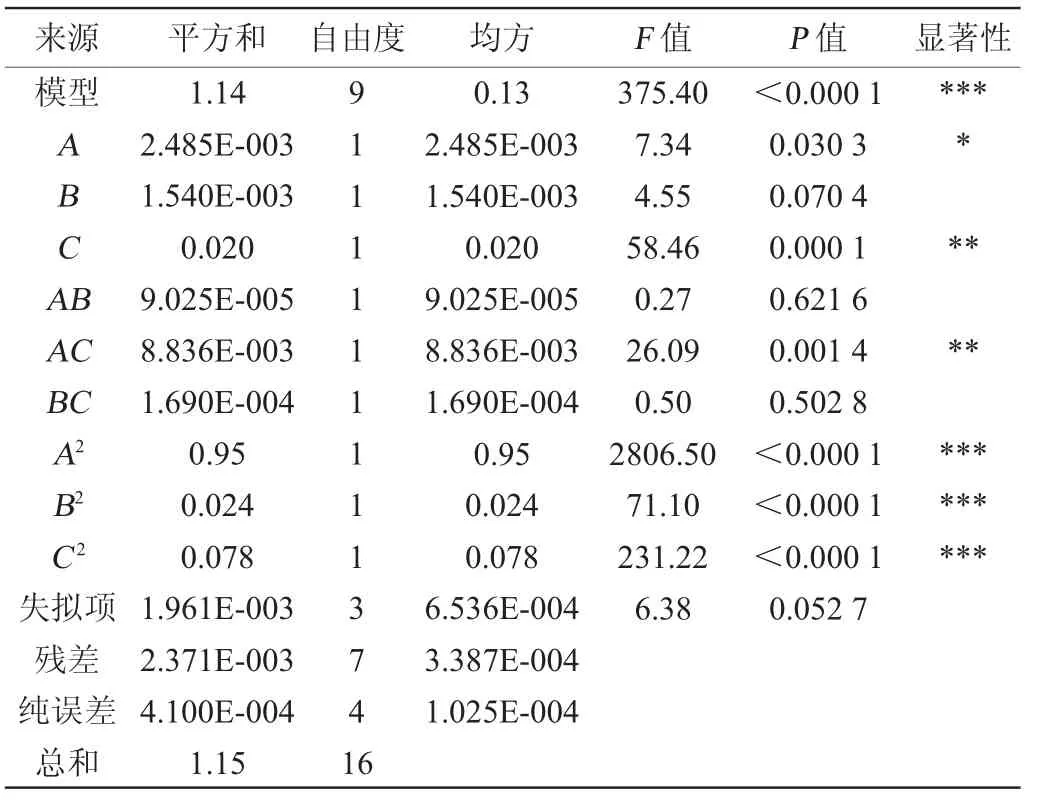
表4 回归模型的方差分析Table 4 Variance analysis of regression model
利用Design-Expert 8.0.6软件对表3数据进行多元回归方程拟合,得到二次多项回归模型方程为:Y=0.78+0.018A+0.014B-0.050C-4.750E-0.03AB-0.047AC-6.500E-0.03BC-0.48A2-0.076B2-0.14C2
2.4.2 回归模型方差分析
由表4可知,模型F值为375.40,P值<0.000 1,表明响应面建立的回归模型达到了高度显著水平,失拟项P值=0.052 7>0.05,不显著,表明模型与试验数据之间拟合度好。模型决定系数R2=0.997 9,调整决定系数R2Adj=0.995 3,说明该模型的拟合度良好且试验误差较小。变异系数(coefficient of variation,CV)为4.07%,在可接受范围内,说明实验操作可行[25]。二次项A2、B2、C2对结果影响高度显著(P<0.001),一次项C、交互项AC对结果影响极显著(P<0.01),一次项A对结果影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。各因素对菌株N3-1的OD600nm值影响程度高低顺序依次为初始Ca2+含量>培养温度>培养基初始pH值。
2.4.3 各因素交互作用对菌株N3-1生长影响的响应面分析
响应曲面图可以直观地反映出两因素交互作用对响应值的影响[26]。通过保持其中两个因素不变而改变另一个因素,以了解两个独立变量之间的交互作用对OD600nm值影响,利用Design-Expert 8.0.6软件绘制各因素交互作用响应面及等高线见图7。
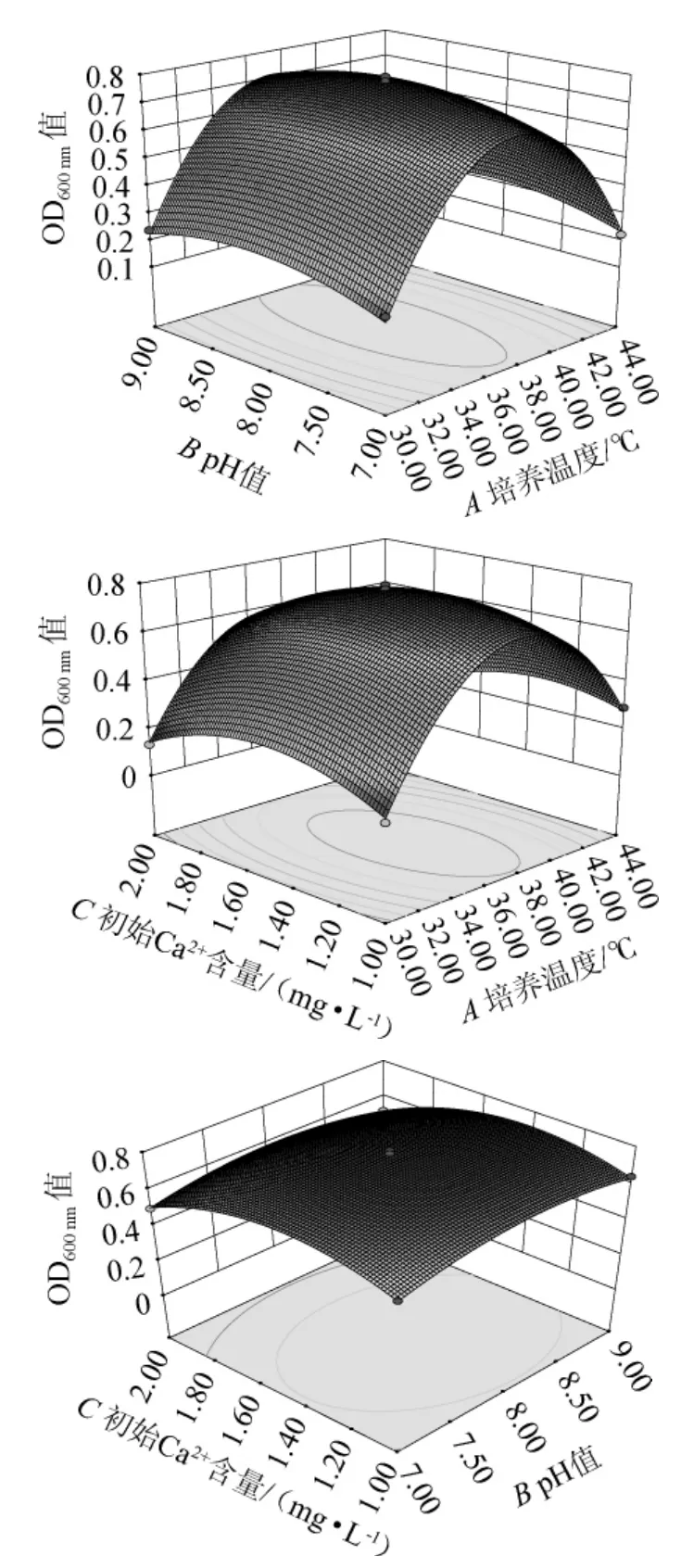
图7 各因素交互作用对菌株N3-1的OD600nm值影响的响应面及等高线Fig.7 Response surface plots and contour lines of effects of interaction between each factor on OD600 nm value of strain N3-1
由图7可知,温度与pH值的交互作用下,温度一定时,随着pH值的增加,OD600nm值无显著变化,当pH值一定时,随着温度增大,OD600nm值先升高后降低,表明温度影响比pH明显;温度与初始Ca2+含量的交互影响下,温度一定时,OD600nm值随Ca2+含量的增加轻微地先增加后减少,当初始Ca2+含量一定时,随温度增大,OD600nm值先增后减的变化趋势,表明初始Ca2+含量比温度影响明显;pH值与初始Ca2+含量的交互影响下,控制其他条件不变,初始Ca2+含量增加,OD600nm值先逐渐升高后降低,控制除pH值外的条件不变,pH值增加,OD600nm值无显著变化,由各因素对纯度影响效果的显著性可以得出,初始Ca2+含量比pH值影响明显。
2.4.4 验证试验
理论上菌株N3-1最佳培养条件为培养温度37.2 ℃,初始Ca2+含量1.41 mg/L,初始pH值8.31,在此条件下预测的OD600nm值为0.775。为了便于实际操作,将培养条件修正为培养温度37 ℃,初始Ca2+含量1.40 mg/L,初始pH值8.3。在此优化培养条件下进行3次平行验证试验,OD600nm值实际值为0.768。实测值与理论值的误差为0.90%,差异不显著,表明该模型可以较好的预测菌株的生长条件。
3 结论
本研究从明胶废水中筛选出一株对Ca2+有较强抗性的细菌,经过形态特征的观察、生理生化鉴定及分子生物学鉴定为尼阿布芽孢杆菌(Bacillus niabensis)。通过单因素及响应面优化确定该菌株的最适培养条件为初始Ca2+含量1.40 mg/L,培养温度37 ℃,初始pH 值为8.3。在此优化培养条件下,OD600nm值为0.768。本研究中筛选得到的Bacillus niabensis可以在高Ca2+浓度的水体环境中生长。今后将继续对该菌钙离子的吸附机理进一步研究,可以为微生物修复水体污染提供新的菌种资源。
