高龄亚临床甲状腺功能减退伴T2DM病人血清铁蛋白、CRP与CIMT的相关性研究
2021-12-06
研究表明,T2DM是亚临床甲状腺功能减退(subclinical hypothyroidism,SCH)的高危因素,T2DM病人中SCH的患病率为13%~32%[1]。SCH与T2DM合并发生时可相互影响,促进病情的发展。氧化应激损伤是糖尿病和心脑血管疾病的病理生理基础,铁作为氧自由基生成的催化剂,可诱导氧化应激的发生,并可影响糖代谢水平[2]。研究证实,T2DM病人伴有血清铁蛋白(serum ferritin,SF)水平异常升高,SF参与T2DM的发生、发展[3]。炎症反应是氧化应激损伤的一种表现,CRP作为机体炎症反应的标志性因子,与心脑血管疾病的发生密切相关,被认为是动脉粥样硬化发生的独立影响因素[4]。颈动脉内膜中层厚度(carotid intima-media thickness,CIMT)作为评价动脉粥样硬化的客观指标,可直接反映心血管疾病的发生风险。本研究通过探究高龄SCH伴T2DM病人SF、CRP与CIMT的关系及影响CIMT增厚的相关因素,为此类病人心血管疾病的防治提供参考。
1 资料与方法
1.1 一般资料 选取2018年1月至2020年1月收治的高龄SCH伴T2DM病人78例为共病组。另以性别、年龄为匹配选取同期收治的单纯SCH及单纯T2DM病人各30例,分别为SCH组、T2DM组。诊断标准:同时符合《成人甲状腺功能减退治疗指南》[5]中SCH的诊断及《中国2型糖尿病防治指南(2017版)》[6]对T2DM的诊断。纳入标准:(1)符合SCH及T2DM的诊断标准;(2)年龄≥80岁;(3)入组前近3个月内未服用磺胺类、甲氧氯普胺等影响甲状腺激素水平的药物。排除标准:(1)存在糖尿病酮症酸中毒、糖尿病高渗性昏迷等严重糖尿病并发症者;(2)伴有恶性肿瘤者;(3)肝、肾等重要器官严重功能障碍者。共病组中男32例,女46例,年龄80~98岁,平均(88.63±4.05)岁,43例有动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD);SCH组男10例,女20例,年龄80~96岁,平均(87.63±5.21)岁,8例发生ASCVD;T2DM组男12例,女18例,年龄80~95岁,平均(88.20±7.23)岁,12例发生ASCVD。3组性别、年龄比较,差异无统计学意义(P>0.05);疾病组的ASCVD发生率高于对照组(P<0.05)。本次研究实施前已获得医院伦理委员会备案,且受检者在研究开始前均签署知情同意书。
1.2 研究方法
1.2.1 SF与CRP检测:采集空腹外周静脉血4 mL,静置后以3000 r/min离心15 min(离心半径10 cm),留取上层血清,使用微粒子酶免疫分析法检测SF水平,以ELISA检测CRP水平,检测仪器与试剂为AxSym i2000全自动免疫分析仪(美国雅培)及配套试剂。
1.2.2 CIMT检测:使用GE Vivid Ⅰ型彩色多普勒超声仪器(美国GE),探头频率为7~10 MHz。指导受检者保持仰卧位,头部偏向受检侧对侧,充分暴露颈部,超声探头自锁骨内侧沿颈总动脉自上而下移动,检测双侧CIMT。参照《超声医学》[7],共检测6个心动周期,取平均值,以CIMT≥1 mm为增厚。
1.3 资料收集 收集高龄SCH伴T2DM病人的一般资料,包括性别、年龄、BMI、吸烟史、饮酒史、入院时血压、基础疾病(高血压史、缺血性事件史、高Hcy血症)、生化指标[CRP、TC、TG、HDL-C、LDL-C、FPG、HbA1c、促甲状腺激素(TSH)、血清总甲状腺素(TT4)、三碘甲状腺原氨酸(TT3)、游离甲状腺素(free thyroxine,FT4)、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、UA]。入院后第2天抽取空腹外周静脉血,离心分离血清,以全自动化学发光免疫分析仪检测甲状腺激素指标,全自动生化分析仪检测血脂指标,快速血糖试纸检测FPG,全自动糖化血红蛋白分析仪及高效液相层析法检测HbA1c,高效液相色谱法检测UA。

2 结果
2.1 共病组、SCH组、T2DM组SF、CRP、CIMT比较 共病组SF、CRP水平与CIMT均高于SCH组与T2DM组,差异有统计学意义(P<0.01),SCH组与T2DM组SF、CRP水平和CIMT比较,差异无统计学意义(P>0.05)。见表1。
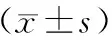
表1 3组血清SF、CRP、CIMT比较
2.2 共病组SF、CRP与CIMT相关性分析 Pearson相关分析显示,SF、CRP水平与CIMT呈正相关(r=0.578、0.605,P<0.05)。
2.3 影响高龄SCH伴T2DM病人CIMT增厚的单因素分析 78例高龄SCH伴T2DM病人中有56例发生CIMT增厚。增厚组的SF、CRP、LDL-C、TC、TSH水平及高血压史比例高于正常组,HDL-C水平低于正常组,差异有统计学意义(P<0.05)。见表2。
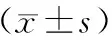
表2 SCH伴T2DM病人CIMT增厚的单因素分析
2.4 影响高龄SCH伴T2DM病人CIMT增厚多因素Logistic回归分析 将单因素分析中有统计学意义的因素作为自变量,进行赋值:高血压史(无=0,有=1)、TC、LDL-C、HDL-C、TSH、SF、CRP为连续变量,以是否出现CIMT增厚为因变量(否=0,是=1)进行Logistic回归分析,结果显示SF、CRP、TC、LDL-C是高龄SCH伴T2DM病人CIMT增厚的危险因素,HDL-C是保护因素(P<0.05)。

表3 SCH伴T2DM病人CIMT增厚的多因素分析
3 讨论
SCH为甲状腺功能减退的早期阶段,有发病隐匿、持续且发病率高的特点。资料显示,老年T2DM出现甲状腺功能异常的风险高于健康人,且以SCH最为常见[8]。随着我国人口老龄化的发展及医疗水平的进步,老年T2DM病人年龄增加及病程延长,导致高龄T2DM病人SCH的发病率上升。SCH伴T2DM病人热量摄入减少时,可导致细胞缺氧,增加血液中的代谢物质,抑制T4向T3转化,导致TSH水平及活性下降,引起TSH的代偿性升高,进而影响胰岛素的降解及肠道对葡萄糖的吸收,造成血糖及血脂的代谢紊乱,促进CIMT增厚,此外SCH病人FSH过低也影响心输出量,并导致血脂异常及机体自由基清除能力下降,二者相互影响,促进动脉粥样硬化的形成[9]。
本研究结果中,疾病组的SF、CRP水平与CIMT均高于SCH组与T2DM组,Pearson相关性分析提示高龄T2DM伴SCH病人SF、CRP水平与CIMT增厚密切相关。SF是机体贮存铁的可溶组织蛋白,其水平可反映机体的铁含量。SF在肝脏中含量最多,过多的铁沉积可增加肝脏负担,导致对胰岛素的摄取、灭活障碍,出现外周高胰岛素血症,并能促进氧化自由基的生成,使肌肉组织及脂肪组织对糖的利用率下降,导致胰岛素摄取障碍而引起胰岛素抵抗,进而影响糖尿病的发生[10-11]。此外高胰岛素血症可促进脂肪细胞对铁的摄取,促使转铁蛋白受体从胞内向细胞表面重新分类,增加机体对铁的贮存,形成恶性循环,而铁过载可促进SCH的发生[12-13]。CRP是机体非特异性炎症指标,可刺激脂肪组织分泌多种细胞因子和激素,影响胰岛素信号的传导,而胰岛素抵抗也可促进机体合成CRP等炎症因子,加重胰岛素抵抗[14]。王炜城等[15]认为CRP水平与SCH可相互影响,但机制仍未明确。SCH及T2DM的发生伴随的脂代谢紊乱、血管内皮损伤与高水平SF、CRP诱导的血管内皮氧化应激损伤,均可导致CIMT增厚,促进动脉粥样硬化斑块的形成。
研究表明,T2DM病人的心血管发病率及死亡率是正常人的4.4倍,且心脑血管疾病是T2DM病人死亡的重要决定因素[16]。年龄是心脑血管疾病发生的危险因素之一,高龄SCH伴T2DM病人的心脑血管发病率及死亡风险大大增加,对病人生命安全造成了严重威胁。本研究结果中单因素分析显示,SCH伴T2DM病人CIMT增厚者的SF、CRP、LDL-C、TC、TSH水平、高血压史占比高于正常组,HDL-C水平低于正常组,说明高龄SCH伴T2DM病人SF、CRP升高与脂代谢异常更加明显;多因素Logistic回归分析显示,SF、CRP、LDL-C、TC是导致高龄SCH伴T2DM病人CIMT增厚的危险因素,HDL-C是保护因素,提示除LDL-C、TC、HDL-C等常规影响CIMT增厚的因素外,SF、CRP亦可增加高龄SCH伴T2DM病人CIMT增厚的风险。在SCH伴T2DM病人中,SF、CRP水平的升高,可加重内分泌紊乱及机体炎症反应状态,促进动脉粥样硬化形成,因此二者均是高龄SCH伴T2DM病人CIMT增厚的危险因素。Prats-Puig等[17]研究证实SF水平可影响CIMT厚度,Ha等[18]发现在韩国健康成年人中SF水平与动脉粥样硬化程度有关,Castro等[19]认为CRP可作为预测心血管疾病发生风险及预后的独立指标,以上研究均证实SF、CRP是CIMT增厚的影响因素。因此,在临床工作中对于高龄SCH伴T2DM病人应加强SF、CRP水平的监测,做好心血管疾病的防治工作,以减少医疗负担。
综上所述,高龄SCH伴T2DM病人SF、CRP水平与CIMT呈正相关,且是导致病人CIMT增厚的危险因素,可作为动脉粥样硬化的检测指标。本研究不足之处在于高龄病人病例数有限,对病人的动脉粥样硬化及心脑血管疾病发生情况未进行随访跟踪证实。
