基于特征图谱、化学计量学和分子对接的复方阿胶浆质量标志物研究
2021-12-04任雪阳宋若兰于啊香马嘉慕折改梅
许 啸,张 淹,任雪阳,王 宇,董 英,宋若兰,于啊香,魏 静,马嘉慕,折改梅*
基于特征图谱、化学计量学和分子对接的复方阿胶浆质量标志物研究
许 啸1,张 淹2,任雪阳1,王 宇1,董 英1,宋若兰1,于啊香1,魏 静1,马嘉慕1,折改梅1*
1. 北京中医药大学中药学院,北京 102488 2. 山东东阿阿胶股份有限公司国家胶类中药工程技术研究中心,山东 聊城 252201
以质量标志物(quality markers,Q-Marker)“五原则”为指导,结合特征图谱、化学计量学、分子对接和含量测定等技术,开展复方阿胶浆(Fufang E’jiao Jiang,FEJ)治疗贫血症的Q-Marker研究。色谱柱Agilent Zorbax SB AQ-C18(250 mm×4.6 mm,5 µm),流动相为0.1%甲酸乙腈溶液-0.1%甲酸水溶液,体积流量1.0 mL/min,柱温30 ℃,检测波长330 nm,焦地黄苯乙醇苷A1为参照峰,建立FEJ特征图谱。采用层次聚类分析(hierarchical clustering analysis,HCA)、主成分分析(principal component analysis,PCA)、偏最小二乘法-判别分析(partial least square method-discriminant analysis,PLS-DA)对不同批次FEJ进行分析。查阅《中国药典》和文献,结合组方配伍环境(君、臣、佐使)、成分传递与溯源等多因素,收集筛选质量控制6个关键成分。在GEO数据库中检索筛选贫血症(anemia)的差异基因,采用Discovery Studio 2016 v16.1软件,将成分与贫血症相关靶点进行对接验证。以330、270 nm双波长同时测定FEJ中异毛蕊花糖苷和党参炔苷的含量。FEJ特征图谱中指认了咖啡酸、绿原酸、洋地黄叶苷C、阿魏酸、焦地黄苯乙醇苷A1、毛蕊花糖苷、焦地黄苯乙醇苷B1、异毛蕊花糖苷共8个特征成分。HCA、PCA和PLS-DA将16批FEJ分为3类,其中异毛蕊花糖苷、洋地黄叶苷C和焦地黄苯乙醇苷A1对FEJ质量影响最为显著。8个特征成分和6个关键成分的分子对接结果表明,异毛蕊花糖苷、党参炔苷、绿原酸、毛蕊花糖苷4个成分能够与激肽原-1(kininogen-1,KNG1)、泛素样蛋白ISG15(ubiquitin-like protein ISG15,ISG15)、赖氨酸特异性脱甲基酶6A(lysine-specific demethylase 6A,KDM6A)、乙酰化酶动力蛋白-3(dynamin-3,DNM3)、蛋白酶激活受体2(proteinase-activated receptor 2,F2RL1)、半胱氨酰白三烯受体1(cysteinyl leukotriene receptor 1,CYSLTR1)6个靶蛋白通过氢键、疏水键、π-π键等作用力结合,具有较好的活性,可作为FEJ的Q-Marker。16批样品中异毛蕊花糖苷、党参炔苷质量浓度分别为6.05~12.30、9.14~16.30 μg/mL。建立了FEJ特征图谱,结合化学计量学和分子对接等技术,筛选了4个Q-Marker异毛蕊花糖苷、党参炔苷、毛蕊花糖苷、绿原酸,并建立了异毛蕊花糖苷、党参炔苷的含量测定方法,为FEJ质量控制提供参考。
复方阿胶浆;质量标志物;特征图谱;化学计量学;分子对接;贫血症;层次聚类分析;主成分分析;偏最小二乘法-判别分析;质量控制;咖啡酸;绿原酸;洋地黄叶苷C;阿魏酸;焦地黄苯乙醇苷A1;毛蕊花糖苷;焦地黄苯乙醇苷B1;异毛蕊花糖苷
复方阿胶浆(Fufang E’jiao Jiang,FEJ)包括阿胶、红参、熟地黄、党参、山楂共5味中药。原方出自明代《景岳全书》中“两仪膏”,按照“气血互生,气升血长”的中医理论加味而成。临床常用于气血两虚、头晕目眩、心悸失眠、食欲不振及白细胞减少症和贫血等症[1]。《中国药典》2020年版FEJ质量标准重点关注了阿胶的真伪和优劣。在中医理论中,气血相关理论与治疗血管生成相关。现代药理研究表明,血管新生是涉及多种细胞如内皮细胞和血管平滑肌细胞的多步骤复杂生物过程,是相关细胞因子、细胞外基质等与细胞之间相互作用的结果。在缺血刺激下,新的血管和侧支循环会逐渐生成,达到改善缺血的目的[2-3]。文献报道,斑马鱼模型可用于研究血管生成[4-5]、微血管功能[6]等方面。本课题组前期研究发现FEJ的促血管生成活性优于单味药阿胶。因此红参等4味植物来源中药对FEJ功效有很重要的贡献,质量标准应该对其予以关注。
2016年,刘昌孝院士[7-8]提出了中药质量标志物(quality marker,Q-Marker)这一中药质量评价与质量控制的核心概念,“五原则”从质量传递与溯源、成分特有性、成分的有效性、成分可测性以及复方配伍环境5个方面,贯穿并指导了中药Q-Marker的研究与发现[9]。中药特征图谱是一种综合的、可量化的鉴别手段,能够反映中药多成分特点,已被广泛应用于中药及中药复方制剂的质量控制[10-11]。将化学计量学方法如层次聚类分析(hierarchical cluster analysis,HCA)、主成分分析(principal components analysis,PCA)法、偏最小二乘法-判别分析(partial least squares-discrimination analysis,PLS-DA)等用于特征图谱的数据分析可以更为有效的挖掘信息。有文献报道[12-14],采用HCA分类结果,结合PCA和PLS-DA得到各成分的贡献率,从而挖掘造成组间差异的主要成分。这些成分可以作为Q-Marker的候选成分。
但是由于特征图谱中实验条件(如供试品制备方法、检测波长等)的局限,存在不能全部体现化学成分信息的问题。这个也会影响到潜在Q-Marker的选择,或者会造成潜在Q-Marker的丢失。因此,本研究又通过查阅《中国药典》2020年版和参考文献,整理得到FEJ各药味中活性成分,并从中药组方的配伍环境(君、臣、佐、使)、成分的传递和溯源等方面对各单味药材饮片进行分析,从而有效地弥补特征图谱成分信息不全,获取质量控制的关键成分。从而满足Q-Marker五原则的质量传递与溯源、成分特有性以及复方配伍环境等特征。
分子对接技术是以结构分子生物学和计算机辅助药物设计相结合的方式,通过将配体与受体进行对接,评价其对接体系的稳定性,筛选与受体活性部位空间和电性特征相匹配的小分子化合物。该技术不仅周期短,操作性强,而且还避免了药理实验稳定性差的缺点,已经逐渐成为中药活性成分筛选的重要手段[15-16]。本研究利用分子对接技术,对FEJ中的特征成分和关键成分进行治疗贫血症的活性筛选,从多种角度探索药物与疾病的关联,同时确保了所选Q-Marker的有效性。最后,以Q-Marker为指标成分,建立FEJ中熟地黄、党参的多成分含量测定方法,为FEJ Q-Marker可测性提供了依据。该研究科学合理地提升了FEJ的质量标准,弥补了以总氮量为唯一含量测定方法。本研究的技术路线如图1。
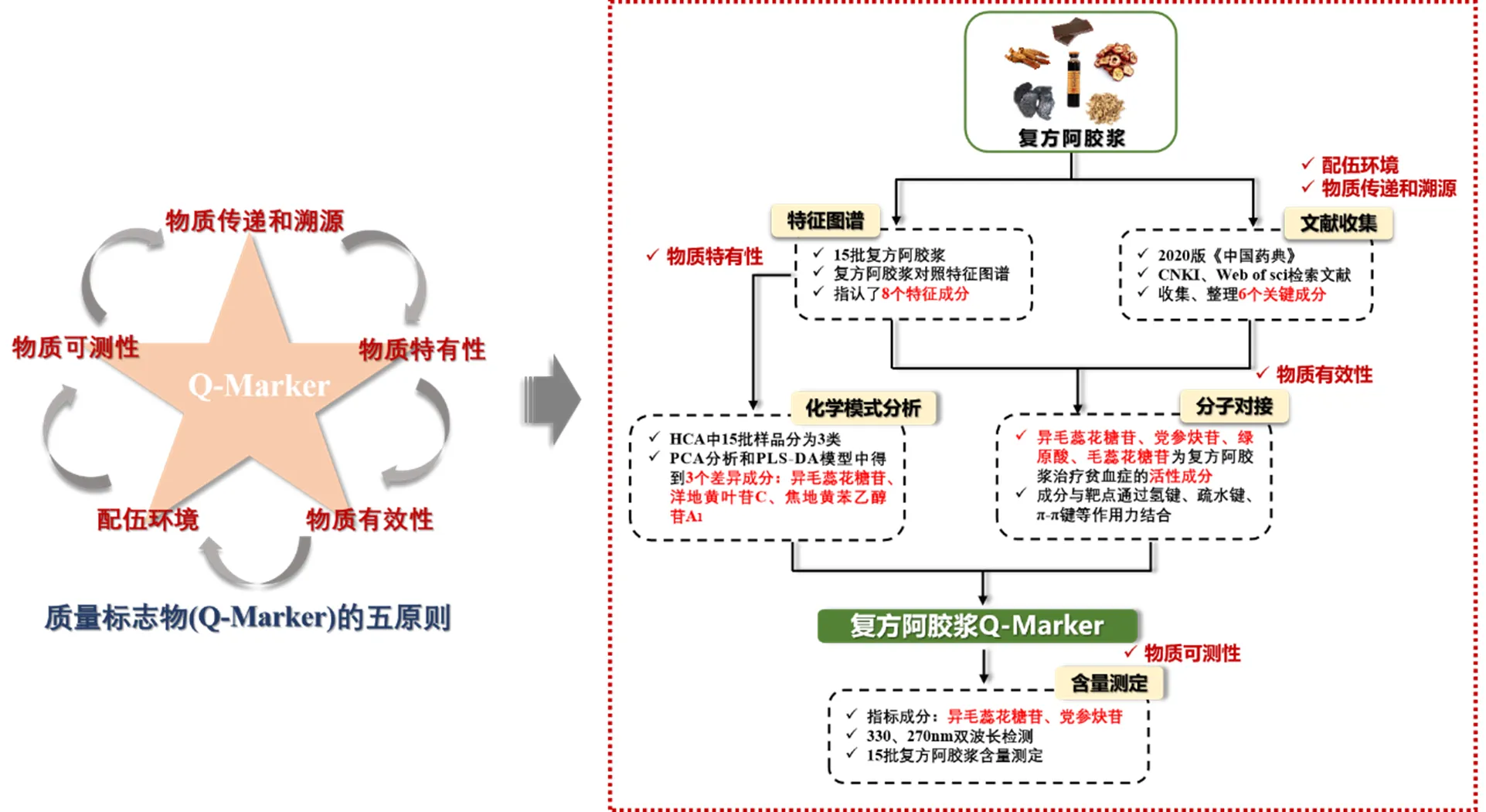
图1 FEJ Q-Marker研究的技术路线
1 仪器与材料
1.1 仪器
华谱科仪Acchorm S6000高效液相色谱仪,配备在线脱气机、四元泵、自动进样器、柱温箱、DAD检测器,华谱科仪(北京)科技有限公司;BT25S型十万分之一电子天平,北京赛多利斯科学仪器有限公司;MX-S型涡旋振荡器,北京大龙兴创实验仪器有限公司;3-18N型高速离心机,湖南恒诺仪器设备有限公司;8302型恒温水浴锅,上海利浦自动化仪表厂。
1.2 材料与试剂
FEJ(批号1905075、1907011、1907012、1907014、1907015、1907017、1907020、1907021、1907022、1909004、1909007、1909010、1909011、1909013、1909015、1909016,编号依次对应为S1~S16),以及批号为1905075批次所对应的红参药材(批号201812-001)、党参药材(批号201905-002)、熟地黄药材(批号201905-005)、山楂药材(批号201905-002)、红参阴性样品、党参阴性样品、熟地黄阴性样品、山楂阴性样品,均由东阿阿胶股份有限公司提供。对照品咖啡酸(批号110885-200102)、绿原酸(批号110753-200413)、阿魏酸(批号110773-201915),购于中国食品药品检定研究院;对照品焦地黄苯乙醇苷A1(批号DST190902-070)、毛蕊花糖苷(批号DST190422-061)、异毛蕊花糖苷(批号DST200513-060)、焦地黄苯乙醇苷B1(批号DST201203-071)、洋地黄叶苷C(批号DST201109-057),购于成都德思特生物技术有限公司;对照品党参炔苷(批号PRF9121002),购自成都普瑞法科技开发有限公司;以上所有对照品的质量分数均≥95%。甲醇、乙腈为色谱级,美国Fishier Scientific公司,其余试剂均为分析纯。超纯水由实验室Millipore Synergy超纯水系统自制。
2 方法与结果
2.1 FEJ HPLC特征图谱
2.1.1 色谱条件 Agilent Zorbax SB-AQ C18色谱柱(250 mm×4.6 mm,5 µm),以0.1%甲酸乙腈溶液为流动相A,以0.1%甲酸水溶液为流动相B,梯度洗脱程序:0~20 min,2%~5% A;20~35 min,5%~12% A;35~45 min,12%~14% A;45~55 min,14%~20% A;55~65 min,20%~23% A;65~80 min,23%~35% A;体积流量1 mL/min;柱温30 ℃;检测波长330 nm;进样量10 μL。
2.1.2 供试品溶液的制备 精密量取FEJ 2 mL,加入乙腈6 mL,涡旋至充分混匀,离心,取上清液,残渣加入乙腈6 mL,涡旋至充分混匀,离心,合并上清液,蒸干,残渣加30%甲醇溶解,并转移至1 mL量瓶中,加30%甲醇至刻度,摇匀,即得供试品溶液。
2.1.3 对照品溶液的制备 取咖啡酸、绿原酸、洋地黄叶苷C、阿魏酸、焦地黄苯乙醇苷A1、毛蕊花糖苷、焦地黄苯乙醇苷B1、异毛蕊花糖苷对照品适量,精密称定,加甲醇制成分别含咖啡酸20 μg/mL、绿原酸20 μg/mL、洋地黄叶苷C 50 μg/mL、阿魏酸20 μg/mL、焦地黄苯乙醇苷A150 μg/mL、毛蕊花糖苷20 μg/mL、焦地黄苯乙醇苷B150 μg/mL、异毛蕊花糖苷50 μg/mL的混合溶液,即得混合对照品溶液。
2.1.4 精密度试验 取编号为S1的FEJ(批号1905075),按“2.1.2”项下方法制得供试品溶液,按“2.1.1”项下色谱条件连续进样6次,记录色谱峰峰面积。以焦地黄苯乙醇苷A1为参照峰,各共有峰的相对峰面积RSD均小于1.70%,相对保留时间RSD均小于0.05%,表明仪器精密度良好。
2.1.5 重复性试验 取编号为S1的FEJ(批号1905075)6份,按“2.1.2”项下方法制得供试品溶液,按“2.1.1”项下色谱条件分别进样,记录峰面积。以焦地黄苯乙醇苷A1为参照峰,各共有峰的相对峰面积RSD均小于2.99%,相对保留时间RSD均小于0.03%,表明方法重复性良好。
2.1.6 稳定性试验 取编号为S1的FEJ(批号1905075),按“2.1.2”项下方法制得供试品溶液,按“2.1.1”项下色谱条件,分别在0、2、4、6、8、16、24 h进样,记录峰面积。以焦地黄苯乙醇苷A1为参照峰,各共有峰的相对峰面积RSD均小于2.08%,相对保留时间RSD均小于0.09%,表明供试品溶液在24 h内稳定性良好。
2.1.7 HPLC特征图谱的生成与相似度评价 取16批FEJ(S1~S16),按“2.1.2”项下方法制得供试品溶液,按“2.1.1”项下色谱条件分别进样。采用《中药指纹图谱相似度评价评价系统(2012A版)》对所记录图谱的AIA文件进行分析。以S1为参照图谱,时间窗宽度设为0.2 min,对色谱峰进行多点校正和全峰匹配,生成16批FEJ的特征图谱匹配图以及对照指纹图谱,见图2。
其中,5号峰焦地黄苯乙醇苷A1分离度好,保留时间居中,选择其为参照峰,计算S1~S16特征图谱与对照特征图谱的相似度,结果分别为0.998、0.994、0.996、0.998、0.998、0.997、0.998、0.994、0.993、0.998、0.997、0.994、0.989、0.991、0.996、0.997,均大于0.9,表明各批次样品的化学成分稳定。
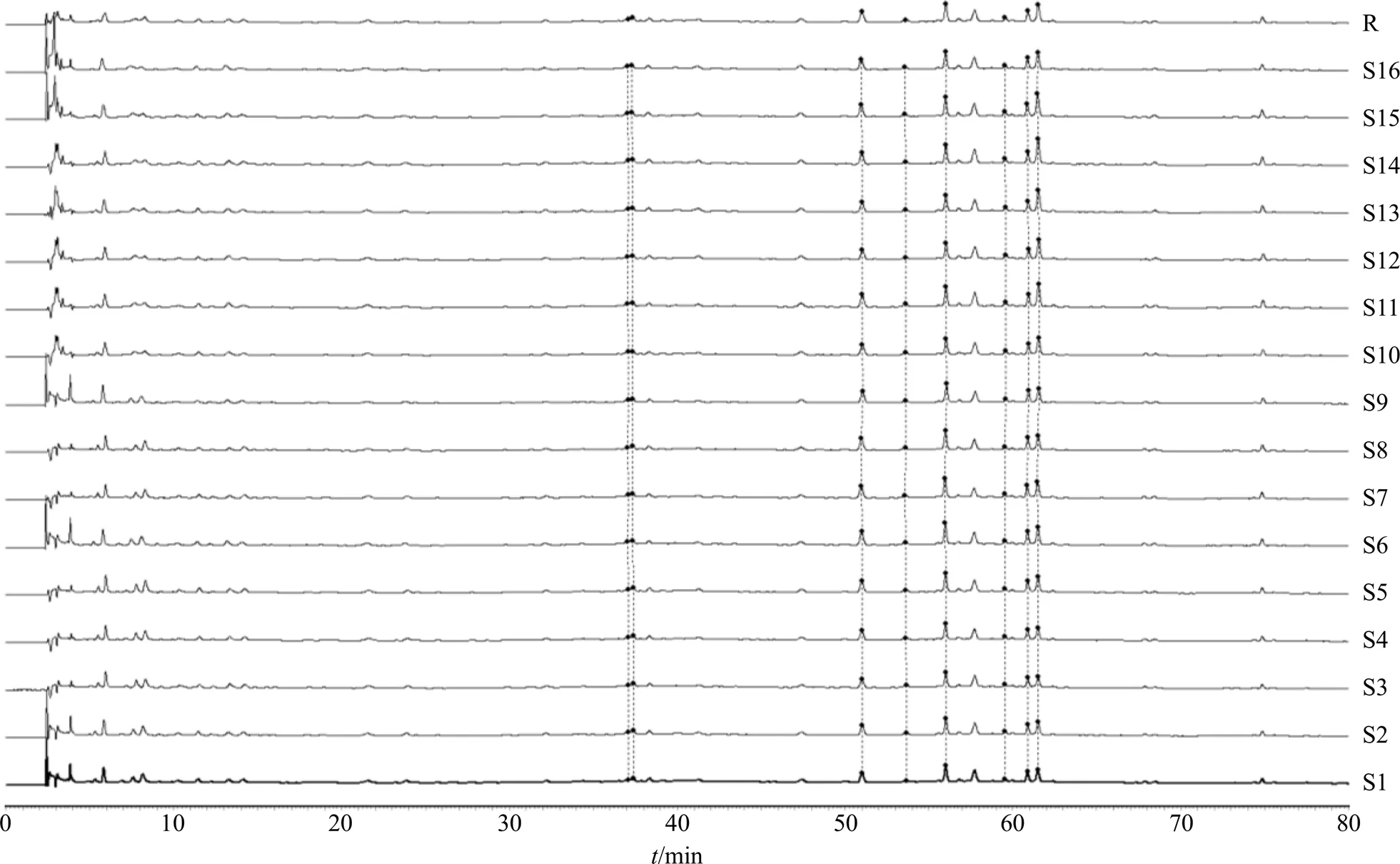
图2 16批FEJHPLC特征图谱 (S1~S16) 及其对照特征图谱(R)
2.1.8 共有峰的归属与指认 根据对照品共指认出8个化合物,1~8号共有峰分别为咖啡酸、绿原酸、洋地黄叶苷C、阿魏酸、焦地黄苯乙醇苷A1、毛蕊花糖苷、焦地黄苯乙醇苷B1、异毛蕊花糖苷,结果见图3。
取FEJ(批号1905075)及对应批次的单味药材饮片,按“2.1.2”项制得红参、党参、熟地黄、山楂的供试品溶液和FEJ供试品溶液,按“2.1.1”项下色谱条件分别进样。通过查阅各味中药成分文献报道及各成分对照品色谱和光谱图,对FEJ特征图谱色谱峰进行归属,见图4。结果显示,1号峰咖啡酸为党参[17]、熟地黄[18-19]中的共有成分;2号峰绿原酸为红参[20-21]、山楂[22]中的共有成分;3号峰洋地黄叶苷C[23]为熟地黄中的成分;4号峰阿魏酸为党参、熟地黄中的共有成分;5号峰焦地黄苯乙醇苷A1、6号峰毛蕊花糖苷、7号峰焦地黄苯乙醇苷B1、8号峰异毛蕊花糖苷为熟地黄中的成分[23-24]。
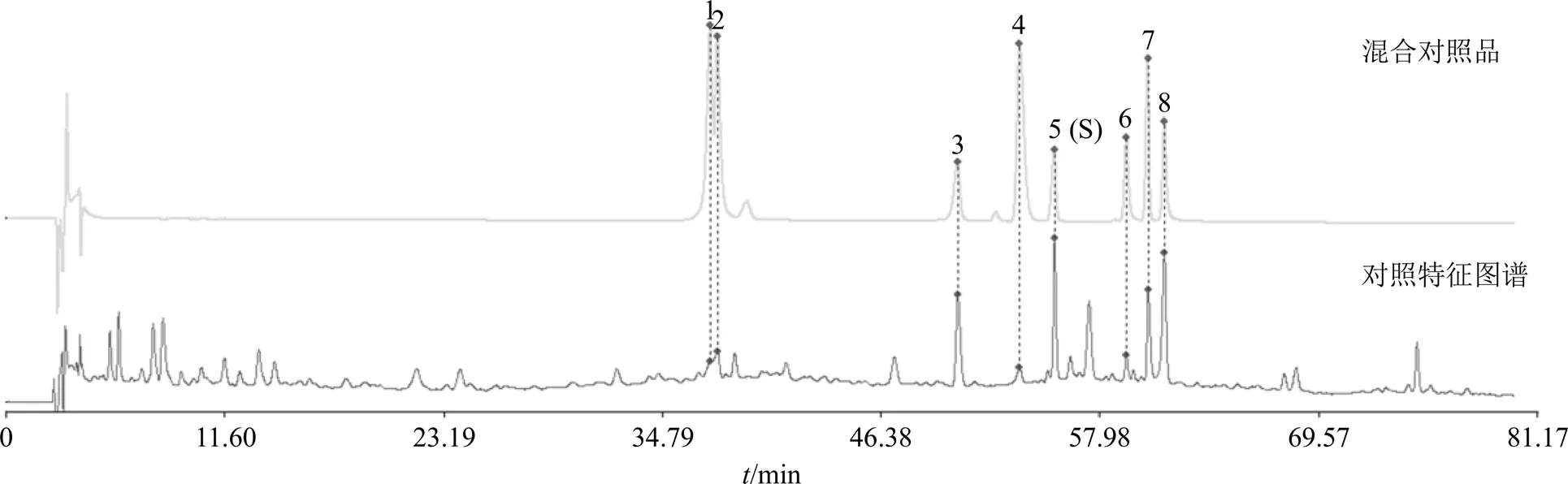
1-咖啡酸 2-绿原酸 3-洋地黄叶苷C 4-阿魏酸 5-焦地黄苯乙醇苷A1 (S) 6-毛蕊花糖苷 7-焦地黄苯乙醇苷B1 8-异毛蕊花糖苷
供试品溶液制备时使用乙腈沉淀了蛋白,因而在此色谱条件所得的HPLC特征图谱中暂无共有峰来自阿胶。
2.2 化学模式分析
2.2.1 HCA 采用Origin 2019软件进行分析,运用组间连接法,Euclidean距离为测度,以FEJ特征图谱中的8个特征峰峰面积为观测量,绘制聚类分析图,见图5。16批样品分成3大类:S1~S4为第1类,S5~S11为第2类、S12~S16为第3类,说明不同批次的合格药材所生产的产品含量存在一定差异,此可能与饮片的原药材来源、饮片的加工等过程有关。
2.2.2 PCA和PLS-DA 为了进一步分析造成不同批次样品之间差异的化学成分,以样品S1~S16为变量,8种成分的峰面积为变量,利用SIMCA 14.1软件进行PCA和PLS-DA处理,结果见图6。将16批样品分为3类,以PLS-DA模型中重要性投影(VIP)值>1.0筛选不同批次样品间的差异性成分,VIP值的大小表明了对样品分类的贡献程度。结果显示,PCA和PLS-DA共得到3个成分,分别为8号峰异毛蕊花糖苷、5号峰焦地黄苯乙醇苷A1和3号峰洋地黄叶苷C,表明这3种成分是影响不同批次样品之间质量差异贡献较大的特征成分。提示在FEJ整个生产过程中可重点监控这3个成分,减小批次间的差异性,为FEJ Q-Marker的选定提供参考。
2.3 分子对接验证
2.3.1 基于GEO数据库的贫血症的靶点筛选 《中国药典》2020年版中,FEJ功能主治为“补气养血”,常用于治疗气血两虚、白细胞减少症和贫血等症。“气血两虚”在传统中医理论中涉及多个脏腑的气血阴阳失调,在西医中并无对应的病症,但从临床表现来看,以贫血症和慢性疲劳综合征的临床症状与其类似[25]。因此对贫血症进行下一步研究。
在GEO数据库中进行基因表达谱芯片筛选,以“anemia normal”为关键词、实验以人源作为样本,得到基因表达谱芯片GSE32719。利用R软件及aggy、limma、pheatmap等R软件包,对芯片进行表达值背景矫正和表达谱数据的归一化预处理,包括原始数据格式的转换,缺失值补充,背景矫正及用数据标准化;以|logFC|≥1且<0.05为筛选条件,选择统计学检验后差异最为显著的基因作为研究对象,获取贫血症正常组与实验组差异表达基因,并将探针名转化为标准基因名。

图4 红参、党参、熟地黄、山楂与FEJ供试品溶液的HPLC图

图5 16批FEJ的HCA图
结果得到贫血症相关658个差异基因,其中,以logFC呈现正值为上调基因463个,列出调控最显著的前20位差异基因;以logFC呈现负值为下调基因有195个,列出调控最显著的前20位差异基因并绘制差异基因火山图和热图,见图7。

图6 16批FEJ的PLS-DA模型及VIP值
2.3.2 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络的构建及拓扑分析 将上述得到的差异基因导入String平台(https://string-db.org),选择“multiple proteins”模式,蛋白种属设为“Home sapiens”,筛选条件为最低相互作用阈值取“highest confidence(≥0.9)”构建PPI网络,见图8。网络中节点(node)表示靶点蛋白,边(edge)表示蛋白与蛋白之间的相互作用,共涉及536个节点和232条边。平均节点度值为0.866 6,平均局部聚类系数为0.225。PPI网络富集的值为0.007 47,表明该网络具有显著的相互作用。

图7 贫血症差异表达基因火山图(A)和热图(B)

图8 PPI网络图
将PPI数据结果以*.tsv格式导出,导入Cytoscape 3.7.2软件,利用CytoNCA 2.1.6插件进行网络拓扑分析,计算靶点拓扑参数包括网络节点度(degree centrality,DC)、介数中心度(betweenness centrality,BC)和紧密度(closeness centrality,CC),运用-score函数[-score=[-mean()]/std(),其中,代表拓扑参数值,mean()为平均数,std()为标准差]进行标准化处理,将标准化处理后的拓扑参数值相加。度、紧密度和介数可以用于评价节点在网络中的中心性和重要性,节点的度、紧密度和介数越高,节点在交互网络中的重要性越高[26]。
选择排名前20的靶点作为贫血症的关键靶点,各靶点特征参数见表1。
2.3.3 关键靶点(靶蛋白)信息的收集与前处理 选取贫血症差异基因中排名前10的关键靶点,在PDB数据库(http://www. rcsb.org)中搜索并下载靶蛋白的三维结构,选择来源为人源(human)、解析度小(<0.3 nm)、X-Ray解析的晶体结构作为研究对象。将靶蛋白导入Discovery Studio 2016 v16.1软件中,利用Clean Protein模块和Prepare Protein模块对靶蛋白进行删除多余蛋白质构象、删去水分子、补全不完整残基、加氢等蛋白预处理。选择靶蛋白特有的小分子配体作为活性中心,删除位于活性口袋位置的配体小分子(原配体),暴露活性口袋并将其定义为对接体系中受体分子。

表1 贫血症靶点特征参数
2.3.4 原配体对接验证 将靶蛋白中的原配体单独提取,基于靶蛋白中的原配体的活性口袋位点,利用CDocker模块,将原配体对接到对应的活性口袋中,计算靶蛋白中原配体的分子构象与对接后的分子构象的均方根偏差(RMSD)。若RMSD<0.20 nm,则说明对接所得分子构象可以在一定程度上还原配体与受体的结合模式,从而证明所选择的对接方法与参数设置具有合理性,结果见表2。得到靶蛋白KNG1、ISG15、KDM6A、DNM3、F2RL1、CYSLTR1,这些靶蛋白的RMSD均小于0.2 nm,说明所选择的对接方法及参数设置合理,可以用于下一步与成分对接。
2.3.5 成分信息的收集与前处理 复方制剂药味组成繁杂,化学成分众多,某些成分在特征图谱的单一检测波长下吸收较弱,难以体现。因此,通过查阅《中国药典》和相关文献,对红参、熟地黄、党参、山楂中可能成为Q-Marker的成分进行收集筛选,扩充FEJ Q-Marker的选择。筛选得到红参、熟地黄、党参、山楂中的关键成分人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、党参炔苷、枸橼酸、毛蕊花糖苷。同时结合特征图谱研究中得到的8个特征成分,最终整理得到13个成分进行分子对接验证。

表2 靶点活性口袋信息及计算结果
在PubChem数据库中搜索并下载成分的2D结构,保存为.sdf格式。将结构导入Discovery Studio 2016 v16.1软件中,利用Prepare Ligands模块对小分子配体进行加氢、产生三维结构和异构体等预处理,并利用Minimize Ligands模块赋予CHARMm力场进行能量最小化。
2.3.6 成分与关键靶点(靶蛋白)对接 利用Discovery Studio 2016 v16.1软件的CDocker模块,将潜在活性成分对接到处理好的活性口袋中。SDS Site Sphere半径根据原配体对接情况设定,Top Hit设为10,Pose Cluster Radius设为0.5,其他参数设置为默认值,对接打分值选取-cdocker interaction energy值。对接打分值评价成分与靶点的相互作用,CDocker Energy值越低(即-cdocker interaction energy值越高),则说明化学成分与蛋白受体对接体系越稳定,对接结果越可靠[27],其成为活性成分可能性越高。以原配体与靶蛋白对接后的对接打分值作为阈值,选取对接打分值大于阈值的成分作为FEJ治疗贫血症的活性成分,最终得到8个对接打分值大于阈值的成分,结果见表3。
分子对接结果表明,异毛蕊花糖苷、党参炔苷、绿原酸、毛蕊花糖苷等成分与各个靶点均有较好的结合,对接打分值较高。其中,异毛蕊花糖苷与靶蛋白DNM3和6RZ5的对接打分值最高;党参炔苷与靶蛋白KDM6A的对接打分值最高;绿原酸与靶蛋白F2RL1对接打分值最高;毛蕊花糖苷与靶蛋白ISG15对接打分值最高。说明异毛蕊花糖苷、党参炔苷、绿原酸、毛蕊花糖苷4个成分对贫血症靶点能够较好地作用于贫血症靶点,可作为FEJ治疗贫血症的活性成分。

表3 活性成分的对接打分值
进一步分析活性成分与靶蛋白的相互作用,以异毛蕊花糖苷与靶蛋白DNM3为例分析成分与靶蛋白之间的相互作用,见图9。图中左侧为成分与靶蛋白对接图,中间为配体与受体结合处相互作用3D图,右侧为配体与受体结合处相互作用2D图。
异毛蕊花糖苷结合于DNM3的蛋白RBD空腔中,与DNM3的关键氨基酸SER41、ASP208、ASN236、SER238、LYS206、GLY43、SER45、LYS44、ARG237发生氢键作用,与LEU209、VAL64发生疏水作用。结合的关键氨基酸残基有酸性氨基酸残基ASP208和碱性氨基酸残基LYS44、ARG237,可形成氢键或盐桥,构成一个具有可成药性的潜在活性位点,从而发生相互作用。

图9 异毛蕊花糖苷与靶蛋白DNM3的相互作用
通过分子对接技术,对质量控制中的特征成分和关键成分进行活性验证,得到异毛蕊花糖苷、党参炔苷、绿原酸、毛蕊花糖苷4个成分可作为FEJ的Q-Marker。其中,绿原酸在山楂、熟地等多个药味中均有,专属性差。毛蕊花糖苷在FEJ中含量很低,含量测定难度高。异毛蕊花糖苷是熟地黄的专属性成分,党参炔苷是党参的专属性成分。这两个成分可溯性和有效性良好。因此将Q-Marker异毛蕊花糖苷和党参炔苷作为指标成分,进行FEJ含量测定研究。
2.4 FEJ多成分含量测定
2.4.1 色谱条件 Thermo hypersil gold C18色谱柱(250 mm×4.6 mm,5 μm),以0.1%甲酸乙腈溶液为流动相A,以0.1%甲酸水溶液为流动相B梯度洗脱,梯度洗脱程序:0~15 min,2%~20% A;15~30 min,20% A;30~35 min,20%~22% A;35~40 min,22%~25% A;体积流量1 mL/min;柱温30 ℃;检测波长330、270 nm;进样量10 μL。
2.4.2 供试品溶液的制备 精密量取FEJ 2 mL,加入乙腈6 mL,涡旋至充分混匀,离心,取上清液,残渣加入乙腈6 mL,涡旋至充分混匀,离心,合并上清液,蒸干,残渣加30%甲醇溶解,并转移至1 mL量瓶中,加30%甲醇至刻度,摇匀,即得供试品溶液。同法制得熟地黄阴性样品溶液和党参阴性样品溶液。
2.4.3 对照品溶液的制备 取异毛蕊花糖苷、党参炔苷对照品适量,精密称定,加甲醇制成含异毛蕊花糖苷25 µg/mL、党参炔苷50 µg/mL的混合溶液,即得对照品溶液。
2.4.4 线性关系考察 取异毛蕊花糖苷对照品适量,精密称定,置于5 mL量瓶中,加甲醇制成含有异毛蕊花糖苷0.484 mg/mL的对照品溶液。取党参炔苷对照品适量,精密称定,置于5 mL量瓶中,加甲醇制成含有党参炔苷0.478 mg/mL的对照品溶液。分别精密量取异毛蕊花糖苷对照品溶液和党参炔苷对照品溶液2.5 mL,配制成混合对照品溶液。取混合对照品溶液,用甲醇分别稀释0、2、5、10、50倍,配制成系列质量浓度的混合对照品溶液,分别进样。以质量浓度()对色谱峰面积()绘制标准曲线,进行线性回归,得2种成分回归方程分别为异毛蕊花糖苷=14 533-1 357.8,=0.999 6,线性范围4.84~242.00 μg/mL;党参炔苷=10 026+1 3224,=0.999 6,线性范围4.78~239.00 μg/mL。
2.4.5 专属性试验 对异毛蕊花糖苷和党参炔苷的混合对照品溶液、FEJ供试品溶液(批号1905075),以及批号1905075 FEJ所对应的熟地黄阴性样品和党参阴性样品进行测定。
通过双波长检测,在330 nm下检测异毛蕊花糖苷,在270 nm下检测党参炔苷。结果表明,检测波长330 nm下熟地黄阴性样品对FEJ供试品中异毛蕊花糖苷的测定无干扰;检测波长270 nm下党参阴性样品对FEJ供试品中党参炔苷的测定无干扰,见图10,说明该方法专属性强。
2.4.6 精密度试验 取FEJ样品(批号1905075),按“2.4.2”项下方法制备供试品溶液,连续进样6次,测定异毛蕊花糖苷和党参炔苷,结果各成分峰面积的RSD分别为0.86%、0.87%,满足精密度限度(RSD)为6%[28],表明仪器精密度良好。
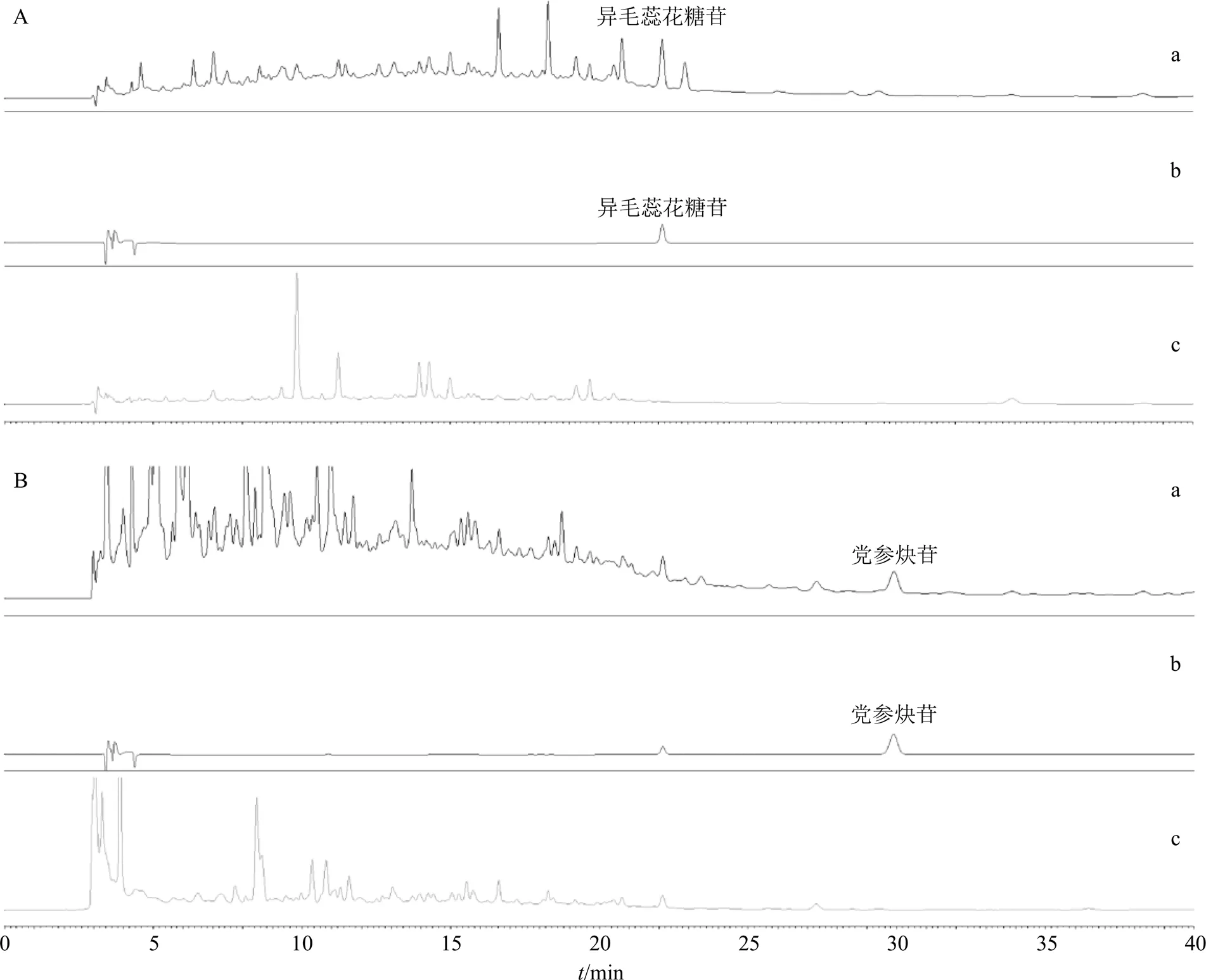
图10 FEJ供试品(a)、混合对照品(b)、阴性对照溶液(c) 在检测波长330 nm (A) 和270 nm (B) 下的HPLC图
2.4.7 重复性试验 取FEJ样品(批号1905075),按“2.4.2”项下方法制备6份供试品溶液,测定异毛蕊花糖苷和党参炔苷,结果各成分峰面积的RSD分别为2.01%、2.01%,满足重复性限度(RSD)为6%[28],表明方法重复性良好。
2.4.8 稳定性试验 取FEJ样品(批号1905075),按“2.4.2”项下方法制备供试品溶液,分别于0、2、4、8、12、24 h进样,测定异毛蕊花糖苷和党参炔苷,结果各成分峰面积的RSD分别为1.68%、1.67%,表明24 h内,供试品溶液稳定性良好。
2.4.9 加样回收试验 取FEJ样品(批号1905075)6份,每份1 mL,按照接近1∶1的量计算所要添加的2种成分的对照品,按“2.4.2”项下方法制备供试品溶液,依法提取测定,计算各成分的回收率。结果表明,异毛蕊花糖苷和党参炔苷的平均回收率分别为101.13%、103.19%,RSD分别为2.71%、2.90%,满足回收率限度为80%~115%[28],表明方法的准确度良好。
2.4.10 样品测定结果 取16个批次(S1~S16)的FEJ,每个批次平行制备3份供试品溶液,依次进样测定,结果见表5。16批FEJ中异毛蕊花糖苷和党参炔苷的质量浓度分别在6.05~12.30 μg/mL、9.14~16.30 μg/mL。
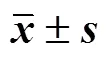
表4 FEJ中异毛蕊花糖苷和党参炔苷含量测定结果(, n = 3)
3 讨论
3.1 FEJ Q-Marker的选择及分析
随着中医药学的飞速发展,中成药的普及性和应用性越来越广。2016年刘昌孝院士[7-8]提出了中药Q-Marker概念,形成了中药产品质量控制的新理念。从生源途径、化学物质基础、炮制加工过程、药效研究和中医理论等多个层面,密切关联了中药的物质基础、有效性和质量控制,为全面提升中药质量标准提供理论和方法的支持[29-30]。
本研究从特征图谱中指认了8个成分,保证Q-Marker的特有性和可溯性。化学计量学分析提示了异毛蕊花糖苷、洋地黄叶苷C和焦地黄苯乙醇苷A1这3个成分应被重点关注,为Q-Marker筛选提供参考。本研究通过查阅《中国药典》和相关文献,对红参、熟地黄、党参、山楂中可能成为Q-Marker的成分进行收集筛选,扩充FEJ Q-Marker的选择。红参和熟地黄是组方中的臣药。其中《中国药典》2020年版中使用人参皂苷Rb1、Re、Rg1作为红参指标成分,将这些指标成分纳入到后续研究中。党参和山楂是组方中的佐使药。党参能够提高造血机能、抗疲劳、增强机体免疫力等,其主要活性成分党参炔苷[31-33]。《中国药典》2020年版收载了党参以党参炔苷为对照的薄层鉴别方法,专属性好,因此选定党参炔苷进一步研究。同时将山楂含量测定的指标成分枸橼酸纳入后续研究中。
分子对接技术作为一种快速的活性验证方法,已被广泛应用于药材饮片、中药复方等活性成分的筛选和验证中[34-35]。分子对接结果显示,异毛蕊花糖苷、党参炔苷、绿原酸、毛蕊花糖苷4个成分是FEJ治疗贫血症的活性成分,可作为Q-Marker。
结合化合物来源的专属性以及含量可测性等因素,选定异毛蕊花糖苷和党参炔苷为FEJ的Q-Marker。这2个成分传递和溯源明确、具有活性且专属性强,整体满足中药Q-Marker的五原则特征。
3.2 提取条件考察
FEJ的制备工艺采用红参、党参、熟地黄、山楂水煎煮的提取方法,化学成分组成复杂且多为大极性化合物。实验前期,在特征图谱和含量测定的供试品制备中,考察了不同提取溶剂,包括甲醇、乙醇、醋酸乙酯-正丁醇、乙腈对FEJ进行提取,以及不同溶解定容溶剂,包括水及30%、70%、100%甲醇对FEJ上清液残渣进行溶解。研究表明使用甲醇作为提取溶剂时,影响部分成分的提取,且基线不稳定;使用乙醇提取,色谱峰多,分离度差;使用醋酸乙酯-正丁醇(1∶1)和乙腈提取后,色谱峰分离度较好。由正丁醇沸点高,回收难度,因此采用乙腈提取的方法进行制备。此外,研究发现不同溶解溶剂对色谱峰影响差异不明显,其中30%甲醇复溶的色谱峰分离度较好,因此选用30%甲醇作为复溶溶剂。同时,优化了提取溶剂的体积和提取次数,保证含量测定中FEJ供试品能够被提取完全。
3.3 色谱条件考察
本研究对特征图谱和含量测定中的检测波长、流动相组成等色谱条件进行优化。在特征图谱研究中,利用二极管阵列检测器在190~400 nm在线扫描,记录并比较了不同波长下的特征图谱。在203 nm下检测到人参皂苷Rg1,然而由于响应值低(含量少,推测可能与复方中红参用量少有关),基线噪音影响较大,因此未选用203 nm作为检测波长。通过查阅文献以及DAD扫描显示,党参炔苷的最大吸收波长在270 nm左右[38],在检测波长270 nm下,色谱图显示前15 min受干扰严重,苯乙醇苷类成分反映不完整,因此未选用270 nm作为检测波长。在含量测定研究方法中,330 nm下色谱峰响应值和各峰峰高比例较好,色谱峰数目较多且分离度较好。党参炔苷在330 nm下紫外吸收极弱,因此,未在特征图谱中对其进行指认。综上,最终确定330 nm为检测波长。
本研究考察了5种流动相体系,包括乙腈-水、乙腈-0.05%甲酸水、乙腈-0.1%甲酸水、0.05%甲酸乙腈-0.05%甲酸水、0.1%甲酸乙腈-0.1%甲酸水。结果表明,当0.1%甲酸乙腈-0.1%甲酸水作为流动相体系时,共有峰峰型良好,分离度好,且以甲酸水溶液为水相时可以进一步改善各成分峰的峰形,效果最佳。此外,本实验也考察了不同柱温(25、30、35 ℃),不同体积流量(0.6、0.8、1.0 mL/min),结果发现,当柱温为30 ℃、体积流量为1.0 mL/min,检测波长为330 nm时,所得色谱峰的数目较多、峰形及分离度等方面均表现良好。
在含量测定研究中,利用二极管阵列检测器在190~400 nm在线扫描,得到异毛蕊花糖苷对照品在327 nm左右波长下有最大吸收;党参炔苷对照品在268 nm左右波长下有最大吸收。最终选定在检测波长330 nm下测定异毛蕊花糖苷,在检测波长270 nm下测定党参炔苷。对FEJ特征图谱的洗脱条件进行优化,在保证成分达到分离效果的同时,缩短检测时间。在该流动相洗脱条件下,异毛蕊花糖苷和党参炔苷出峰情况良好,分离度达到要求。
本研究提供了一种FEJ中Q-Marker研究的创新思路与方法,提升了FEJ质量控制水平。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 1322-1323.
[2] 金永志, 李梦帆, 黄荣, 等. 当归补血汤促进血管新生作用的研究进展 [J]. 中医药导报, 2019, 25(13): 109-111,117.
[3] 陈荣荣, 郭浩, 徐砚通, 等. 中药复方和有效成分对血管新生促进或抑制作用的研究进展 [J]. 中草药, 2013, 44(23): 3413-3421.
[4] 史永平, 刘发生, 孔浩天, 等. 利用斑马鱼模型研究丹红注射液及代表性成分的促进血管生成作用 [J]. 时珍国医国药, 2019, 30(11): 2588-2590.
[5] 王成, 龚莉虹, 郭朝成, 等. 模式生物斑马鱼在中药药效物质筛选中的应用进展 [J]. 中草药, 2019, 50(24): 6125-6134.
[6] 陈维武, 白玛卓玛, 郭胜亚, 等. 二十五味珍珠片对斑马鱼微血管功能的影响 [J]. 中国实验方剂学杂志, 2019, 25(13): 49-54.
[7] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(QMarker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
[8] Liu C X, Cheng Y Y, Guo D A,. A new concept on quality marker for quality assessment and process control of Chinese medicines [J]., 2017, 9(1): 3-13.
[9] 张铁军, 白钢, 陈常青, 等. 基于“五原则”的复方中药质量标志物(Q-marker)研究路径 [J]. 中草药, 2018, 49(1): 1-13.
[10] 彭平, 熊少哲, 张蓓, 等. 基于全方特征图谱质量表征的芩连制剂质量评价研究 [J]. 中草药, 2021, 52(5): 1312-1322.
[11] 许春芳, 崔莉莉, 鄢红霞, 等. 昆仙胶囊HPLC特征指纹图谱和多成分定量测定研究 [J]. 中草药, 2020, 51(24): 6213-6220.
[12] 张梦晨, 谢辉, 陆兔林, 等. 基于指纹图谱、化学计量学、网络药理学的半夏汤洗前后质量评价 [J]. 中草药, 2021, 52(10): 2897-2908.
[13] 高森, 王苹, 唐铖, 等. 基于HPLC指纹图谱、多指标成分含量测定及化学计量学的湿热痹片质量评价 [J]. 中草药, 2020, 51(21): 5454-5461.
[14] 陈晓璐, 郭振旺, 邓家刚, 等. 基于肉桂质量标志物(Q-Marker)预测的质量控制研究 [J]. 中草药, 2021, 52(9): 2707-2718.
[15] 李志立, 杨冰, 翟艳敏, 等. 基于分子对接技术虚拟筛选红花中抗心肌缺血活性组分 [J]. 中国中药杂志, 2020, 45(12): 2881-2890.
[16] 王玉, 杨雪, 靳晓杰, 等. 基于中医药整合药理学平台、GEO数据库芯片及分子对接探讨大黄抗肝癌的作用机制 [J]. 中草药, 2020, 51(20): 5207-5219.
[17] 净晶, 张吉发, 李慧, 等. 长花党参化学成分的研究 [J]. 时珍国医国药, 2013, 24(10): 2340-2342.
[18] 冯蓬, 甘东浩, 王卫国, 等. 基于网络药理学的熟地黄干预骨质疏松症分子机制研究 [J]. 山东中医杂志, 2020, 39(2): 177-184.
[19] Tao J H, Zhao M, Ling Y,. UPLC-Q-TOF/MS-based metabolic profiles of bioactive components inandherb pair by rat intestinal bacteria [J]., 2017, 9(2): 147-152.
[20] Ali M B, Hahn E J, Paek K Y. CO2-induced total phenolics in suspension cultures ofC. A. Mayer roots: Role of antioxidants and enzymes [J]., 2005, 43(5): 449-457.
[21] Chung I M, Lim J J, Ahn M S,. Comparative phenolic compound profiles and antioxidative activity of the fruit, leaves, and roots of Korean ginseng (Meyer) according to cultivation years [J]., 2016, 40(1): 68-75.
[22] 赵博, 田恒康, 孙道涵, 等. 基于酚类特征图谱的山楂质量表征关联分析研究 [J]. 北京中医药大学学报, 2017, 40(8): 684-692.
[23] 邹献亮, 陈颋, 华腊, 等. 一测多评法同时测定熟地黄中4种苯乙醇苷 [J]. 中成药, 2019, 41(5): 1085-1090.
[24] Shen L J, Chen H L, Zhu Q F,. Identification of bioactive ingredients with immuno-enhancement and anti-oxidative effects from Fufang-Ejiao-Syrup by LC-MSncombined with bioassays [J]., 2016, 117: 363-371.
[25] 张万年. 益气安神膏治疗气血两虚型慢性疲劳综合征的临床研究 [D]. 广州:广州中医药大学, 2018.
[26] 马婧, 陈茜, 边亚倩, 等. 基于系统中药学的丹参活血化瘀功效标志物研究 [J]. 中国中药杂志, 2020, 45(14): 3259-3265.
[27] 刘美凤, 蒋利荣, 刘华鼐, 等. 番石榴叶抗Ⅱ型糖尿病活性成分的虚拟筛选 [J]. 华南理工大学学报: 自然科学版, 2011, 39(3): 28-31.
[28] 中国药典 [S]. 四部. 2020: 480-483.
[29] 彭任, 陆兔林, 胡立宏, 等. 中药饮片质量标志物(Q-marker)研究进展 [J]. 中草药, 2020, 51(10): 2603-2610.
[30] 陈丽华, 肖发林, 黄诗雨, 等. 中药质量评价研究思路及创新发展趋势 [J]. 中草药, 2021, 52(9): 2541-2547.
[31] 廖江敏, 李林玉, 瞿云安, 等. 党参药材活性成分党参炔苷的化学稳定性研究 [J]. 天然产物研究与开发, 2020, 32(3): 385-388.
[32] Zhang P, Hu L H, Bai R B,. Structural characterization of a pectic polysaccharide fromand its immunomodulatory activitiesand[J]., 2017, 104(Pt A): 1359-1369.
[33] Zhao X N, Hu Y L, Wang D Y,. The comparison of immune-enhancing activity of sulfated polysaccharidses fromand[J]., 2013, 98(1): 438-443.
[34] 龚曼, 杨联河, 朱利利, 等. 鄂西香茶菜甲素作为抗肿瘤先导物的发现与抗肿瘤活性验证 [J]. 中国中药杂志, 2021, 46(16): 4061-4068.
[35] 郭锦晨, 王茎, 孙宇洁, 等. 基于网络药理学及分子对接探讨桑叶-菊花治疗高血压的作用机制 [J]. 天然产物研究与开发, 2021, 33(5): 847-858.
[36] 郑昆, 伦志彩, 罗兆亮. 超高效液相色谱-波长切换法同时测定健脾丸(浓缩丸)中4种成分的含量 [J]. 食品与药品, 2021, 23(2): 142-146.
Study of quality markers of Fufang E’jiao Jiang based on characteristic spectrum, chemometrics and molecular docking
XU Xiao1, ZHANG Yan2, REN Xue-yang1, WANG Yu1, DONG Ying1, SONG Ruo-lan1, YU A-xiang1, WEI Jing1, MA Jia-mu1, SHE Gai-mei1
1. School of Chinese Pharmacy, Beijing University of Chinese Medicine, Beijing 100102, China 2. National Engineering Research Center for Gelatin-based Traditional Chinese Medicine, Dong-E-E-Jiao Co., Ltd., Liaocheng 252201, China
Guided by the “Five Principles” of quality markers (Q-Marker), combined with characteristic spectrum, chemometrics and molecular docking and content determination, developed Q-Marker for the treatment of anemia with Fufang E'jiao Jiang (复方阿胶浆, FEJ).The characteristic spectrum of FEJ was determined by HPLC using Agilent Zorbax SB AQ-C18column. The mobile phase was 0.1% formic acid acetonitrile-0.1% formic acid water, and the flow rate was 1.0 mL/min, detection wavelength was 330 nm. Sixteen batches of FEJ characteristic spectrum were established with jionoside A1as the reference peak. Based on the results of common peak area determination of characteristic spectrums, the quality of different batches of FEJ was evaluated by hierarchica cluster analysis (HCA), principal components analysis (PCA) and partial least squares-discrimination analysis (PLS-DA). Six key components were collected from each herb inand literatures. The differential genes of anemia was searched in the GEO database, and Discovery Studio software was used to verify the components in FEJ. The content of two components in 16 batches was determined at the same time at 330 nm and 270 nm.There were eight components were identified, namely caffeic acid, chlorogenic acid, purpureaside C, ferulic acid, jionoside A1, acteoside, jionoside B1, isoacteoside. The results of HCA, PCA and PLS-DA showed that 15 batches of FEJ can be divided into three categories. Isoacteoside, purpureaside C, and jionoside A1were contributing to the quality difference between different batches of FEJ. The results of molecular docking showed that isoacteoside, lobetyolin, chlorogenic acid, and acteoside can bind to six key targets such as KNG1, ISG15, KDM6A, DNM3, F2RL1, and CYSLTR1 through hydrogen bonds, hydrophobic bonds, π-π bonds, etc. They can be used as Q-Markers of FEJ. The contents of isoacteoside and lobetyolin in 16 batches of FEJ were 6.05—12.30 μg/mL and 9.14—16.30 μg/mL, respectively.Q-Markers in FEJ was explored by characteristic spectrum, chemometrics and molecular docking, which can be used for quality control and evaluation of FEJ.
Fufang E’jiao Jiang; quality markers (Q-Markers); characteristic spectrum; chemometrics; molecular docking; anemia; hierarchical cluster analysis; principal components analysis; partial least squares-discrimination analysis; quality control; caffeic acid; chlorogenic acid; purpureaside C; ferulic acid; jionoside A1; acteoside; jionoside B1; isoacteoside
R283.6
A
0253 - 2670(2021)23 - 7148 - 14
10.7501/j.issn.0253-2670.2021.23.009
2021-06-16
国家重点研发计划(2018YFC1707300);国家重点研发计划项目(2018YFC1706300)
许 啸(1995—),女,硕士研究生,研究方向为中(民族)药药效成分和新药创制研究。Tel: 13521701679 E-mail: xux_26@163.com
折改梅(1976—),女,研究员,博士生导师,研究方向为中(民族)药药效成分和新药创制研究。Tel: (010)53912129 E-mail: shegaimei@126.com
[责任编辑 郑礼胜]
